草鱼源嗜水气单胞菌的毒力与耐药性检测
2019-04-29
(河南师范大学水产学院河南新乡453007)
草鱼 (Ctenopharyngodon idellus)是四大家鱼之一,肉质鲜美,经检测含有大量的不饱和脂肪酸,有利于人体血液循环,因此是广大消费者餐桌上较常见的鱼类之一;其次,草鱼个体较大,生长迅速,是我国重要的淡水养殖鱼类[1]。但由于近年来草鱼的养殖规模和养殖地区的不断扩大以及生态环境的恶化,草鱼因感染细菌性病原而致病的事例逐渐增多[2]。
嗜水气单胞菌(Aeromonas hydrophila)属于弧菌科,气单胞菌属,能从自然水体、土壤和鱼体中分离检测到,是水产动物的条件致病菌,在鱼体抵抗力下降或者环境条件恶劣时感染鱼类可导致斑点叉尾鮰(Ictalurus punetaus)套肠病、腹水病,淡水养殖鱼类患危害性较大的细菌性败血症,中华鳖(Trionyx sinensis)患红底板病、腐皮病等[3-7],也能感染鸟类、爬行类和两栖类动物致使其出现不同程度的发病症状[8]。在一定条件下,人类感染嗜水气单胞菌后,出现腹泻、肠炎等疾病,严重者导致败血症[9]。嗜水气单胞菌为目前普遍存在的一种人-畜-水生动物共患病原菌[10]。2017年5月份,新乡郊区某渔场养殖的草鱼出现腹部膨大,红肿出血等症状,为查明该渔场草鱼死亡原因,本实验对分离纯化的病原菌进行了形态观察、人工感染、gyrB基因鉴定以及药敏试验,旨在为草鱼感染细菌性疾病的科学防控提供一定的参考。
1 材料与方法
1.1 实验鱼
本研究所用患病草鱼鱼体质量为84-96 g,体长14-16 cm,取自新乡郊区某养殖场,发病症状表现为鳃丝末端腐烂,腹部膨大,肝脾糜烂。
供试鲫鱼(Carasstus anratus)取自河南师范大学水产养殖基地,鱼体质量为18-24 g,体长10-11 cm。选取体质健康的个体用于人工感染实验。
1.2 细菌分离鉴定
1.2.1 细菌分离
在无菌条件下使用接种环蘸取发病草鱼的脾脏、肝脏等组织,分别划线接种于TSA培养基上进行分离纯化培养,选取代表性菌株AH-16进行常规革兰氏染色,使用光学显微镜观察分离菌株的染色特性。
1.2.2 人工感染
供试鲫鱼暂养7天,挑选体质健康的50尾个体,将其随机分为5组,放在直径为60 cm、深度为100 cm的圆桶里,水温保持在25±1℃,不喂食,每天换1/3水。将分离菌株AH-16按照等对数间距设置实验浓度梯度,配制成7.90×107cfu/mL、1.96×107cfu/mL、4.94×106cfu/mL、1.24×106cfu/mL 4个梯度的菌悬液,按200 μL/尾的剂量分别对供试鲫鱼进行腹腔注射,腹腔注射200 μL的无菌生理盐水,攻毒后定时查看鲫鱼的存活情况以及做好记录,饲养观察2周。并根据攻毒后不同浓度菌悬液下的死亡情况,计算死亡率,且该病原菌的半致死浓度LD50值参照半数效量累积法(Reed-Muench法)[11]进行计算。
1.2.3 gyrB基因的PCR扩增
使用CTAB法提取纯化细菌的基因组DNA[12],PCR扩增所用引物gyrB-F:5'-TCCGGCGGTCTGCACGGCGT-3',gyrB-R:5'-TTTCCGGGTTGTACTCGTC-3'。反应体系:2×Es Mix 10 μL、DNA 1 μL、上下游引物各1 μL、添加ddw 至20 μL。PCR的反应条件为:94℃预变性4 min,94℃变性30 s,58℃退火30 s,72℃延伸60 s,72℃终延伸 10 min。扩增产物经1.5%琼脂糖凝胶电泳,出现特异性良好的目的条带,将PCR产物送至上海生工生物公司进行测序把测序结果进行BLAST搜索,使用MEGA 6.0软件构建系统进化树。
1.3 药敏试验
选用阿莫西林、罗红霉素、奈啶酸、复方新诺明、头孢噻肟、妥布霉素等22种抗菌药物,药敏试验按照常规纸片扩散(K-B)法进行操作[13],首先制备优势菌株AH-16的菌悬液,向菌悬液中加入经高温灭菌的生理盐水稀释为1×108cfu/mL,然后吸取100 μL稀释后的菌悬液均匀涂布于MH琼脂平板,把药敏纸片分别贴到经自然晾干的培养基上,每一个平板贴3片相同的药敏纸片,28℃恒温过夜培养,测量抑菌圈的直径,结果取3个数值的平均数。分离菌株的药敏纸片结果分析参照文献[14-15]中的标准进行判定。
2 结果与分析
2.1 菌株鉴定
2.1.1 分离菌的特征
从患病草鱼体内分离的细菌接种到TSA培养基上经过纯化培养后获得一批形态一致的优势菌,菌落形态为卵圆形、边缘光滑、乳白色,中央隆起(图1)。革兰氏染色阴性,呈短杆状,两端钝圆,排列形式为单个或多个,细菌大小长约1-2 μm(图2)。
2.1.2 人工感染

图1 分离菌株AH-16的菌落形态Fig.1 Colony morphology of isolated strain AH-16

图2 分离的菌株AH-16的革兰氏染色结果Fig.2 Gram staining results of isolated strainAH-16
将配制好的不同浓度的菌悬液对健康鲫鱼进行腹腔注射后,鲫鱼的死亡情况详见表1,结果显示,菌悬液浓度为7.90×107cfu/mL实验组的鲫鱼48 h内死亡率达100%,死亡鲫鱼发病症状与新乡郊区某养殖场自然发病的草鱼的症状类似,主要表现为鳃丝末端腐烂,腹部膨胀,胸部出血,肝脾糜烂。1.96×107cfu/mL浓度组的鲫鱼48 h内死亡率为80%;菌悬液浓度为4.94×106cfu/mL和1.24×106cfu/mL实验组中,鲫鱼在48 h内均未出现死亡现象;对照组在48 h内全部没有死亡。使用Reed-Muench法计算出分离菌AH-16对鲫鱼的LD50为1.2×107cfu/mL。
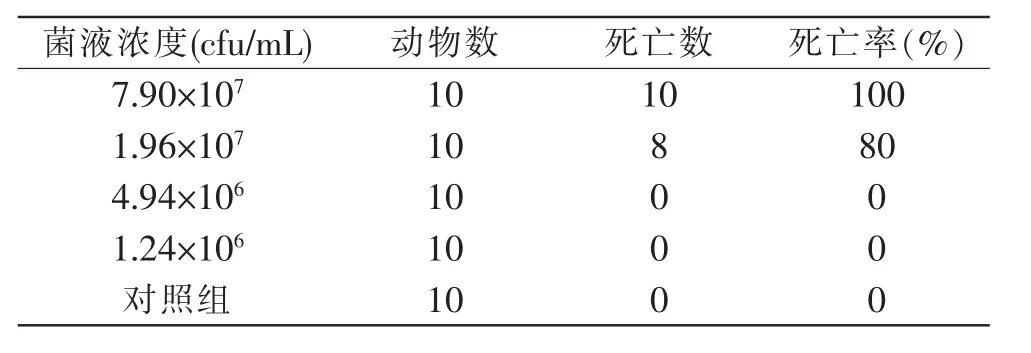
表1 鲫鱼的人工感染试验Table 1 Artificial infection test of healthy Crucian carp
2.1.3 gyrB基因的PCR扩增
分离菌株AH-16的PCR检测结果如图3所示,由图3可知,PCR扩增获得了大小约为1100 bp的目的基因,与预期扩增片段大小相符。将测序结果进行Blast搜索,使用MEGA 6.0建立系统进化树(图4),结果显示分离菌株AH-16与嗜水气单胞菌标准株(HQ326180.1)的同源相似度为99%,嗜水气单胞菌和分离菌株AH-16在系统进化树中聚为一支,则该致病菌AH-16为嗜水气单胞菌。
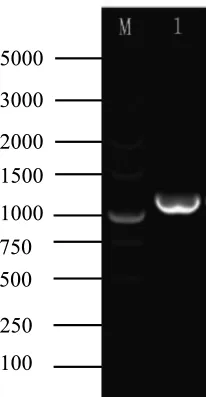
图3 分离菌株AH-16的PCR检测结果注:M为DL5000 Marker;1为分离菌株的PCR检测结果Fig.3 PCR detection results of isolated strain AH-16Note:M is DL 5000 Marker;1 is the PCR detection result of the isolated strain
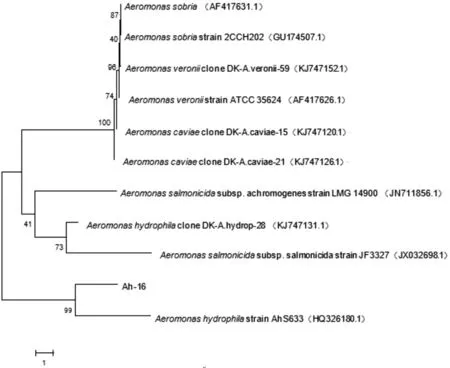
图4 分离菌株AH-16的gyrB基因序列系统进化树Fig.4 Syetematic phylogenetic tree of gyrB gene sequence of isolated strain AH-16
2.2 药敏试验
通过纸片扩散法测试了菌株AH-16对22种药物的敏感性,具体结果详见表2。结果显示,AH-16对头孢噻肟、链霉素、庆大霉素、卡那霉素、新霉素、四环素、强力霉素、氯霉素、复方新诺明、恩诺沙星和萘啶酸等11种药物敏感;中度敏感的抗菌药物有红霉素、妥布霉素、多黏菌素B;而对青霉素G、阿莫西林、头孢氨苄、头孢唑啉、头孢拉定、罗红霉素、磺胺异恶唑、利福平等8种抗生素产生耐药。
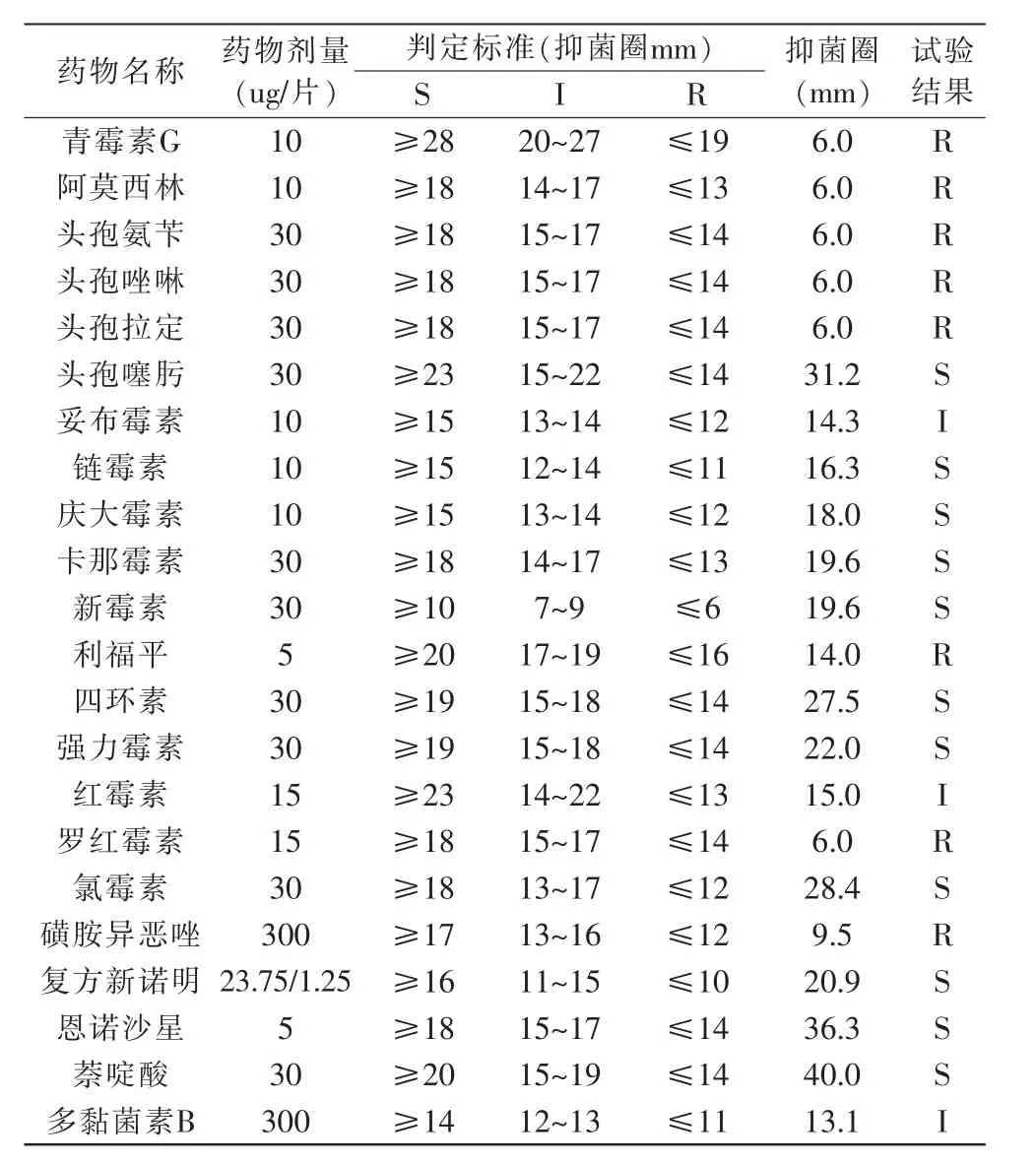
表2 AH-16对不同抗生素的敏感性Table 2 Sensitivity of Pathogen AH-16 to different Antibiotics
3 讨论
3.1 嗜水气单胞菌的致病性
近年来随着我国养殖产量和养殖品种不断增加,水产动物疾病也频繁发生,其中最为常见的是由气单胞菌属细菌感染引起的细菌性鱼病。气单胞菌属细菌是自然环境中的常在菌,养殖水体、污水、土壤和水生动物体表都能人为分离检测到嗜水气单胞菌,在特定条件下,可使水产动物致病,当鱼体抵抗力下降、体表损伤或环境条件恶劣等条件下可导致其发病。研究显示,鱼类、牛蛙、龟鳖等水产养殖动物如果被嗜水气单胞菌感染后都能患病,若伴随养殖环境恶化,则可出现爆发性死亡[16]。在本研究中,利用从患病草鱼体内分离出的嗜水气单胞菌AH-16对健康鲫鱼人工感染,结果显示嗜水气单胞菌可以在较短时间内使鲫鱼出现大量死亡现象,且出现死亡的鱼体表现出肝脾糜烂,出血,肠道出血发红等与自然发病草鱼的症状一致,可以确定AH-16菌株是导致草鱼患病的病原菌。攻毒结果显示,嗜水气单胞菌对鲫鱼的LD50值为1.2×107cfu/mL,参照濮俊毅等[17]研究中对细菌毒力的判定标准,LD50在106-107cfu/mL内的菌株则具有较强的毒力,显示本研究中患病草鱼分离菌AH-16具有较强的致病力。细菌的致病性取决于溶血素、S层蛋白及胞外蛋白酶[15]等毒力因子,嗜水气单胞菌产生的毒素可引起生物体广泛而复杂的病理变化,以体表和内脏器官的急性出血症状为多,从AH-16菌株的人工感染中可见,嗜水气单胞菌对健康鲫鱼有较强的致病性。
3.2 嗜水气单胞菌病的科学防治
嗜水气单胞菌病对水产养殖业危害严重,养殖者深受该疾病困扰。由于抗菌药物的使用具有操作简单、成本较低、效果较好的特点,在相当长的时期内抗菌药物的使用仍是水产养殖细菌性疾病防治的常用方法,但是由于养殖者在养殖过程中对抗菌药物的不合理使用,致使耐药细菌的出现,进而影响到疾病治疗效果。本实验采用22种抗菌药物对病原菌AH-16进行药敏试验,结果显示:AH-16对头孢噻肟、链霉素、庆大霉素、卡那霉素、新霉素、四环素、强力霉素、氯霉素、复方新诺明、恩诺沙星和萘啶酸等11种药物敏感(其中氯霉素为国家禁用药物,因此氯霉素仅用于本次药物敏感试验),而对8种抗菌药物表现出耐药,显示出嗜水气单胞菌AH-16为一种多重耐药性菌株,对多种抗菌药物产生抗性。因此在实际生产中可在对分离菌株有抑制作用的药物中选择一种或者几种符合国标的药物对养殖鱼体进行治疗。
嗜水气单胞菌的来源不同,对抗生素的敏感程度也有差异,徐先栋等[18]的研究显示嗜水气单胞菌对新霉素、四环素、氯霉素敏感;陈言峰等[19]研究的研究结果表明,嗜水气单胞菌对庆大霉素、强力霉素敏感,而对利福平耐药;而梁利国等[20]的报道显示嗜水气单胞菌对链霉素和复方新诺明表现出高度的敏感,对阿莫西林表现耐药。杨宁等[21]的实验显示嗜水气单胞菌对恩诺沙星、复方新诺明耐药,对妥布霉素敏感。综合不同研究者结果的差别可知,养殖地条件、养殖种类和用药方法的差异导致病原菌所处的环境有所不同,从而在药敏试验检测中出现不同的结果。随着养殖技术的提高和养殖密度增加,水产养殖中疾病频发,对于一些细菌性疾病,养殖者通常使用抗菌药物进行控制,但由于长期使用单一种类的抗菌药物,致使病原菌对某些抗生素产生耐药性,且造成养殖环境的污染,因而养殖过程中暴发的疾病越来越难以防治。因此,养殖中对细菌性疾病的防治既要考虑病原菌对药物的敏感性,也要根据渔药的相关规定合理用药。在选择和使用抗生素时应严格按照相关规定进行,为了提高抗生素的使用效果,减少细菌性病原对药物产生耐药性,更不应该长期使用同一种抗生素,应做到科学且精准使用抗菌药物。
