白藜芦醇治疗炎症性肠病的研究进展
2019-04-29陈香许新微张朝阳赵明1
陈香,许新微,张朝阳,赵明1,*
(1.江苏大学药学院,江苏 镇江212013;2.镇江市食品药品监督检验中心,江苏 镇江212050;3.江苏大学医学院,江苏 镇江212013;4.太仓市中医医院检验科,江苏 苏州215400)
炎症性肠病(inflammatory bowel disease,IBD)是一组由环境、遗传、感染以及免疫等因素相互作用导致的肠道黏膜免疫系统异常反应的疾病,主要包括溃疡性结肠炎(uclerative colitis,UC)和克罗恩病。IBD的病变多发生于直肠和乙状结肠,并可迁延至结肠,进而导致整个结肠病变,临床症状主要以腹泻、黏液脓血便、腹痛及里急后重为主,以结肠黏膜慢性炎症和溃疡形成为病理特点[1]。近年来,因发病率不断升高、难以彻底治愈且长期迁延不愈易诱发肿瘤等特点,IBD已成为消化病研究的热点和难点之一。目前临床上治疗IBD的主要方法有传统药物及免疫抑制剂治疗、生物制剂治疗、微生态制剂治疗、抗生素治疗以及手术治疗等。但是,上述药物均具有一定的不足之处。寻找高效、安全的治疗IBD的新型药物已成为一项迫切任务。白藜芦醇是一种具有抗炎、抗氧化作用的天然二苯乙烯类活性物质[2]。近年来的研究显示,白藜芦醇具有治疗IBD的作用[3]。本文就白藜芦醇对IBD治疗作用的研究进展进行综述,并展望白藜芦醇治疗IBD的发展前景。
1 白藜芦醇的理化性质
白藜芦醇又称芪三酚,化学名称是3,5,4’-三羟基苯二烯,分子式是C14H12O3,结构式见图1,相对分子量为228.24,呈无味、灰白色或白色粉末,较难溶于水,易溶于有机溶剂。在低温、避光条件下白藜芦醇较为稳定,碱性环境中不稳定[4]。白藜芦醇以顺式-/反式游离态和顺式-/反式糖苷结合态等形式存在,是一种具有天然活性的多酚类单体化合物。
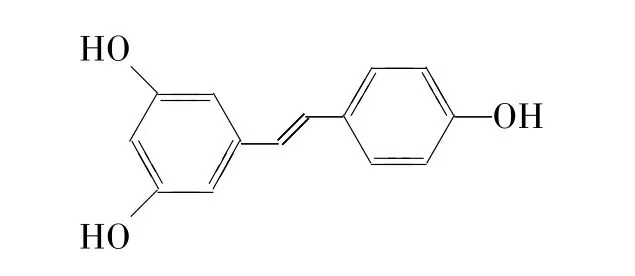
图1 白藜芦醇结构式
2 白藜芦醇对免疫细胞的调节作用
2.1 白藜芦醇对T细胞的免疫调节作用
Gao等[5]的实验显示,25μmol/L白藜芦醇对经有丝分裂原/抗原激活的T细胞增殖的抑制率达90%。Falchetti等[6]的研究显示,白藜芦醇对T细胞的免疫调节作用具有剂量依赖性,低浓度(0.625~0.25μg/mL)的白藜芦醇可刺激CD4+/CD8+T细胞中细胞因子IL-2、IL-4以及核转录因子(INFγ)的表达和分泌,高浓度(10μg/mL)时则能抑制CD4+/CD8+T细胞分泌细胞因子;同样,低浓度的白藜芦醇能够激活细胞毒性T细胞的细胞毒活性,而高浓度则具有抑制作用。此外,白藜芦醇对CD8+T细胞分泌细胞因子的抑制效果比对CD4+T细胞的抑制更好。Radkar等[7]的研究显示,当白藜芦醇浓度≥25μmol/L时会激发细胞毒性T细胞的特异性杀伤潜能。Feng等[8]研究显示,低剂量白藜芦醇能增强T细胞介导的免疫反应。Sharma等[9]也报道了白藜芦醇能够抑制T细胞活性的实验结果。
2.2 白藜芦醇对外周血单个核细胞(PBMC)的免疫调节作用
Seyyedebrahimi等[10]每天使用800 mg白藜芦醇对48例2型糖尿病患者连续8周进行口服治疗,结果显示,白藜芦醇在患者PBMC中具有抗氧化剂的作用。Boscolo等[11]的研究显示,高浓度白藜芦醇能显著抑制植物血凝素刺激引起的PBMC增殖,并且PBMC分泌的细胞因子INF-γ和TNF-α量亦受到显著抑制。但是,当白藜芦醇浓度低至10~100 nmol/L时,对细胞增殖的抑制作用消失。Capeleto等[12]研究显示,白藜芦醇通过Ala16Val-SOD2 SNP途径活化人PBMC。但也有研究显示白藜芦醇可促进某些炎性因子的表达。Gualdoni等[13]研究显示,白藜芦醇可显著提高PBMC表达细胞因子TNF-α。
2.3 白藜芦醇对B细胞的免疫调节作用
Jhou等[14]的研究显示,白藜芦醇通过上调B细胞中FcγRIIB的表达从而选择性地降低B细胞数量,缓解狼疮性肾炎。Zunino等[15]使用不同浓度白藜芦醇处理经有丝分裂原作用的B细胞,结果显示低浓度白藜芦醇(2和5 nmol/L)能促进B细胞增殖,而高浓度白藜芦醇(10 nmol/L)抑制B细胞的增殖,但是B细胞中Bcl-2和caspase-3的表达水平随白藜芦醇浓度的增加而升高,呈一定的剂量依赖性。Wang等[16]从系统性红斑狼疮模型建立第2天起给予建模小鼠白藜芦醇口服,连续7个月,结果显示白藜芦醇对B细胞的增殖以及抗体的产生等均具有抑制作用。此外,Sharma等[9]也报道了白藜芦醇具有抑制B细胞活性的作用。
2.4 白藜芦醇对巨噬细胞的免疫调节作用
Ma等[17]使用白藜芦醇作用于经脂多糖刺激的RAW264.7小鼠巨噬细胞,结果显示白藜芦醇能下调诱导型一氧化氮合酶(iNOS)和IL-6的表达,而且,以剂量依赖的形式抑制NO的产生和IL-6的分泌。白藜芦醇也抑制HMGB1从胞核向胞质转运以及核转录因子κB(NF-κB)p65从胞质入核,抑制了IκBα的磷酸化。白藜芦醇对巨噬细胞的上述作用均是通过抑制STAT-1和STAT-3的磷酸化实现的[17]。Wang等[18]的研究显示,白藜芦醇能降低巨噬细胞TNF-α的表达水平以及主要的前炎症因子的分泌,增加M2型巨噬细胞相关基因信使RNA的表达。Yang等[19]的研究显示,白藜芦醇可抑制肺泡巨噬细胞的凋亡并降低其细胞因子的表达。
2.5 白藜芦醇对树突状细胞(DC)的免疫调节作用
Kim等[20]的研究显示,白藜芦醇显著抑制骨髓来源的DC细胞表达共刺激分子CD80和CD86、MHC-I和MHC-II。白藜芦醇也明显抑制了脂多糖刺激的DC细胞产生胞内IL-12 p40/p70和分泌IL-12 p70的能力。白藜芦醇处理的DC细胞通过甘露糖受体介导的内吞作用高效捕获抗原。此外,白藜芦醇可抑制DC细胞对单纯异基因T细胞增殖的刺激作用,并在反应性T细胞中诱导低水平的IL-2分泌。Buttari等[21]的研究显示,白藜芦醇可阻止DC细胞在糖基化过程中成熟。Svajger等[22]的研究显示,白藜芦醇诱导DC细胞介导的免疫耐受,尤其是在DC细胞分化过程中使用白藜芦醇处理效果更好。白藜芦醇可使DC细胞的共刺激分子CD40、CD80和CD86表达下调,诱导ILT3和ILT4的表达,但不影响HLA-G的表达。经白藜芦醇处理的DC细胞活化后失去产生IL-12p70的能力,但是产生IL-10的能力增强。
此外,白藜芦醇还对NK 细胞具有调节作用[23]。上述的国内外研究阐明了白藜芦醇对免疫细胞的调节作用以及可能机制。下面将进一步综述白藜芦醇对由免疫细胞参与炎症反应的IBD的作用以及可能的机制。
3 白藜芦醇对IBD的作用及其机制
3.1 白藜芦醇对IBD的作用
近年来的研究显示,白藜芦醇能够有效缓解不同动物IBD模型的症状。Abdallah等[24]使用白藜芦醇(2和10 mg/kg体重)连续7 d通过口服处理三硝基苯磺酸(trinitrobenzene sulfonic acid,TNBS)诱导的IBD Wistar大鼠,结果显示白藜芦醇处理组大鼠较阳性组大鼠的溃疡区域面积明显减小,结肠质量指数下降,结肠组织髓过氧化物酶(myeloperoxidase,MPO)活性下降,GSH、丙二醛和NO水平降低,结肠组织和血清中ICAM-1和VCAM-1的表达水平降低。Yildiz等[25]将白藜芦醇(10 mg/kg体重)通过腹腔注射的给药方式处理TNBS诱导的IBD Wistar大鼠,结果显示,与阳性组大鼠相比,白藜芦醇处理组大鼠的结肠镜检评分下降,结肠丙二醛水平降低,但MPO、超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶的活性无明显变化,结肠GPX活性升高。Arslan等[26]采用甲氨蝶呤诱导Wistar大鼠构建IBD模型,将白藜芦醇(25 mg/kg体重)通过口服给药方式连续30 d处理模型组大鼠,结果显示,白藜芦醇处理组大鼠十二指肠和空肠丙二醛、GSH和8-OH/Gua水平比阳性组大鼠显著降低,而且MPO mRNA表达水平也明显下降。Abdin等[27]将白藜芦醇(10 mg/kg体重)通过口服给药的方式连续14 d处理恶唑酮诱导的Wistar大鼠构建UC模型,结果显示,白藜芦醇处理组大鼠的DAI指数下降,结肠SphK1表达水平降低,结肠MPO活性以及组织病理学损伤分数下降。Larrosa等[28]使用葡萄糖硫酸钠(dextran sulfate sodium,DSS)诱导Fischer F344大鼠构建克罗恩病模型,将剂量为1 mg/kg体重的白藜芦醇以口服方式连续处理模型组大鼠25 d,结果显示,与阳性组大鼠相比,经过白藜芦醇处理的大鼠结肠长度缩短,结肠组织病理学损伤分数减小,结肠中COX-2、前列腺素E2(prostaglandin E2,PGE2)以及NO的蛋白表达降低。Rahal等[29]采用肽聚糖-多糖诱导Lewis大鼠构建克罗恩病模型,将40或100 mg/kg体重剂量的白藜芦醇以灌服方式连续处理大鼠28 d,结果显示白藜芦醇处理的大鼠盲肠组织IL-1β的mRNA表达水平比阳性组大鼠明显降低,而盲肠中IL-6、TNF-α和TGF-β1的表达水平显著升高。
Sharma等[30]采用DSS诱导C57BL/6小鼠构建IBD模型,将100 mg/kg体重的白藜芦醇以隔天灌服的方式连续10 d处理IBD小鼠,结果显示,与阳性组相比,经白藜芦醇处理的小鼠结肠更长,结肠中TNF-α转化酶(TNF-α converting enzyme,TACE)mRNA表达水平下降,TIMP3和沉默信息调节因子2相关酶1(Silent mating type information regulation-1,SIRT1)mRNA表达水平升高。Yao等[31]采用DSS诱导BALB/c小鼠,构建IBD小鼠模型,将30或60 mg/kg体重的白藜芦醇以口服的方式连续14 d处理IBD小鼠,结果显示,与阳性组小鼠相比,经白藜芦醇处理的小鼠结肠组织学疾病评分下降,结肠丙二醛水平和MPO、SOD和GPX活性降低,IL-8、TNF-α和IFN-γ的mRNA及蛋白表达水平下降。Youn等[32]以口服的方式连续7 d将10 mg/kg体重的白藜芦醇处理经DSS诱导的IBD ICR模型小鼠,结果显示,经白藜芦醇处理的小鼠结直肠长度伸长,结肠中iNOS含量下降,NF-κB和IκB表达水平降低,而ERK和STAT3的磷酸化水平下降。Altamemi等[33]以口服的方式连续5周将100 mg/kg体重的白藜芦醇处理经DSS诱导的IBD ApcMin/+模型小鼠,结果显示白藜芦醇处理的小鼠结肠息肉大小和数量下降,BrdU和PCNA阳性结肠细胞数减少;结肠COX-2和IL-6的mRNA表达降低,TNF-α表达水平降低,T细胞、B细胞、MDSC以及NK细胞数量下降,肠道黏膜中microRNA-455和microRNA-101b的表达升高。
目前有关白藜芦醇对IBD治疗作用的临床试验较少。最近,一项随机、双盲、安慰剂对照临床试验评估了白藜芦醇对炎症生物标志物和UC患者生活质量的影响。在该研究中,患者每天服用白藜芦醇0.5 g,连续6周后,血浆C-反应蛋白、TNF-α和NF-κB p65水平降低。患者生活质量得到改善,临床结肠炎活动指数显著降低[34]。此外,在轻至中度UC患者体内,SOD活性和总抗氧化能力提高,但服用白藜芦醇的患者丙二醛水平降低[35]。
3.2 白藜芦醇对IBD的作用机制
3.2.1 白藜芦醇抗炎作用的机制 IBD患者肠道组织中均存在炎症反应。参与炎症反应的免疫细胞会分泌多种促炎因子,破坏肠道组织的正常结构,影响肠道功能。NF-κB是能与多种免疫球蛋白轻链基因启动子κB序列特异性结合并促进其转录的一类蛋白质。NF-κB可调节多种促炎因子的表达,进而影响炎症的发生与发展[36]。因此,通过下调NF-κB的活性抑制炎症反应也就成为治疗IBD的重要手段。Youn等[32]的实验显示,在DSS诱导的小鼠IBD模型中,口服白藜芦醇能抑制NF-κB的活化,减少NF-κB下游促炎因子的产生,进而减轻炎症对肠道组织的损伤。体外细胞实验也证实了白藜芦醇可以剂量依赖的方式降低NF-κB活性,进而降低COX-2基因表达水平[37]。白藜芦醇能通过抑制NF-κB磷酸化及其降解的途径来降低炎性因子TNF-α、IL-6以及COX-2等的表达[38]。SIRT1可与NF-κB蛋白质分子中的RelA/p65亚基结合,导致SIRT1在Lys310位点去乙酰化进而抑制NF-κB的转录活性[39]。这也说明NF-κB的活性受SIRT1去乙酰化作用的调控。那么白藜芦醇可否通过诱导SIRT1的活化并上调其活性、下调NF-κB活性这一途径发挥抗炎作用?Singh等[40]的研究显示,白藜芦醇可通过上调结肠免疫细胞中作为NF-κB激活和炎症的逆向调节器的SIRT1预防结肠炎。Dong等[41]的研究显示,白藜芦醇以iNOS-NO依赖方式通过SIRT1-NF-κB途径减轻肠道亚急性缺血再灌注(ischemia-reperfusion,I/R)损伤。
以L-精氨酸为底物,NOS可通过3种形式合成NO。在3种同工酶亚型中,iNOS在炎症反应的调控中起着重要作用。越来越多的证据表明,白藜芦醇能够通过NO-依赖性的方式缓解由I/R导致的肠系膜动脉等组织损伤[41]。那么白藜芦醇是否可通过调控NO的表达实现其在IBD中的抗炎作用呢?1999年Tsai等[42]报道,在经脂多糖激活的RAW 264.7细胞中,白藜芦醇可能通过下调NF-κB的结合活性来抑制炎症中增强的iNOS表达,进而显著抑制NO的产生。此后,相继有不同的研究支持上述结果[43-45]。Youn等[32]以口服白藜芦醇的给药方式处理经DSS诱导的IBD模型,实验结果显示白藜芦醇可下调iNOS的表达水平并减弱NF-κB、STAT3以及ERK的活化,减轻由DSS引起的结肠组织损伤。Serra等[46]采用白藜芦醇体外作用于肠上皮来源的HT-29细胞系,结果显示白藜芦醇可显著降低经细胞因子诱导产生的NO、PGE2、iNOS和COX-2的表达以及活性氧的形成,从而缓解炎症引起的肠道组织损伤。
3.2.2 白藜芦醇的抗氧化作用 血液中丙二醛含量反映组织细胞受自由基攻击的严重程度,而SOD活力则反映机体清除氧自由基的能力。近年研究显示,白藜芦醇能通过清除活性氧簇进而发挥抗氧化作用,减轻肠道组织损伤。Jang等[47]的研究显示,白藜芦醇在小鼠巨噬细胞系Raw 264.7细胞、人单核细胞和中性粒细胞中是一种有效的活性氧生成抑制剂。Yildiz等[48]的研究显示,白藜芦醇可减轻I/R诱导的大鼠小肠氧化损伤。Ozkan等[49]的研究也显示,白藜芦醇能通过降低丙二醛、NO以及MPO水平,恢复SOD活性,减轻由I/R引起的肠损伤。Jha等[50]采用静脉注射20 mg/kg或口服50 mg/kg白藜芦醇的方式处理肠I/R模型大鼠,结果显示白藜芦醇均能有效缓解机体SOD水平的下降以及丙二醛水平的升高。Dong等[41]等也报道了白藜芦醇可明显提高大鼠肠I/R后黏膜上皮细胞内细胞色素的氧化酶活力,降低氧自由基的产生,提高SOD水平及活性,减少血液中丙二醛,明显减轻由I/R导致的肠道黏膜组织损伤。近年来的临床试验也证实了白藜芦醇这一作用。2015年,Samsami-Kor等[34]对每日服用1粒白藜芦醇胶囊且连续服用6周的患者进行研究,结果显示白藜芦醇可降低丙二醛和MPO的表达,进而抑制组织的氧化损伤和凋亡,起到减轻炎症的作用。
3.2.3 白藜芦醇抑制肠道纤维化的作用 当外界抗原等异物引起肠道炎症反应,肠道组织被持续破坏,肠道间质细胞活化并过度增殖,过多的间质细胞外基质在肠壁沉积,导致肠壁发生纤维化[51]。而在临床上,肠壁纤维化、肠腔狭窄为克罗恩病常见并发症。到目前为止,有关白藜芦醇抑制肠道纤维化作用的报道较少。Rahal等[52]的研究显示,白藜芦醇能显著减少肽聚糖-多糖构建的Lewis大鼠克罗恩病模型炎性细胞因子和TGF-β1的含量,降低Ⅰ型、Ⅲ型前胶原和IGF-1 mRNA的表达,抑制组织纤维化,说明白藜芦醇具有抑制纤维化的作用。Garcia等[53]也报道了类似的研究结果。Li等[54]的研究也显示,白藜芦醇可能通过激活SIRT1或抑制IGF-Ⅰ受体途径抑制胶原I的合成,从而抑制IGF-1诱导的肠道纤维化。最新的研究结果显示,SIRT1通过减少炎症和纤维化的进程来预防肺纤维化[55]。白藜芦醇在IBD中的作用除了抗炎、抗氧化以及抑制纤维化之外,还有抑制肠道上皮细胞凋亡等作用[34]。
综上所述,同类型实验动物模型以及临床研究均显示了白藜芦醇主要是通过抗炎、抗氧化、抑制肠道纤维化及抑制肠道细胞凋亡等方式缓解IBD。但是具体作用机制尚不清晰。全面深入研究白藜芦醇治疗IBD的作用及其机制,将为其在IBD临床治疗中提供理论基础和实验依据,并为开发与白藜芦醇相关的新型药物提供思路。
