Nrf2基因启动子区-653A/G多态性与绝经后 骨质疏松症的相关性研究
2019-04-28
(临沂市人民医院,山东 临沂 276003)
骨质疏松症(Osteoporosis,OP)是最常见的骨骼疾病,可发生于任何年龄,但多见于绝经后女性[1]。遗传因素在OP及其骨折的发生中起重要作用,多种基因的遗传变异被证实与骨量调节有关。转录因子Nrf2是Cap‘n’Collar(CNC)家族的成员,在抗氧化应激中发挥着重要作用。多项细胞及动物实验均证实[2-4],Nrf2可以抑制氧化应激诱导的成骨细胞凋亡、破骨细胞分化与成熟、骨显微结构破坏等病理改变,但其在绝经后骨质疏松症(Postmenopausal osteoporosis,PMOP)发生发展中的人群效应目前还不完全明确。本研究旨在探讨Nrf2基因启动子区-653A/G多态性与PMOP的关系,为临床诊疗工作提供遗传学参考。
1 资料和方法
1.1研究对象 选取2017年5月-2018年12月在本院行DXA骨密度检查的绝经后住院妇女357名。纳入标准:①绝经后妇女;②无引起继发性骨质疏松症的疾病,如甲状旁腺功能亢进症、骨软化症等;③无长期(>3个月)激素和其他影响骨代谢的药物使用史。排除标准:①严重肝、肾、心、脑血管等系统疾病者;②精神病患者;③恶性肿瘤患者;④免疫功能异常者。入选患者年龄50~75岁,根据骨密度的结果将其划分为正常组、减少组和疏松组。所有入组患者或其家属签署知情同意书,本研究经医院伦理委员会审核批准。
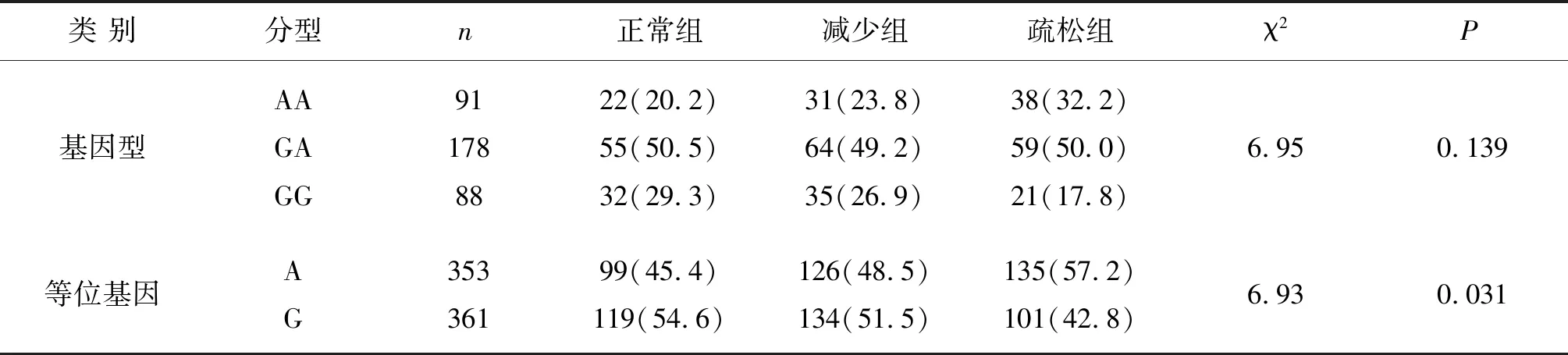
1.2诊断标准 根据中华医学会骨质疏松和骨矿盐疾病分会2017版《原发性骨质疏松症诊疗指南》,基于DXA测量的中轴骨(腰椎1-4,股骨颈或全髋)骨密度或桡骨远端1/3骨密度,对骨量正常的诊断标准是T值≥-1.0,骨量减少的诊断标准是-2.5 1.3方法 1.3.1骨密度测定 采用美国GE公司生产的DPX-MD型双能X线骨密度检测仪对患者的腰椎1-4、股骨颈和全髋骨密度进行检测,骨密度仪每日开机时进行体模校准以保证测量结果的准确性。在测定骨密度的同时,记录患者年龄、身高和体重,计算体重指数(BMI)。 1.3.2血生化指标和骨代谢指标测定 所有研究对象需空腹8 h以上,于清晨抽取静脉血5 mL,采用全自动生化分析仪测定血清钙(Ca)、磷(P)和碱性磷酸酶(ALP)的水平;电化学发光免疫分析法测定骨钙素(OC)、β胶原特殊序列(β-CTX)、甲状旁腺素(PTH)和25-羟维生素D3[25(OH)D3]的水平。 1.3.3基因型鉴定 ①DNA提取:所有研究对象采集清晨空腹静脉血3 ml,使用酚/氯仿法提取外周血白细胞DNA,置于-20 ℃冰箱保存。②引物设计:利用Primer 5软件设计引物,并委托Invitrogen公司合成。上游引物序列:5'-GGGTTCCCGTTTTTCTCCCAGCTCTGGGTG-3',下游引物序列:5'-TGTTTGCGAAGGTCGCTGGAGTTCGGACGC-3'。③PCR扩增:PCR反应体系共20 μL,包括:模板DNA 1 μL,10xBuffer 2 μL,上、下游引物各1 μL,dNTP混合物2 μL,Taq DNA聚合酶0.2 μL,剩余体积用双蒸水补充至20 μL。PCR反应程序:首先95 ℃预变性5 min;然后95 ℃变性30s,55 ℃退火30 s,72 ℃延伸45s,35个循环。最后72 ℃延伸5 min。④基因测序:PCR产物经过虾碱酶(SAP)和外切酶I(EXO I)纯化后用ABI公司的SNaPshot Multiplex kit进行延伸反应。延伸产物经纯化后采用ABI 3730XL测序仪进行基因测序,测序结果用GeneMapper 4.1软件分析。 2.1三组患者的一般资料比较 三组BMI、OC和β-CTX比较有统计学意义,两两比较:减少组与疏松组BMI比较没有统计学意义(q=2.64,P>0.05),其他各组间同一指标比较均有统计学意义(q=4.10~25.34,P<0.05)。见表1。 2.2Hardy-Weinberg平衡检验 本研究中正常组、减少组和疏松组的Nrf2基因-653A/G位点基因型分布经χ2检验均符合Hardy-Weinberg平衡,具有群体代表性,见表2。 2.3各组基因型和等位基因频率比较 三组等位基因比较有统计学意义,骨质疏松组的A等位基因频率高于骨量正常组,G等位基因频率低于骨量正常组(χ2=6.93,P=0.031)。见表3。 2.4回归分析 以PMOP的发生与否作为因变量,选择Nrf2基因型、年龄、身高、体重、BMI、Ca、P、ALP、OC、β-CTX、PTH和25(OH)D3等作为自变量,进行Logistic回归分析。结果显示,Nrf2基因型、体重、β-CTX与PMOP的发生有关,其中Nrf2(AA)基因型和β-CTX是PMOP发生的危险因素,体重是PMOP发生的保护因素,见表4。 表1 三组患者一般资料的比较 表2 Nrf2基因-653G/A基因型的Hardy-Weinberg平衡检验 表3 各组间Nrf2基因型和等位基因频率分布[n(%)] 表4 PMOP相关危险因素的分析 越来越多的证据表明,氧化应激与PMOP的发生发展有关。在动物实验方面,氧化应激可以通过加强RANKL的表达激活破骨细胞前体,同时诱导相关细胞因子(如IL-1、IL-6和IL-7等)的活化,增加破骨细胞的数量和活性,导致PMOP的发生和发展[5]。此外,活性氧还可促进成骨细胞的凋亡,抑制成骨细胞的矿化,而应用抗氧化剂如维生素E和N-乙酰半胱氨酸(NAC)等可以抑制此过程[6-7]。在人群研究方面,高水平的血浆氧化因子水平增加了绝经后妇女的骨吸收,这可能与活性氧破坏了RANKL与OPG之间的平衡有关[8-9]。此外,一项长达23年的研究还发现,血浆中活性氧水平的升高与髋部骨折的发生有关,测定血浆中活性氧的水平,有助于预测长期的髋部骨折风险[10]。 转录因子Nrf2是CNC家族的重要成员,包含589个氨基酸残基,由6个在进化上高度保守的Nrf2-ECH同源结构域(简称Neh1-Neh6)组成,其可以通过诱导一系列靶基因(如细胞内抗氧化酶和Ⅱ相解毒酶等)的转录,进而发挥抗氧化应激、抑制炎症等多种重要的生物学功能。大量研究证实[2-4],敲除Nrf2以后,成骨细胞的生成减少,凋亡增加,而破骨细胞的生成和活化增强,这主要与氧化应激的不适当增加有关。多种抗氧化物质如白藜芦醇、燕麦生物碱、淫羊藿苷、鼠尾草酸、天麻素、甘草酸、儿茶素、叶黄素等均可通过激活Nrf2发挥抑制骨质疏松的作用,进一步证实了Nrf2在抗骨质疏松方面的关键地位。 基于Nrf2在骨质疏松症中的重要作用,本研究重点关注Nrf2基因启动子区-653A/G多态性与PMOP的相关性。结果表明:减少组和疏松组的BMI低于正常组,而OC和β-CTX水平高于正常组;OC和β-CTX分别是反映成骨和破骨的重要指标,它们的明显升高,提示骨量减少和OP患者的骨代谢和骨流失加快。其次,基因型鉴定结果发现,三组基因型构成无显著差异,疏松组A等位基因频率高于G等位基因频率,其他两组反之,提示A等位基因可能导致绝经后妇女骨量减少和骨质疏松的发生,其原因可能与携带者体内氧化应激的水平升高密切相关。最后,对PMOP发生风险的回归分析进一步提示,Nrf2(AA)基因型和β-CTX是骨质疏松发生的危险因素,而体重是骨质疏松发生的保护性因素。 总之,本研究发现,Nrf2基因启动子区-653A/G多态性与PMOP的发生存在相关性,AA基因型和A等位基因可能是PMOP发生的危险因素。2 结果



3 讨论
