减蛋综合征病毒在不同品系小鼠体内的组织分布
2019-04-28范涛梁琳李嘉阳李刚
范涛,梁琳,李嘉阳,李刚*
(1. 中国农业科学院北京畜牧兽医研究所,北京 100193; 2. 中国食品药品检定研究院,北京 102629)
减蛋综合征病毒(egg drop syndrome virus, EDSV)属禽类腺病毒,2005年国际病毒分类委员会(ICTV)新的腺病毒分类标准中将EDSV归为富AT腺病毒属[1]。该病毒主要引起禽类(鸡、鸭、鹅等)产蛋量急剧下降,可在鸭胚细胞、鸭胚成纤维细胞中良好增殖,而在鸡胚成纤维细胞中增殖不良,以鸭为自然宿主[2],也称为鸭腺病毒A型。
腺病毒具有宿主范围广,致病性低,外源基因承载量大等特点,可作为抗原基因载体制成疫苗,诱导固有免疫反应或在宿主细胞内表达承载基因产物,进而实现免疫预防或治疗目的。禽腺病毒凭借种属的差异,对哺乳动物来说有很好的安全性,已成为重要的疫苗载体并得到广泛的应用[3-5],研究较早且具有代表性的毒种是鸡胚致死孤儿病毒(CELOV),而EDSV是否具备同样的效果仍需进行实验证实。本研究选用了3个品系小鼠模型作为对象,通过人工感染,观察EDSV在小鼠体内增殖情况以及动态变化规律,为该病毒构建载体提供理论依据与数据支持。
1 材料与方法
1.1 材料
1.1.1 实验动物
免疫系统正常小鼠BALB/c、T细胞免疫缺陷小鼠Nu、高度免疫缺陷小鼠NSG,每个品系32只,SPF级,雌性,5 ~ 6周龄,体重为14 ~ 16 g,由中国食品药品检定研究院实验动物资源研究所保存并提供【SCXK(京)2014-0013】。动物饲养在中国食品药品检定研究院动物实验室屏障环境隔离器中【SYXK(京)2016-0004】。饲养环境:温度22 ~ 26℃,相对湿度40%~70%,压差≥50 Pa,换气次数≥ 20 次/h,空气洁净度5级,明暗交替12/12 h,噪声≤60 dB。同时本实验在中检院实验动物伦理委员会监督与指导下进行【中检动(福)第2016(B)007号】。
1.1.2 主要仪器
隔离器(苏州冯氏实验动物设备有限公司软包隔离器,中国),离心机(Beckman X-22R,德国),超速离心机(Hitachi CP100NX,日本);紫外分光光度仪(Thermo Nano Drop 2000,美国);酶标仪(Thermo Fisher Multiskan Go,美国);恒温培养箱(上海智城ZXMP-A1230,中国);荧光定量PCR仪(美国应用生物系统公司ABI 7500 Fast,美国);单通道(2 ~ 20 μL、20 ~ 200 μL)、八通道(50 ~ 300 μL)微量移液器(Eppendorf,德国)。
1.1.3 主要试剂耗材
ELISA 96孔可拆式(8×12)聚苯乙烯酶标板(NUNC公司,丹麦),0.1 mL八联排管及八联排管超净光盖(BIO plastics BV,荷兰);TaKaRa Premix Ex Taq 试剂、蛋白酶K、RNase A(宝生物工程(大连)有限公司,中国),乙醇、饱和酚、氯仿、异丙醇等(北京化学工业集团有限公司,中国);蔗糖密度梯度溶液、1×PBS、抗原包被液、封闭液、PBST洗液、抗体稀释液、酶结合物稀释液、TMB显色剂、终止液等由实验室自行配制。
1.2 实验方法
1.2.1 小鼠攻毒与样本采集
将EDSV病毒液室温解冻,摇匀。3个品系小鼠,品系内分为实验组24只,每只小鼠腹腔注射0.1 mL血凝效价为212的病毒液;对照组8只,每只腹腔注射同等剂量的PBS。实验组与对照组分开放置于不同隔离器内饲养。分别于攻毒后1、3、5、7、14、21、28、35 d,每日选取各品系3只实验组和1只对照组小鼠,CO2麻醉,摘除眼球取全血约1 mL,置于1.5 mL离心管中,4℃静置析出血清,用微量移液器吸取上层血清至新离心管中,编号,-20℃冻存备用。选择攻毒后1、7、14、21、28 d实验组与对照组小鼠,剖取心脏、肺、肝、脾、肾、小肠、子宫、气管、食管、脑10种组织,每种组织取一小块置于1.5 mL离心管中,用于DNA提取,-80℃冻存。
1.2.2 间接ELISA抗原包被浓度与抗体稀释度优化
30% ~ 50%(m/v)5个间隔相等浓度梯度的蔗糖溶液进行超速离心纯化抗原;用纯化的EDSV抗原包板,抗原稀释为2、5、7、10 μg/mL 4个浓度,取已知阳性血清、阴性血清各1份,分别做1∶100、1∶200、1∶400、1∶800、1∶1600倍的稀释,“方阵滴定法”确定抗原最佳包被浓度与血清工作稀释度,P/N值最大时对应的抗原浓度与抗体稀释度为工作浓度。
1.2.3 间接ELISA方法小鼠血清抗体监测
用优化后浓度的抗原液包板,100 μL/孔,37℃ 1 h后4℃过夜;设置阴性对照、阳性对照、空白对照各2个孔,分别加入工作浓度稀释后的SPF级小鼠血清、已知EDSV抗体阳性小鼠血清和PBS,待检血清样本稀释后每份平行做2孔,每孔100 μL,用封板膜封板,37℃反应1 h;取出后洗板5次,叩干;山羊抗鼠辣根过氧化物酶(goat anti-mouse IgG-HRP)按1∶5000稀释为工作浓度,每孔加入100 μL,封板,37℃孵箱反应1 h,取出后洗板5次并叩干;每孔加入100 μL 底物溶液,放入铝箔袋,37℃避光显色10 ~ 15 min;取出酶标板,每孔加入50 μL终止液(2 mol/L硫酸);酶标仪设定波长为450 nm,读取板上各孔OD值。
1.2.4 TaqMan qPCR检测EDSV体内组织分布
将各组织块解冻,剪碎,饱和酚/氯仿法提取总DNA,紫外分光光度计测定DNA浓度及纯度。以EDSV六邻体蛋白编码区基因序列作为目的基因,文献获得探针引物[6];NCBI网站公布的小鼠β-actin蛋白(Actb)基因序列(Gene ID:11461)为内参基因,设计探针引物,由宝生物工程(大连)有限公司设计合成。(表1)
根据TaKaRa Premix Ex Taq 试剂使用ABI 7500 Fast荧光定量PCR仪推荐反应体系及条件进行扩增,qPCR反应体系:PremixExTaq(2×buffer) 10 μL、Forward Primer (10 μmol/L) 0.4 μL、Reverse Primer (10 μmol/L) 0.4 μL、Probe (5 μmol/L) 0.8 μL、ROX Reference Dye2 (50×) 0.2 μL、cDNA 2 μL、ddH2O 6.2 μL,qPCR反应程序:95℃ 30 s,95℃ 5 s,60℃ 30 s,40 个循环,60℃时收集荧光信号。用比较CT法(△△CT)进行数据处理,得出相对定量(RQ)值,再将RQ值取10的对数(LgRQ),转换为数量级的形式来判断变化量[7]。

表1 EDSV、Actb 荧光定量PCR引物及探针Table 1 Primers and probes for EDSV, Actb TaqMan qPCR
2 结果
2.1 间接ELISA检测三种小鼠血清抗体变化规律
2.1.1 抗原包被浓度与抗体稀释度优化
“方阵滴定”结果显示,EDSV抗原包被浓度为2 μg/mL,阴性、阳性血清稀释度为1∶800倍时,此时的P/N值最高,为23.10,因此,确定使用该浓度的抗原及血清稀释度进行抗体检测。(表2)
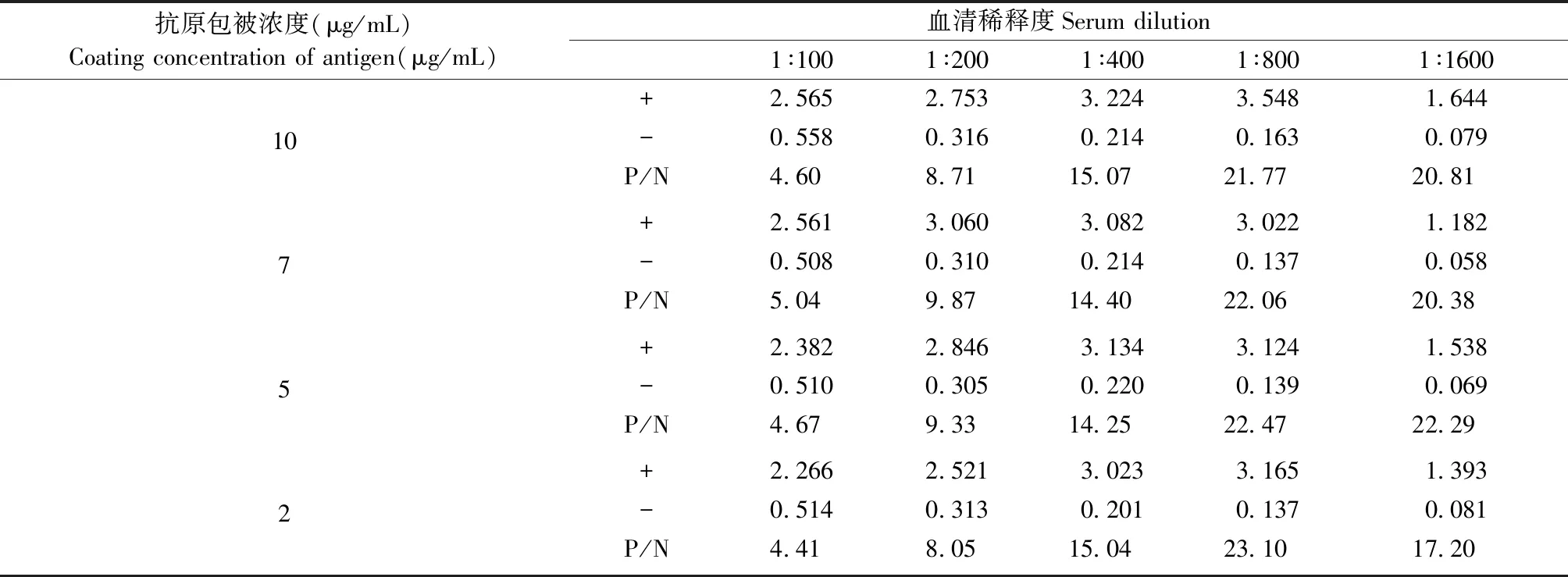
表2 EDSV抗原包被浓度及血清工作稀释度结果Table 2 Results of EDSV coating concentration and serum working dilution
2.1.2 间接ELISA监测三种小鼠血清抗体
ELISA检测结果显示(表3),BALB/c小鼠攻毒3 d即可在血清内检测到抗体的表达,平均OD值为0.901;至14 d,抗体水平达到最高,至监测期内35 d一直维持高水平表达;Nu小鼠也可于攻毒3 d检测到抗体,但表达水平较BALB/c小鼠有所降低,平均OD值为0.587,攻毒14 d后,Nu小鼠血清中抗体水平出现下降,至35 d抗体一直维持在较低的水平;NSG小鼠在整个监测过程中,抗体水平一直处于阴性状态。根据检测数据,绘制三品系小鼠血清抗体变化趋势图(图1)。
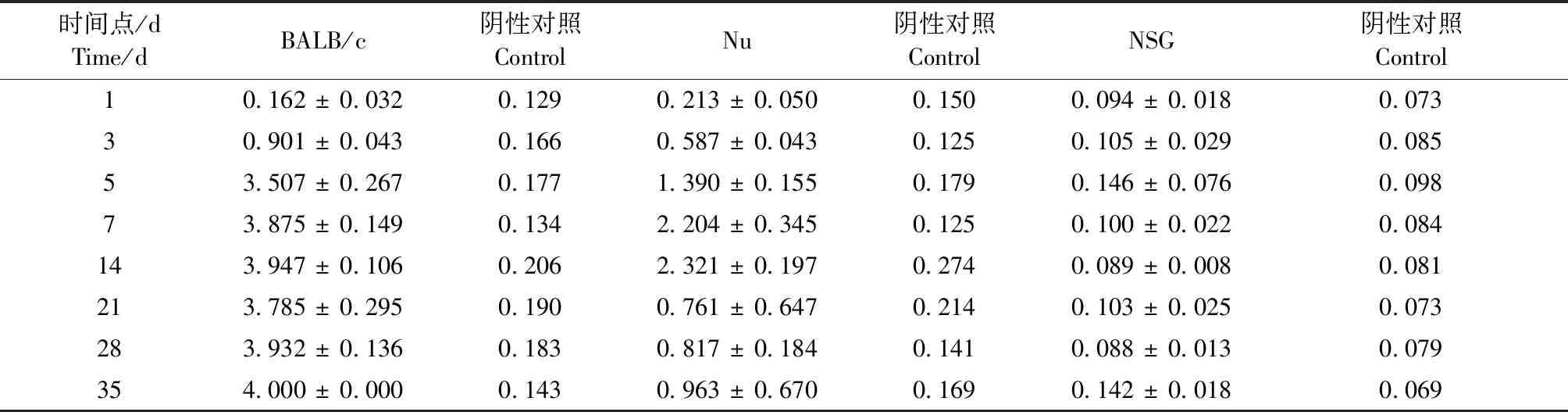
表3 三品系小鼠血清抗体ELISA检测结果Table 3 ELISA test results of serum antibodies in the three mouse strains
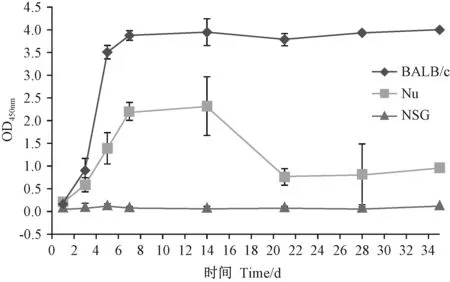
图1 三品系小鼠血清抗体ELISA检测结果比较Figure 1 Comparison of ELISA results of serum antibodies in the three mouse strains
2.2 TaqMan qPCR检测EDSV组织分布结果
3个品系小鼠的10种组织样本,除NSG小鼠7 d和14 d脑组织中未检测到病毒含量外,其他样本目的基因与内参基因均可计算出相对表达量(表4)。同时,各品系对照组小鼠在实验期内,各组织中均未扩增出病毒核酸。
根据实验结果,BALB/c小鼠感染后1 d,肝组织中的病毒表达量最高,达到5.45个数量级,其次由高到低依次是脾、食管、子宫、小肠、肺、气管、肾、心脏,脑组织中病毒含量最低,随感染时间的延长,各组织内病毒表达量较感染1 d均有所下降;至攻毒后28 d,肝、脾病毒表达量依然维持着较高的水平,脑组织中病毒相对含量降至最低,其他各脏器组织中仍可检测到病毒含量(图2)。
Nu小鼠和NSG小鼠略有差异,其感染1 d表现为脾组织中病毒表达量最高,分别为3.95和4.05个数量级,其次为肝,Nu小鼠1 d肝病毒含量为3.84个数量级,NSG小鼠为3.82个数量级。随后两品系小鼠各器官内的病毒表达量逐步降低,以Nu小鼠最为明显,于攻毒28 d,两种小鼠体内各器官内仍可以检出阳性信号,肝、脾病毒表达量较高。结果表明,在监测期内,EDSV可在部分小鼠组织器官内始终存在,主要集中在肝、脾等组织中(图3、图4)。
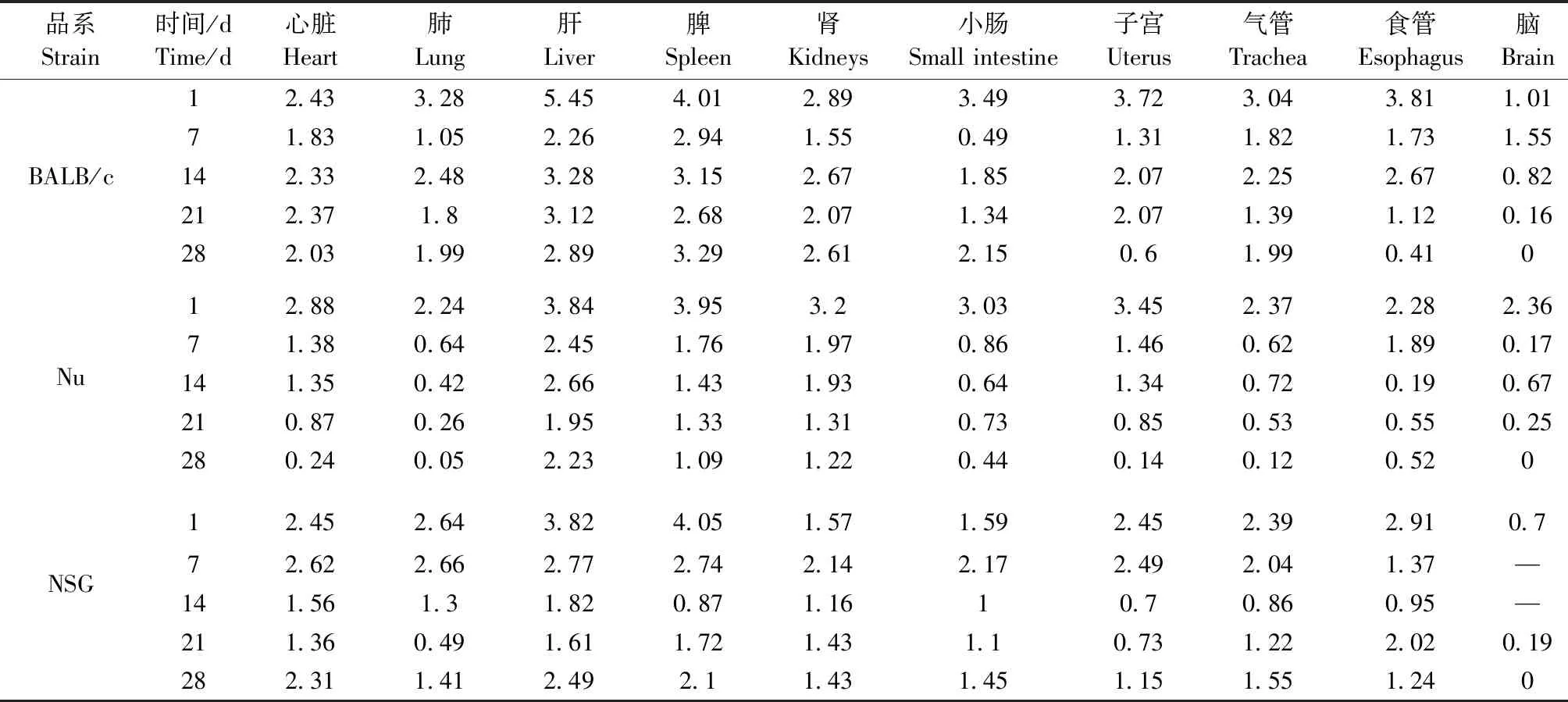
表4 三品系小鼠各组织病毒载量相对定量结果Table 4 Relative quantitative results of viral load in tissues of the three mouse strains
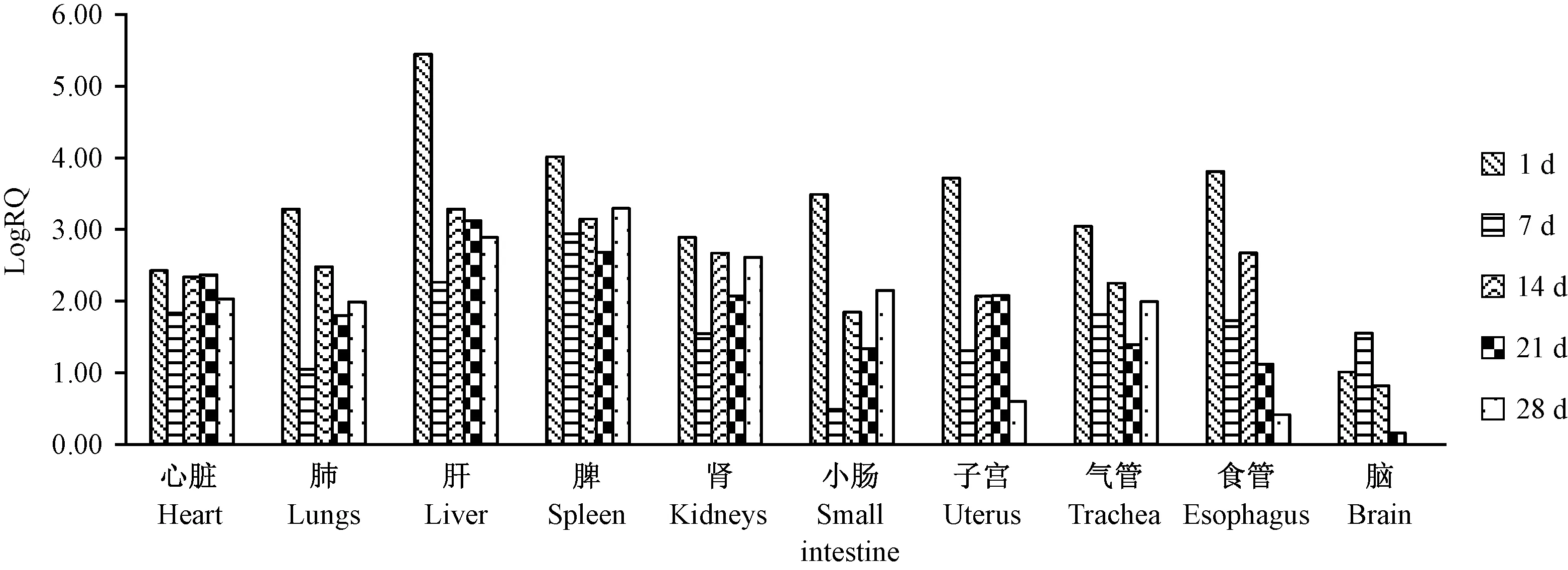
图2 EDSV在BALB/c小鼠体内组织分布Figure 2 Organ distribution of EDSV in the BALB/c mice

图3 EDSV在Nu小鼠体内组织分布Figure 3 Organ distribution of EDSV in the nude mice
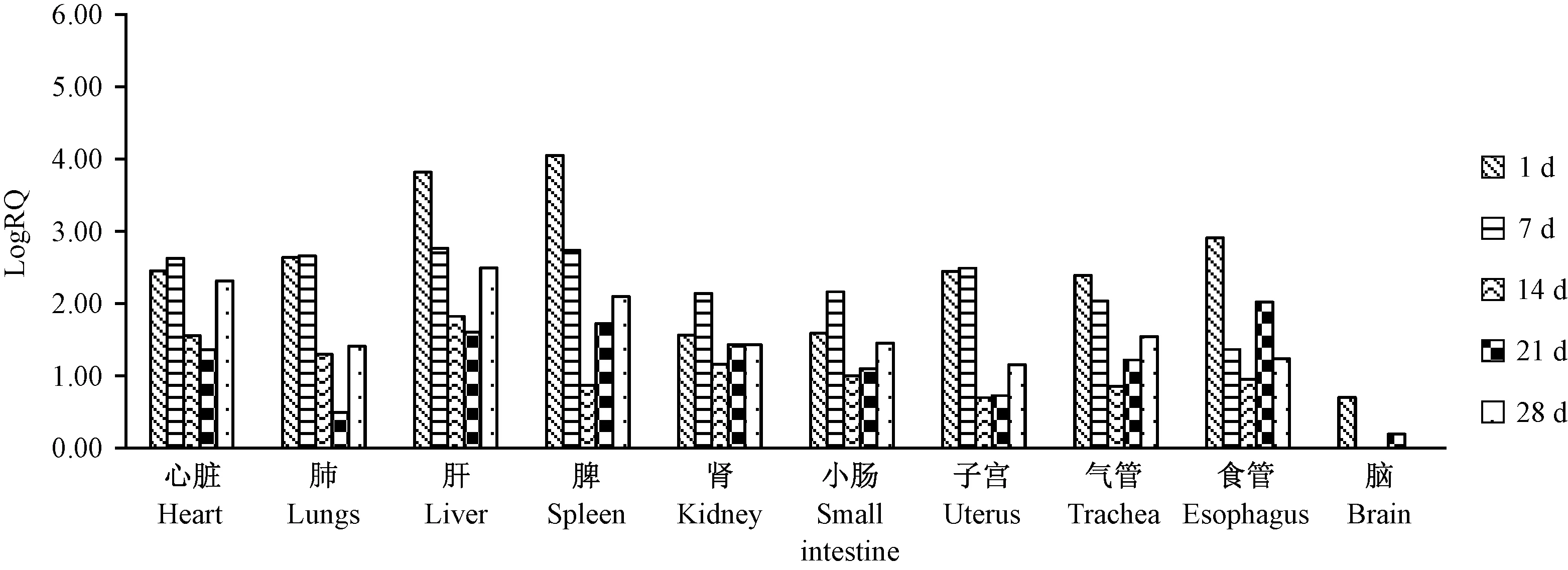
图4 EDSV在NSG小鼠体内组织分布Figure 4 Organ distribution of EDSV in the NSG mice
3 讨论
EDSV按原分类属于禽类腺病毒Ⅲ群,由五邻体蛋白(penton)、六邻体蛋白(hexon)与纤维蛋白(fiber)共同构成病毒衣壳。试验证明,三种结构性蛋白基因经过重组表达鉴定,均具有免疫原性[8-10]。在EDSV感染禽类的研究中,种鸭可在攻毒3 d检测到血清抗体,HI效价可达8 Log2,并于攻毒后12 d达到最高[11];王晓东[12]对3月龄SPF鸭仅进行基础免疫后,第1周即可检测出血清抗体,平均HI效价5.75 Log2,两周后达到最高6.75 Log2,抗体水平可维持17周在5 Log2以上。以上结果都指示出EDSV可快速刺激禽类机体产生免疫应答反应,并产生持久性的抗体保护。鼠腺病毒(mouse adenovirus, Mad)以小鼠为天然宿主,在实验鼠群中感染比例约为8.3%[13]。人工感染后15 d ELISA方法可检测出阳性血清抗体,37 d达到峰值[14]。本实验是使用禽腺病毒人工感染小鼠,结果显示,该病毒株可使小鼠在短期内产生较高水平的抗体,并且可维持35 d抗体持续检出,相比鼠腺病毒,EDSV能够较快地刺激小鼠机体产生免疫应答反应,与禽类感染此病毒后的特性相一致。
通过实验结果可以看出,动物自身免疫机能对EDSV抗体的表达产生着影响。免疫机能正常的BALB/c小鼠,在抗原刺激后3 d即可检测出血清抗体,并随着感染时程延长,抗体水平逐渐增高,监测至35 d,仍然保持着较高的抗体含量。裸小鼠较BALB/c而言,缺少胸腺,体内无成熟的T淋巴细胞,而EDSV像大多数微生物一样属胸腺依赖性抗原(TDAg),辅助性T细胞(Th)的缺陷,导致小鼠体内B细胞在免疫应答过程中产生的抗体有所减少,不能持续产生有效的体液免疫应答。因此,裸鼠的血清抗体产生初期,表达水平较BALB/c小鼠偏低,监测至21 d时,血清抗体水平下降明显。NSG小鼠是在NOD小鼠背景基础上,DNA修复复合蛋白Prkdc发生scid突变,致使小鼠B、T淋巴细胞缺失,同时IL2rg缺失突变,阻止了多重受体细胞因子信号传导,导致功能性NK细胞缺失[15],动物机体无法产生细胞免疫应答与体液免疫应答,因此,在整个抗原刺激过程中,其抗体水平一直维持在阴性,符合该模型特点。
应用荧光定量PCR相对定量法检测病毒载量,其优势在于去除了采样间的误差,结果用变化倍数来表示,用于指示病毒在体内含量的变化趋势。通过比较不同品系小鼠各组织脏器中病毒核酸相对表达量可以看出,三品系小鼠均可在腹腔注射病毒液后1 d于体内各主要脏器中检测到病毒,这可能与感染途径有关,病毒液随血液循环迅速扩散至全身各脏器中。BALB/c小鼠感染后1 d,肝为病毒相对表达量最高的组织器官,感染至28 d,脾中病毒相对表达量最高,肝较脾中病毒水平略低,但依然显示有较高的表达量;Nu和NSG两种免疫缺陷型小鼠表现出攻毒后1 d脾病毒含量最,其次是肝,这可能与其具有的免疫缺陷特性有关,两种小鼠的脾均小于免疫正常的小鼠,至28 d时,其二者肝中病毒相对表达量是各组织间最高的,由此说明,EDSV对小鼠肝与脾有一定的亲嗜性。通过三品系小鼠攻毒全程监测结果可以看出,28 d时体内各组织的病毒含量较攻毒1周内(1 ~ 7 d)均有所降低,说明动物机体自身对EDSV有一定的清除作用。病毒在免疫系统正常与免疫缺陷小鼠的体内均没有引起明显的组织病变,除了动物机体的免疫系统发挥作用以外还可能与组织细胞表面结合受体有关。腺病毒有严格的种属特异性,而EDSV又是介于禽类腺病毒与哺乳动物腺病毒的中间体[16],推测该病毒在哺乳动物体内可以增殖表达,是否引起组织细胞发生病变需进一步进行实验观察。
综上所述,减蛋综合征病毒可刺激小鼠产生免疫应答,在免疫缺陷小鼠体内抗体水平表达量较低,该病毒在小鼠体内有肝、脾等组织嗜性特点,为EDSV构建新型载体以及在实验动物模型上的进一步研究与应用提供了理论基础与数据支持。
