牛冠状病毒荧光定量PCR检测方法的建立及初步应用
2019-04-28王莎莎岳秉飞
王莎莎,王 吉,岳秉飞
(中国食品药品检定研究院,北京 102629)
牛冠状病毒(bovine coronavirus, BCV)是一类具有包膜,基因组为27~30 kb大小的线性单股正链的RNA病毒[1],具有感染性,是所有RNA病毒中最大的。BCV是冠状病毒科冠状病毒属成员,目前冠状病毒共分为α、β、γ以及新假定的一个属共四类,牛冠状病毒和鼠肝炎病毒以及SARS冠状病毒等同属β类冠状病毒[2]。BCV与人肠道冠状病毒4408株在抗原性和基因序列具有很高的相似性,存在潜在感染人的风险。BCV是引起新生犊牛腹泻和成年牛冬痢、呼吸道疾病的主要病原,在全球普遍流行。BCV经常与其他多种病原引发混合感染,难于诊断,通常需要实验室病毒分离、血清检测或者分子学检测方法进行诊断。本研究建立了BCV特异的TaqMan探针法实时荧光定量PCR(fluorescence quantitative PCR,FQ-PCR)检测方法,能够实现快速批量检测牛群中BCV的感染情况,并减少污染。该方法可应用于牛源性生物制品BCV污染的检测,为保证生物制品安全性提供依据,同时为开展BCV基因组的研究打下基础。
1 材料和方法
1.1 样品与毒种来源
牛冠状病毒核酸为哈尔滨兽医研究所惠赠,牛蓝舌病病毒(bluetongue virus,BTV)核酸为第二军医大学惠赠,牛疱疹病毒1型(bovine herpesvirus 1,BHV-1)、牛副流感病毒3型(bovine parainfluenza virus 3, BPIV3)、牛病毒型腹泻病毒(bovine viral diarrhea virus,BVDV)、呼肠孤病毒III型病毒(reovirus 3,Reo3)、小鼠肝炎病毒(mouse hepatitis virus, MHV)为本实验室保存。牛肛拭子63份G1~G63,牛鼻拭子63份B1~B63采集于2016年内蒙古牛群,牛源性生物制品33份NY1~NY33为本实验室2015年应急检测样品。
1.2 主要试剂与仪器
FQ-PCR Mix购自ABI; FQ-PCR引物探针由ABI公司合成。RNA快速提取试剂盒RNeasy Mini Kit(250)(批号:154043816)购自Qiagen,AMV逆转录试剂盒AMV Reverse Transcriptase(批号:0000290291)购自Promega,TaqMan Universal PCR Master Mix(批号:1704286)购自ABI。荧光定量PCR仪ABI7500 Fast购自ABI公司。
1.3 实验方法
1.3.1 引物设计
选择BCV N 基因保守区域设计引物探针,序列如表1所示。
1.3.2 质粒标准品的制备
由TaKaRa公司合成BCV(NCBI ID:AF058942)7851~8090 bp的cDNA序列,转入pMD19-T载体中,构建BCV FQ-PCR的标准质粒pMD19-BCVN,浓度为4.0×1010Copies/μL。
1.3.3 病毒cDNA的获取
将牛冠状病毒、牛疱疹病毒I型、牛副流感病毒3型、牛病毒型腹泻病毒、呼肠孤病毒III型、小鼠肝炎病毒;牛肛拭子63份;牛鼻拭子63份;牛源性生物制品33份等样品按照RNA快速提取试剂盒操作方法进行RNA提取。提取的RNA按照Promega AMV逆转录试剂盒获取cDNA,保存于-80℃备用。
1.3.4 BCV FQ-PCR扩增体系及标准曲线的建立
经条件优化,PCR反应体系为:TaqMan Universal PCR Master Mix 10 μL,探针引物混合物(10 μmol/L)1 μL,无RNA酶水7 μL,模板1 μL。反应条件:50℃ 2 min;95℃ 10 min;95℃ 15 s,60℃ 1 min,40个循环。
将pMD19-BCVN作为标准品,进行10倍系列稀释为109~100copies/μL,将其作为模板,按上述反应体系和反应条件进行FQ-PCR反应,每个稀释度做3个平行实验,选取线性较好的7个稀释度绘制标准曲线。

表1 用于扩增N基因的引物与TaqMan探针序列
1.3.5 BCV FQ-PCR检测方法的特异性、灵敏性、准确性和稳定性检测
使用建立的荧光定量PCR方法检测BCV、牛疱疹病毒1型、牛副流感病毒3型、牛病毒性腹泻病毒、呼肠孤病毒Ⅲ型、小鼠肝炎病毒、牛蓝舌病病毒的病毒核酸,并设立阴性对照N/C(空白样品)检测BCV实时荧光定量PCR检测方法的特异性;使用4.0×109~4.0×100copies/μL稀释的标准质粒作为模板,进行BCV FQ-PCR反应,每个稀释度做三个平行,检测方法的灵敏性;用BCV FQ-PCR检测方法对3份不同阳性样品进行重复检测,评价本发明方法的准确性和稳定性。
1.3.6 BCV FQ-PCR污染实验
将100~10-7梯度稀释的BCV病毒液和100~10-7梯度稀释的BCV RNA 0.1 mL与0.2 mL的鼠神经生长因子混合后按1.3.3所述方法获取cDNA,并使用BCV FQ-PCR方法进行检测,验证其适用性,每个稀释度做3个平行。
1.3.7 BCV FQ-PCR的应用
使用建立的FQ-PCR方法检测63份牛肛拭子,63份牛鼻拭子以及33份牛源生物制品中BCV的感染情况。如有阳性结果,使用PCR引物BCV-PF:5’-CGATGAGGCTATTCCGACTAGG-3’;BCV-PR:5’-GCTTAGTTACTTGCTGTGGC-3’(未发表)对其进行PCR扩增,产物送北京英潍捷基公司进行测序鉴定,以进一步验证。
2 结果
2.1 BCV FQ-PCR扩增体系及标准曲线的建立
使用4.0×109copies/μL到4.0×103copies/μL的标准质粒作为模板进行FQ-PCR反应,扩增曲线如图1,构建的标准曲线如图2。扩增曲线各稀释度间距均匀,标准曲线相关系数Slope为-3.417(在-3~-3.5之间),r2值为0.999(>0.99)说明相关性高,定量结果有效,扩增效率Eff为96.195%(90%-110%之间)。标准品及待测样本3个重复的标准差(CTSD值)均小于0.218。
2.2 BCV FQ-PCR特异性检测
如图3所示,建立的BCV FQ-PCR检测BHV-1、BPIV3、BVDV、Reo3、BTV均无S型扩增曲线,而BCV有S型扩增曲线,CT值为22,阴性对照无S型扩增曲线,说明该方法能特异的检测BCV。
2.3 BCV FQ-PCR灵敏性检测
如图4所示,4.0×109~4.0×101copies/μL各稀释度的3个平行实验均有S型扩增曲线,101copies/μL标准品检测的 CT值为34.088,拷贝数为43.45copies,而100copies/μL的3个平行实验只有1个实验有S型扩增曲线,CT值>35,说明BCV FQ-PCR检测方法最小能可靠的检测到40copies的样品。同时确定该检测方法的判定标准为样品循环阈值(CT)≤35,同时拷贝数(Copies)≥10,判定该样品检测结果为阳性;循环阈值(CT) ≥35、拷贝数(Copies)<10,或者循环阈值(CT) <35、拷贝数(Copies)≥10,或者循环阈值(CT) <35、拷贝数(Copies)<10,此样品超出检测限,不能确定被检样品是阳性样品,结果判为阴性。
2.4 BCV FQ-PCR准确性和稳定性检测
起始浓度分别为4.0×106copies/μL、4.0×105copies/μL、4.0×104copies/μL的标准品的最终实测值的均值分别为4.78×106、3.89×105、3.7×104copies/μL,对应CTSD值分别为0.038、0.113、0.102,CV值分别为0.228、0.547、0.424。3个浓度梯度3次重复实验Ct值的变异系数(CV)均小于5%,表明方法重复性、稳定性良好。
2.5 BCV FQ-PCR污染实验
BCV FQ-PCR检测BCV病毒液的污染实验结果显示其检测100~10-5稀释度的CT值平均值分别为21.11、23.51、27.14、30.46、32.16、34.75,10-6BCV病毒液的CT值平均值为37,超出检测限。BCV FQ-PCR检测BCV RNA污染实验结果显示其100~10-2稀释度的CT值平均值分别为25.88、30.17、33.7,10-3BCV RNA的CT值平均值为36.49,超出检测限。污染实验结果说明BCV FQ-PCR在检测BCV病毒和BCV RNA污染的样品时有很好的适用性。
2.6 BCV FQ-PCR的初步应用
检测63份牛肛拭子、63份牛鼻拭子以及33份牛源生物制品中BCV的感染情况,检测结果如表1所示。其中仅有1份牛肛拭子G63和2份牛源生物制品NY12、NY17出现阳性结果,G63的CT值为34.506,NY12、NY17的CT值分别为33.78和34.21。使用1.5中所述的引物进行2次PCR扩增后G63、NY12可以得到457 bp比较明显的扩增条带,测序结果在NCBI上比对,与BCV B1-28F株(NCBI序列号:KU558923)的同源性为99%,与人冠状病毒OC43株(NCBI序列号:KF530072)的同源性为97%。

表2 BCV FQ-PCR初步应用检测结果
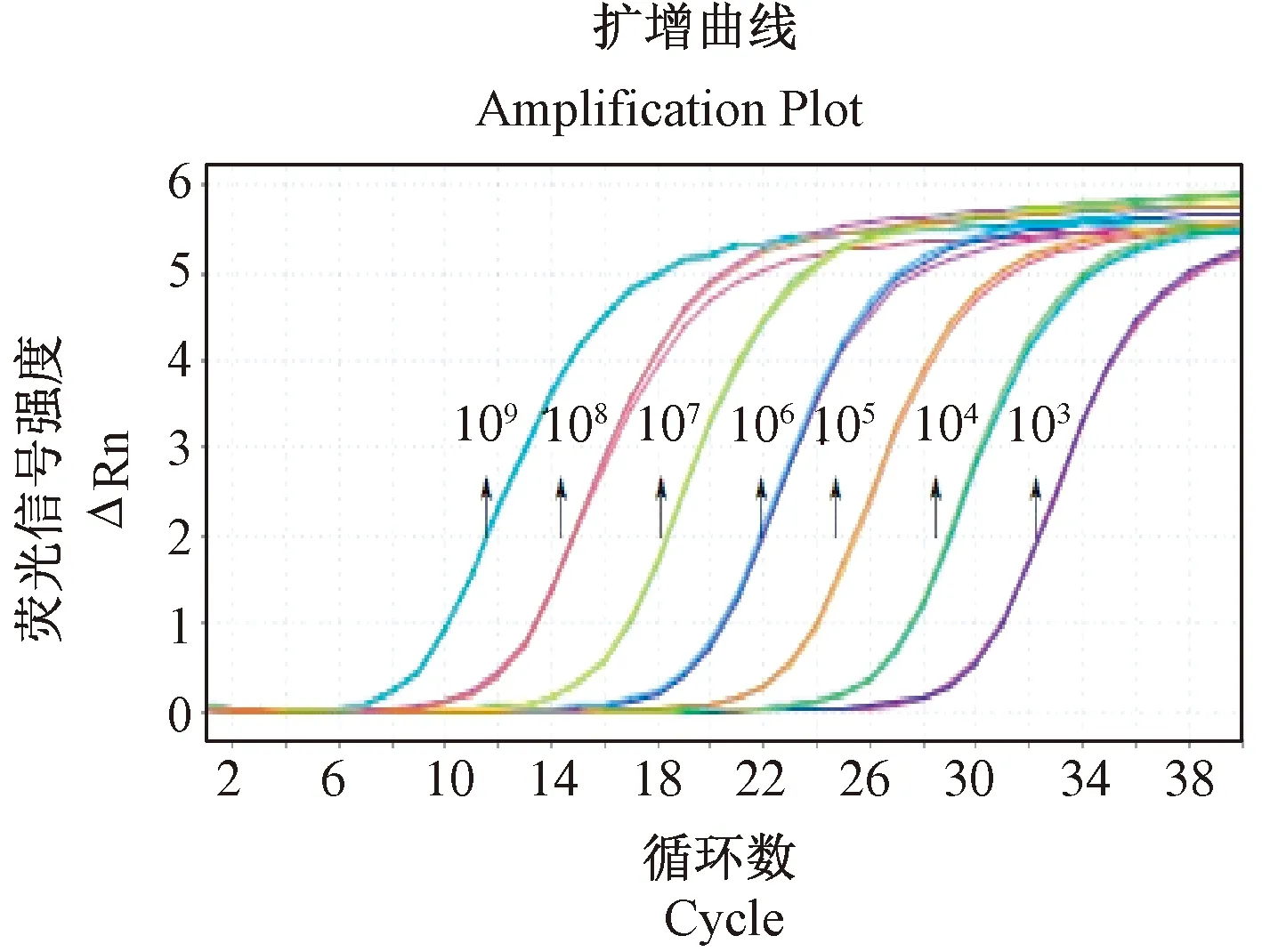
图1 BCV 103~109 copies/μL扩增曲线Figure 1 BCV 103~109 copies/μL amplification curve

注:斜率:-3.417 ,Y轴截距:39.686 ,相关系数:0.999 ,扩增效率:96.195%。图2 BCV FQ-PCR标准曲线Note. Slope: -3.417, Y-lnter:39.686, r2:0.999, Eff%:96.195.Figure 2 BCV FQ-PCR standard curve

注:1:BCV;2-8:BHV-1、BPIV3、BVDV、Reo3、MHV、BTV、N/C。图3 BCV FQ-PCR特异性实验扩增曲线Figure 3 BCV FQ-PCR specificity test amplification curves
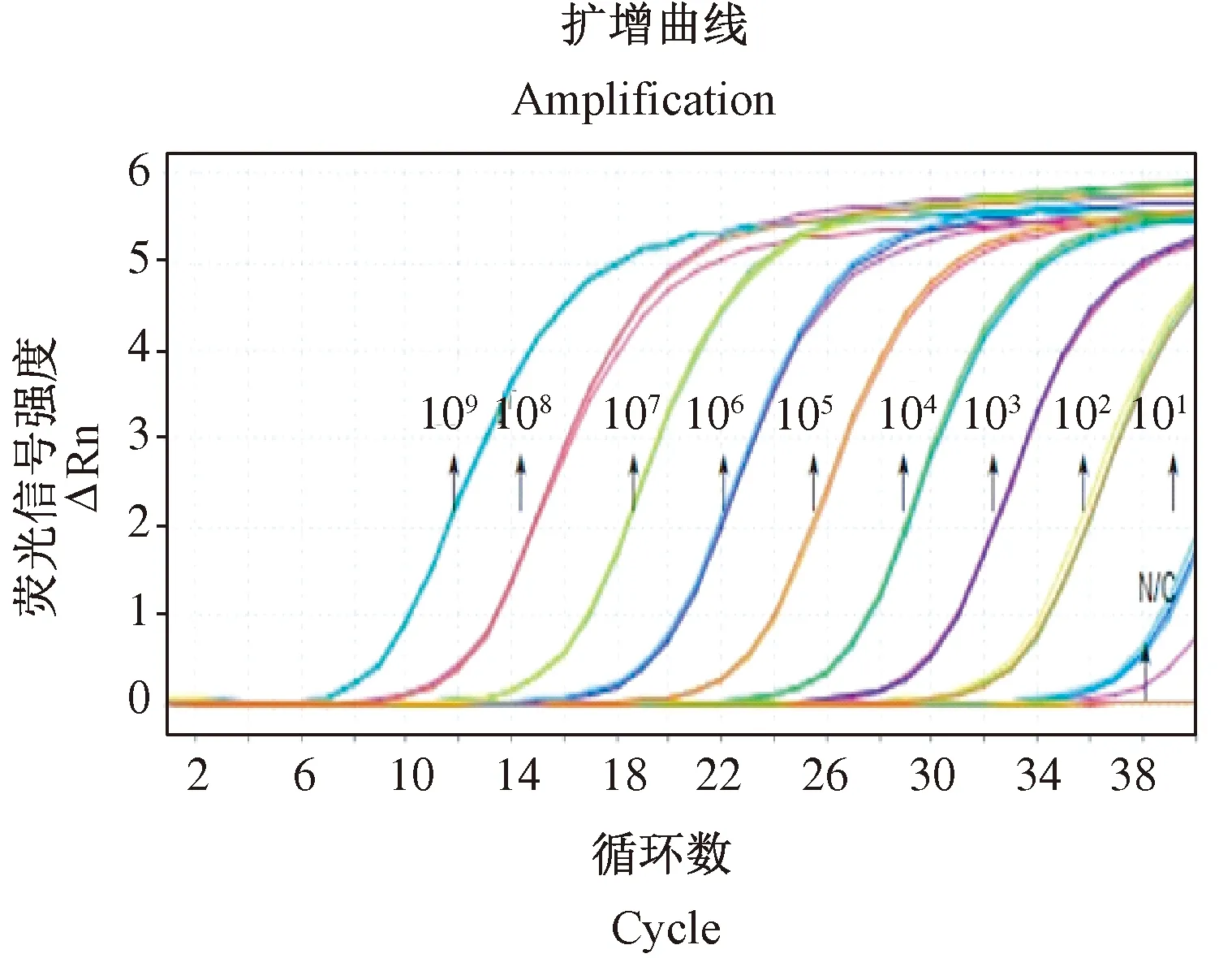
图4 BCV FQ-PCR灵敏度检测扩增曲线Figure 4 BCV FQ-PCR sensitivity test amplification curves
3 讨论
BCV检测方法有很多,但常规检测方法存在耗时长、灵敏性差等不足,FQ-PCR技术以其灵敏度高、速度快、特异性强等优点在基因表达水平分析、突变和多态性研究、病原体的定性和定量检测等方面得到广泛应用。该方法提供了检测BCV的FQ-PCR的引物和探针,以实现对样品的批量检测,有很高的灵敏度和特异性。国内有一些学者建立了BCV的染料法荧光定量PCR[3],TaqMan探针法比染料法荧光定量PCR特异性更高[4]。
为了准确检测BCV,研究人员选取保守性较高,且与MHV序列差异较大的N基因进行引物探针设计。所建立的FQ-PCR检测方法,以重组质粒为标准品,建立的标准曲线各稀释度间距均匀,其标准曲线相关系数Slope为-3.417,相关系数r2为0.999,扩增效率Eff为96.195%。该方法检测BCV的敏感度为40 copies,经特异性验证确定其对BHV-1、BPIV3、BVDV、Reo3、MHV、BTV等病毒无交叉反应,准确性和稳定性检测验证该方法3个浓度梯度3次重复实验Ct值的变异系数(CV)均小于5%,有很好的稳定性和准确性。
污染实验结果说明BCV FQ-PCR在检测BCV病毒和BCV RNA污染的样品时有很好的适用性。污染实验中,可以准确检测的BCV病毒稀释度为10-5,而BCV RNA的稀释度为10-2,有可能是因为RNA在样品的处理过程中降解严重,虽然使用了无RNase的耗材,RNA的降解有可能是使用的鼠神经生长因子或者别的一些原因。
2017年北京制定了实验用牛的地方标准,BCV并未被列入普通级实验用牛需要排除的病原体,然而实验用牛群感染BCV存在一定的病发风险,在进行使用牛做动物实验时也应做全面的考虑[5]。Gomez等[6]对286份牛粪便样本进行BCV检测,发现在健康牛和腹泻牛粪便中均能检测出BCV核酸,且腹泻牛粪便样本的检出率高于健康牛粪便样本。建立的BCV FQ-PCR方法在内蒙古的健康牛群中检测出阳性样本也说明BCV在国内牛群中的普遍流行。BCV可引发冬痢,冬痢的临床病症为腹泻,有时候便血、发烧、抑郁、牛奶减产、厌食症、有时也咳嗽和流鼻涕,致死性不高,然而BCV感染群体有很高的发病率,造成很大的经济损失[7]。
使用2次PCR的方法对阳性样本进行了BCV片段扩增,G63和NY12样品成功扩增出了BCV片段。测序显示其核酸序列与BCV和人冠状病毒都有很高的同源性,与人冠状病毒4408株的序列同源性高达98%。这与文献报道一致[8],且BCV在环境中存活时间较长[9],人鼻粘膜、皮肤、口腔黏膜以及头发都有可能成为BCV的传播载体[10],在人工饲养的牛群和野生反刍动物之间存在交叉感染[11]。因此,为保证牛源性生物制品的安全性,要加强牛源生物制品的质量管理,建立的BCV FQ-PCR检测方法为高通量高敏感性的BCV检测提供了技术支持。
