沉默miR-222上调PUMA基因表达诱导高转移潜能腺样囊性癌细胞凋亡*
2019-04-28周子亮曾秉辉魏常博余东升
周子亮 曾秉辉 魏常博 余东升
涎腺腺样囊性癌(salivary adenoid cystic carcinoma,SACC)属于多见的涎腺肿瘤[1],强侵袭性与早期转移是其重要特征[2]。目前SACC的标准治疗方法是手术切除肿瘤并结合术后放疗[3]。然而,术中无法完全切净的肿瘤细胞以及肿瘤的早期远处转移是影响SACC预后的主要原因[4]。微小RNA(MicroRNA,miRNAs)是一类非编码的单链RNA小分子[5]。其中,miR-222是一种具有促癌作用的miRNA。有研究发现在口腔鳞癌等肿瘤细胞中,miR-221和miR-222表达上调,并与肿瘤的生长活性密切相关[6-8]。然而,关于miR-222在转移性腺样囊性癌细胞中作用的研究是不充分的。p53上调凋亡调控因子(p53 upregulated modulator of apoptosis,PUMA)是Bcl-2家族的一员,位于p53的下游,有强大的促凋亡效应[9]。Karst等[10]用免疫组织化学以及组织芯片的方法检测PUMA的表达,结果提示PUMA的表达抑制与肿瘤发生紧密相关。本文选用涎腺高转移潜能腺样囊性癌细胞SACC-LM,着重检测miR-222与PUMA表达的相关性是否具有特殊性,并观察细胞迁移、增殖、凋亡等行为的变化,希望发现涎腺转移性腺样囊性癌的潜在治疗靶点。
1.材料与方法
1.1 主要材料与试剂 DMEM-高糖培养基、磷酸盐缓冲液(PBS)、胎牛血清(fetal bovineserum,FBS)和青链霉素购自美国Hy Clone公司;Opti-MEM培养基、Trizol裂解液及LipfectamineTMRNAiMAX转染剂(Invitrogen公司,美国);Trypsin-EDTA溶液(Sigma,美国);由上海吉玛公司合成反义miR-222与反义miR-222 NC;PUMA一抗(CST,美国);抗兔IgG二抗(碧云天,中国);BCA蛋白定量试剂盒(生工,中国)。
1.2 细胞培养 在含10%FBS与双抗(100U/ml青霉素、100μg/ml链霉素)的DMEM-高糖培养基培养SACC-LM细胞。在37℃恒温孵育箱中,以5%CO2、95%饱和湿度培养,每隔24h更换1次溶液。
1.3 细胞转染 对数期SACC-LM细胞以1×105个/孔接种在六孔板中,并置于恒温培养箱中过夜。当汇合度为50%时,用1ml无血清无抗生素培养基替换每个孔溶液。配制终浓度为20μmol/L的反义miR-222培养基 600μl(A液)。于 600μl Opti-MEM 培养基中加入 6μl LipfectamineTMRNAiMAX,混匀并静置(B液)。10min后,将A、B液混匀,静置30min。每个孔加入1ml混合液并在37℃放置4h,然后用含有血清的培养基替换。类似地,通过相同的方法将具有FAM荧光标记的As-miR-222 NC转染到SACC-LM细胞中。
1.4 实时荧光定量PCR(qRT-PCR)收集转染细胞用Trizol裂解,再用DNaseⅠ除去基因组DNA。分别以18Sr RNA与U6 snRNA为PUMA和miR-222的内参设计引物。18Sr RNA引物为5'-CCTGG-ATACC-GCAGC-TAGGA-3'(Forward),5'-GCGGC-GCAAT-ACGAA-TGCCCC-3'(Reverse);U6 snRNA引物为5'-CTCGCTTCGG-CAGCA-CA-3'(Forward),5'-AACG C-TTCAC-GAATT-TGCGT-3'(Reverse);PUMA引物为5'-GGGCC-CAGAC-TGTGA-ATCC-3'(Forward),5'-TCACA-CGTGC-TCTCTCTAAA-CC-3';miR-222引物为5'-ACACTCCAGC-TGGGA-GCTAC-ATCTG-GCTACTG-3'(Forward),5'-CTCAA-CTGGT-GTCGTGGA-3'(Reverse)。用ΔΔCT法进行数据统计分析。
1.5 蛋白印迹试验(Western Blot) 将细胞在冰上裂解30min,同时加入PMSF,并取上清以测定蛋白浓度。SDS-PAGE电泳后蛋白转至PVDF膜。将5%脱脂奶粉在37℃下孵育一小时,在4℃下加入一抗过夜,并用二抗在37℃下孵育一小时。用TBST洗膜3次,加入化学发光溶液,并显影。
1.6 Transw ell迁移实验 转染后收集、计数1×105个细胞。在Transwell培养板上室中加入80μl细胞重悬液,并向下室添加500μl有血清的培养基。细胞培养箱中培养12h后,对小室下室侧细胞进行固定染色。采用显微镜观察计数,以x±s表示,评估细胞迁移能力。
1.7 CCK-8检测细胞增殖 转染48小时后,将细胞以1000个/孔接种在96孔板中,并在每组中设置4个复孔。按时间点(0,24,48,72 h)收集细胞,每孔加入10μl CCK-8溶液。在37℃中放置4h后,用酶标仪读出OD450的数值并计算,绘画增殖曲线。
1.8 流式细胞仪检测细胞凋亡和细胞周期 基因转染48h后,向每组收集1×106个细胞,用预冷的PBS洗涤。取0.5ml细胞重悬液,加入Annexin V-FITC 1.25μl,常温暗室放置15min。离心收集细胞,用预冷的缓冲液重悬,加入10μl碘化丙啶(PI),冰上避光孵育10min,随即用流式细胞仪分析凋亡情况。同样的方法收集与洗涤细胞,加入预冷的70%乙醇4℃过夜固定。离心收集细胞并用PBS洗一次,加入500μl PBS(含50μg/ml碘化丙啶,0.2%Triton X-100,100μg/ml RNase A),4℃避光放置30 min,随即用流式细胞仪分析周期分布。
1.9 统计学分析 用SPSS 20.0统计学软件分析数据。通过两独立样本t检验进行样本的两两比较,并通过单因素方差分析比较多组样本。假设为双侧检验,检验水准为α=0.05。
2.结果
2.1 转染效率检测 As-miR-222 NC带有FAM标签,细胞转染6h后,荧光显微镜下观看FAM荧光基团如图所示(图1),表明转染效率较高,可达80%。

图1 荧光倒置显微镜下观察SACC-LM细胞转染效率(×100)
2.2 检测基因转录水平 细胞转染后用qRTPCR检测miR-222与PUMA的转录情况(图2)。转染As-miR-222后,实验组miR-222表达水平明显下调(P<0.05),PUMA转录水平显著增加(P<0.01),差异有统计学意义。

图2 转染对miR-222和PUMA基因mRNA表达水平的影响
2.3 检测细胞PUMA蛋白表达水平 Western Blot结果可见,实验组PUMA蛋白表达显著增强(图3)。使用Image J软件,测量目标蛋白PUMA和内参蛋白GAPDH的灰度值,并计算两者的比值为(0.496±0.016)、(0.474±0.006)和(0.875±0.058)。转染后实验组PUMA蛋白表达显著增加(P<0.01),提示miR-222的沉默可以消除其对PUMA的靶向抑制作用。
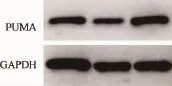
图3 转染后SACC-LM各组细胞PUMA蛋白的表达情况
2.4 检测细胞迁移能力 计算每组中细胞迁移的数量(表1),数据显示实验组中通过小室的细胞数量显著减少(P<0.01,图4),说明抑制miR-222可降低SACC-LM细胞的运动能力。
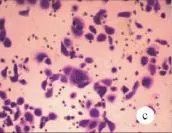
图4 转染后SACC-LM细胞迁移实验检测(×100)
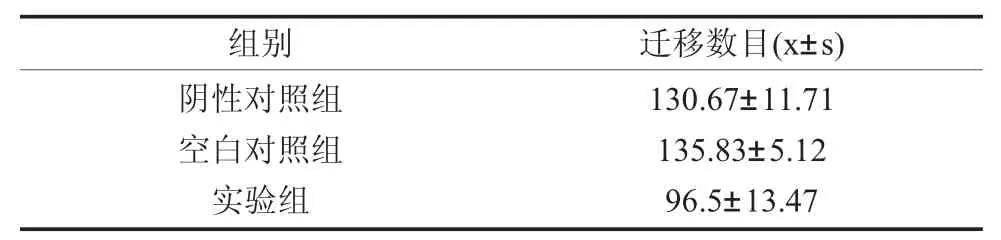
表1 各组SACC-LM细胞的迁移数目(×100)
2.5 检测细胞增殖能力 计算各组的OD450比值,画图反映出各个时间点的细胞生长状况。结果显示阴性对照组细胞的增殖变化不明显,而实验组细胞的增殖则有显著降低(P<0.01,图5)。提示miRNA-222的确能促进高转移潜能涎腺腺样囊性癌细胞SACC-LM增殖,通过沉默miRNA-222表达能抑制细胞增殖。
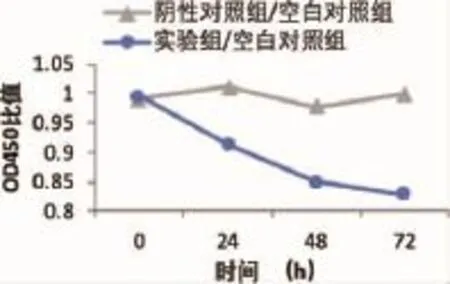
图5 转染后SACC-LM细胞的增殖情况
2.6 检测细胞凋亡情况与周期分布 流式细胞术检测细胞凋亡,总细胞凋亡率分别为18.59%、19.65%和27.13%,实验组凋亡率显著增加(P<0.01,图6)。同样,检测细胞周期,实验组G0/G1期的细胞比例显著增加,而S期和G2/M期则相应减少(P<0.01,表2)。说明沉默miRNA-222能影响SACC-LM细胞周期分布,并促进其凋亡。3.讨论
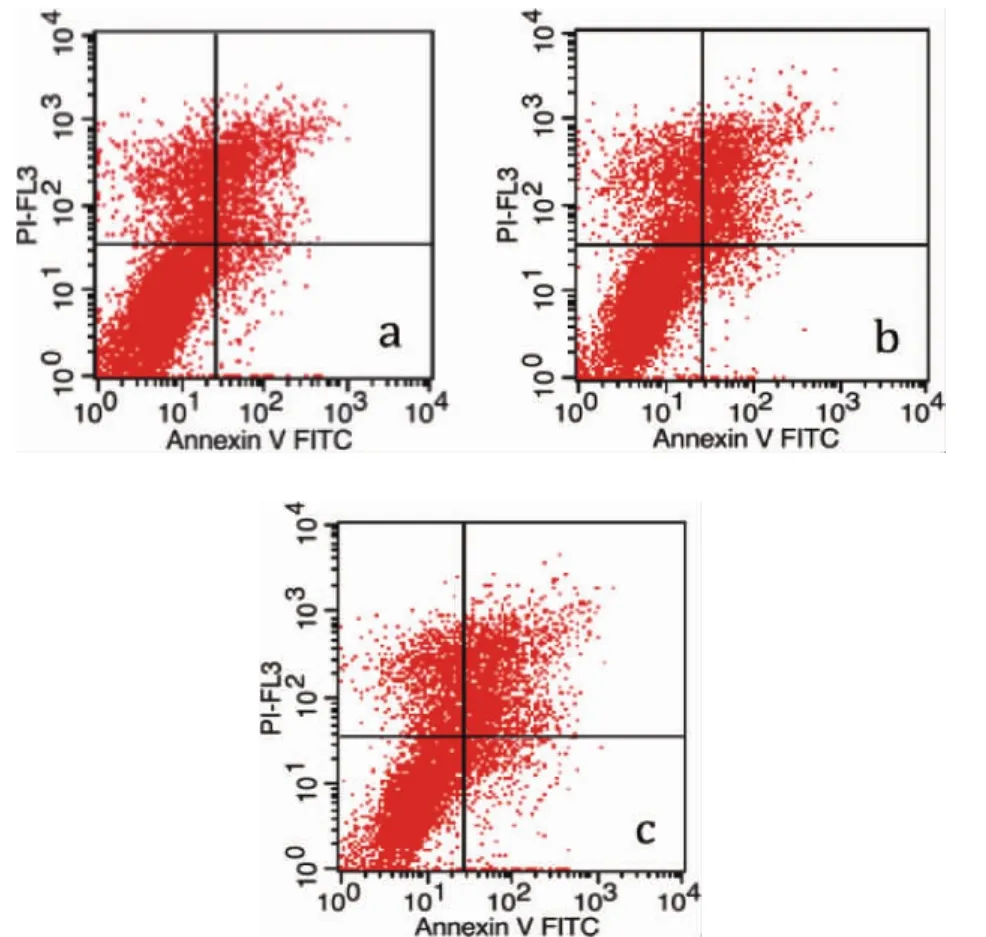
图6 转染后SACC-LM各组细胞凋亡情况
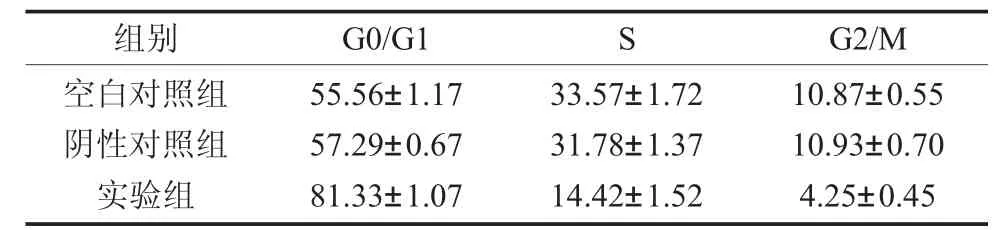
表2 转染后各组细胞周期分布(x±s,%)
PUMA在细胞的凋亡过程中起重要作用[11,12]。有研究表明,细胞凋亡的行为能防止肿瘤的发生[13],若PUMA基因突变或缺失,则使凋亡的发生率降低。在恶性肿瘤中,PUMA上游基因p53受损、PUMA启动子甲基化、Bcl-2蛋白家族抗凋亡蛋白过表达等因素均能导致PUMA等表达降低,抑制PUMA的促凋亡功能[14]。可以看出,通过过表达肿瘤细胞的PUMA基因,可以增强PUMA介导的细胞凋亡效应,以达到治疗肿瘤的目的。
越来越多的miRNAs被研究所证实与肿瘤生长、分化、迁移、侵袭、转移、凋亡等行为密切相关,是肿瘤治疗的潜在靶点[15]。miRNAs在许多肿瘤中表达是异常的[16],可以看出它在肿瘤的发展中起重要作用。其中,miR-222是常见的促癌miRNAs,在一些肿瘤中高表达,如脑胶质母细胞瘤[17]、甲状腺乳头状癌[18]、前列腺癌[19]等,并与其生长密切相关。Zhang[20]等报道抑制miR-222能上调脑胶质母细胞瘤细胞表达PUMA,并促进细胞凋亡。提示miR-222可以负调节PUMA的表达并影响细胞。miR-222与miR-221是成簇分布的miRNA,二者相邻并呈前后排列,人miR-221/222核心序列完全同源,有报道PUMA与PTEN是其主要的共同靶基因[21,22]。其中,PTEN能阻断PI3K/Akt信号通路,抑制肿瘤生长,促进细胞凋亡[23]。Yang等[6]发现miR-221和miR-222同时在口腔鳞癌中高表达,且表达水平与肿瘤生长活性高度相关。同时沉默miR-221/222可使PUMA与PTEN显著上调[21]。提示以miR-221和miR-222作为联合靶点的基因治疗可能更具优势,值得进一步的探索。
本实验通过向高转移潜能腺样囊性癌细胞SACC-LM转入反义链,沉默细胞内源性miR-222,进而提高细胞表达PUMA。并进一步通过细胞功能实验证实,上调SACC-LM细胞的PUMA表达水平,有助于抑制其增殖、迁移的能力,并显著影响细胞周期,诱导凋亡的发生。综上所述,本研究通过沉默miR-222上调PUMA表达,揭示出治疗转移性腺样囊性癌的潜在靶点,并有望为临床开发抗癌药物提供参考。
