不同贮藏条件对五味子质量的影响
2019-04-27陈舒妤石婧婧邹立思刘训红唐仁茂马继梅
陈舒妤,石婧婧,邹立思,刘训红*,唐仁茂,马继梅,严 颖,赵 慧
1南京中医药大学药学院,南京 210023;2江苏苏中药业集团股份有限公司,泰州 225500
五味子为大宗常用中药材,系木兰科植物五味子Schisandrachinensis(Turcz.)Baill.的干燥成熟果实,具有收敛固涩,益气生津,补肾宁心的功效,用于久嗽虚喘,自汗盗汗,内热消渴,心悸失眠等症[1]。现代研究表明,五味子主要含有木脂素、有机酸、挥发油等化学成分,具有降酶保肝、抗氧化、抗肿瘤、抗菌和抗病毒等作用[2-4]。中药疗效的发挥是多种成分综合作用的结果,针对五味子多元活性成分的特点,建立多元活性成分同时测定的方法,对探讨多指标成分的综合评价体系具有实用性和有效性。
药材的贮藏是中药材品质形成的重要环节,有效的贮藏技术可以减少贮藏过程中由于自身特点及贮藏环境因素对中药材质量产生的不良影响,确保临床用药的疗效。一般研究认为药材贮藏造成质量下降的关键因素是药材含水量、贮藏湿度、温度和时间,尚少见对包装材料的研究。目前,关于五味子药材的品质评价及储藏研究,主要集中于木脂素和有机酸类成分的分析,多以某一类成分中的一种或多种化合物为评价指标,尚少见对上述多元指标成分同时测定的研究报道。其分析方法有高效液相色谱法(HPLC)[5]、超高效液相色谱法(UPLC)[6]、液相色谱-质谱联用技术(LC-MS)[7]等。HPLC难以解决组分共流出现象[8],LC-MS 技术具有灵敏度高、选择性强、分析速度快的优点,更适于中药复杂体系的分离分析。其中,在四级杆-线性离子阱(QTRAP)系统下,MS/MS谱的灵敏度较标准三重四级杆高出数十倍至数百倍,则可以得到更丰富的MS/MS 数据[9]。本实验基于超快速液相色谱-串联四级杆/线性离子阱质谱(UFLC-QTRAP-MS/MS)技术,同时测定五味子中木脂素及有机酸共15种指标成分的含量,并结合灰色关联度分析[10]和TOPSIS法对不同贮藏条件(不同包装材料,不同贮藏温度)五味子药材进行比较分析与综合评价,旨在为五味子适宜储藏条件的优选提供基础资料,同时为五味子药材内在质量的综合评价和全面控制提供新的方法参考。
1 仪器与材料
1.1 仪器
SIL-20A XR超快速液相色谱仪(日本Shimadzu公司);AB QTRAP 4500 型三重四级杆线性离子阱质谱仪(美国AB SCIEX公司);Q-500B高速多功能粉碎机(上海冰都电器有限公司);ME36S型电子分析天平(德国赛多利斯公司,1/100万);KQ-500B超声波清洗机(昆山超声仪器有限公司,超声功率500 W,40 kHz);湘仪H1650-W高速离心机(湖南湘仪实验室仪器开发有限公司);Milli-Q超纯水制备仪(美国Millipore公司)。
1.2 试药与试剂
五味子甲素(批号:110764-200408)、五味子乙素(批号:110765-200407)、五味子醇甲(批号:110857-200709)、五味子酯甲(批号:111529-200503)、L-苹果酸(批号:190014-201302)购自中国食品药品检定研究院,纯度均大于98%;五味子丙素(批号:lw16051601)、五味子醇乙(批号:lw16071904)、五味子酯乙(批号:lw16100801)、戈米辛:D(批号:lw16032405)、戈米辛:J(批号:lw16092404)、当归酰基戈米辛:H(批号:lw16072204)、五味子酚(批号:lw16012701)、奎宁酸(批号:lw16071201)、酒石酸(批号:lw15122605)购自南京良纬生物科技有限公司,纯度均大于98%;原儿茶酸(批号:YECS20140411)购自南京春秋生物工程有限公司,纯度大于98%;乙腈、甲酸为色谱纯,德国Merck公司产品;甲醇(批号:143135)为色谱纯,江苏汉邦科技有限公司;实验用水为Milli-Q超纯水。
1.3 材料
五味子药材由苏中药业集合股份有限公司提供,产地:吉林,批号:17032802,规格统货,经南京中医药大学刘训红教授鉴定为木兰科植物五味子Schisandrachinensis(Turcz.)Baill.的干燥成熟果实,留样凭证存放于南京中医药大学中药鉴定实验室。样品由作者自己按不同贮藏条件(不同包装材料,不同贮藏温度)每份500 g贮藏半年后取出,样品信息见表1。
2 实验方法
2.1 对照品溶液制备
精密称取奎宁酸、酒石酸、L-苹果酸、原儿茶酸、五味子醇甲、戈米辛 D 、戈米辛 J、五味子醇乙、当归酰基戈米辛 H 、五味子酯乙、五味子酚、五味子甲素 、五味子乙素 、五味子丙素、五味子酯甲的对照品适量,置5 mL量瓶中,加甲醇溶液溶解制成质量浓度分别为950.00、998.00、1 570.00、1 110.00、970.00、920.00、846.00、972.00、982.00、960.00、996.00、960.00、978.00、978.00、1 024.00 μg/mL的对照品储备液,供分析用。取各对照品储备液适量,加甲醇定容至10 mL制成混合对照品溶液,并逐级稀释,得到一系列不同浓度的混合对照品溶液,供分析用。
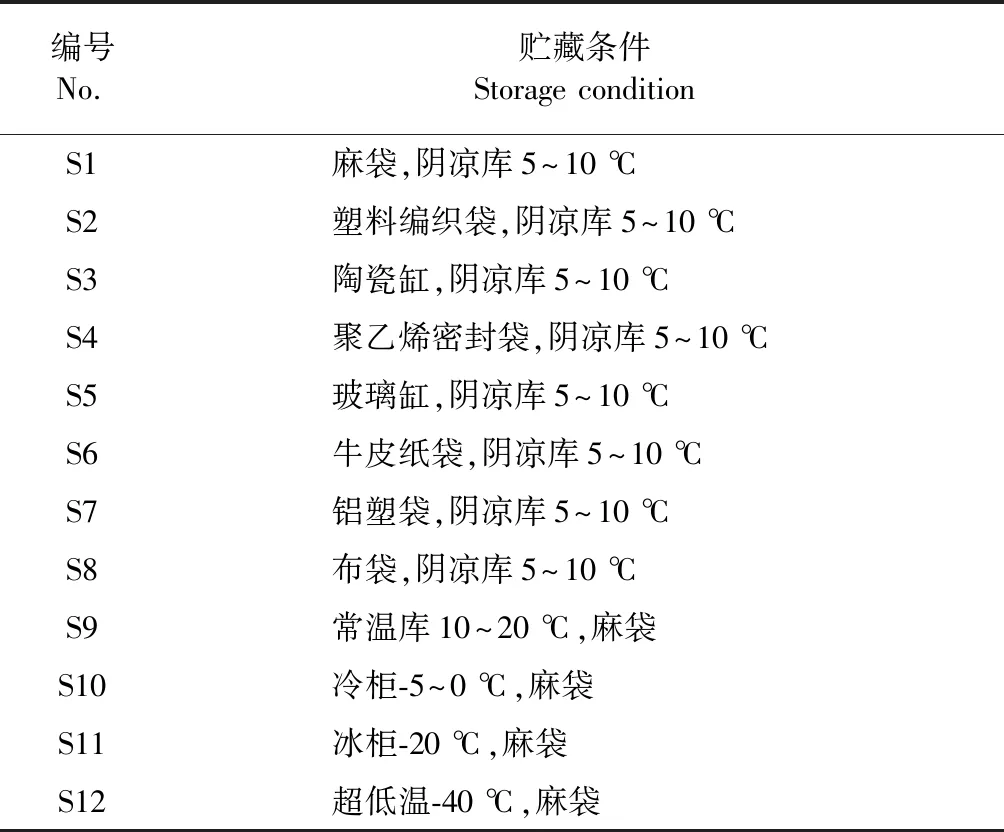
表1 不同贮藏条件样品信息
注:S1~S8:贮藏于阴凉库中考察不同包装材料样品;S1,S9~S12:以麻袋为包装材料考察不同贮藏温度样品。
Note:S1-S8:All stored in cool warehouse to research different package materials;S1,S9-S12:All stored in sacks to research different temperature.
2.2 供试品溶液制备
精密称定样品粉末0.5 g,精密量取加入甲醇20 mL,密闭,称重,超声处理(功率500 W,频率40 kHz)40 min,放置冷却,再次称重,用甲醇补足质量损失,过滤,滤液(12 000 rpm)离心10 min,取上清液,过0.22 μm微孔滤膜滤过,取续滤液用甲醇稀释25倍即得供试品溶液。
2.3 色谱条件
色谱柱:SynergiTMHydro-RP 100Å 柱(100 mm × 2.0 mm,2.5 μm);流动相:A为 0.1%甲酸水溶液,B为乙腈;梯度洗脱程序:0~4 min、30%~52% B,4~8 min、52%~75% B,8~11 min、75%~90% B,11~15 min、90%~30% B,15~17.10 min、30%~30% B;柱温40 ℃;流速0.4 mL/min;进样量1.0 μL。
2.4 质谱条件
离子化方式:电喷雾离子源(ESI);多反应监测离子扫描模式(MRM)检测;气帘气流速35 L/min;雾化气流速55 L/min;辅助气流速55 L/min;离子源温度550 ℃;喷雾电压:正离子模式下5 500 V,负离子模式下-4 500 V。15种成分的质谱具体参数见表2。

表2 15种成分的质谱分析参数
2.5 分析方法
采用SynergiTMHydro-RP 100Å色谱柱对色谱分离条件进行优化,按照优化的条件进行UFLC-QTRAP-MS/MS分析,并做方法学考察,用外标法计算各样品中15种功效成分的含量。根据含量测定结果,用灰色关联度及TOPSIS分析对不同贮藏条件五味子药材进行综合评价。
3 实验结果
3.1 提取条件优化
实验分别考察了提取溶剂(50%、70%、100%甲醇)、料液比(1:20、1:40、1:60)及提取时间(20、40、60 min)。结果表明,以100%甲醇作为提取溶剂,料液比1:40,超声40 min时相对峰面积较大。
3.2 色谱、质谱条件优化
实验考察了不同流动相(甲醇-水、乙腈-水、甲醇-0.1%甲酸水、乙腈-0.1%甲酸水)及梯度洗脱条件对样品中各峰色谱峰形及分离度的影响。结果显示,采用乙腈-0.1%甲酸水溶液梯度洗脱时,峰形更好且有良好的分离效果。因此选择0.1%甲酸水-乙腈作为流动相梯度洗脱。实验同时选用正、负离子模式测定15种目标成分的含量,其中4种有机酸(L-苹果酸、酒石酸、原儿茶酸、奎宁酸)在负离子模式下有较强的离子响应和更好的峰形,其他成分在正离子模式下有较强的离子响应和更好的峰形。
3.3 方法学考察
3.3.1 标准曲线、检测限和定量限
精密吸取“2.1”项下一系列浓度的混合对照品标准溶液,按“2.3”项和“2.4”项条件进样分析,以对照品的峰面积(Y)对相应的浓度(X)进行线性回归,得到回归方程、相关系数和线性范围;以各化合物的3倍信噪比(S/N)相对应的浓度为检测限(LOD),以各化合物的10倍信噪比(S/N)相对应的浓度为定量限(LOQ)。结果见表3,图1。

表3 15种成分的线性方程、相关系数、检测限和定量限
3.3.2 精密度、重复性、稳定性实验
取“2.1”项下制备的混合对照溶液,进样量为1 μL,连续自动进样6次,记录15种目标成分峰面积并计算RSD;取S1样品,按“2.2”项下方法制备供试品溶液,吸取1 μL进样,重复测定6次,计算各目标成分含量的RSD;取S1样品,按“2.2”项下方法供试品溶液,分别在0、2、4、8、12、24 h测定,记录15种目标成分峰面积并计算RSD,结果见表4。
3.3 .3加样回收率实验
精密称取9份已知含量的S1样品各0.25 g,置于锥形瓶中,平均分为三组,分别加入3个不同水平(80 %、100 %、120 %)的各对照品溶液适量后,震荡均匀,按“2.2”项下方法制备加样回收率供试品溶液,分别进行测定,结果见表5。

图1 15种成分的MRM图Fig.1 Extracted ion current chromatograms of fifteen components注:1.奎宁酸;2.酒石酸;3.L-苹果酸;4.原儿茶酸; 5.五味子醇甲;6.戈米辛D;7.戈米辛J;8.五味子醇乙;9.当归酰基戈米辛H;10.五味子酯乙;11.五味子酚;12.五味子甲素 13.五味子乙素;14.五味子丙素;15.五味子酯甲Note:1.Quinic acid;2.D(-)-Tartaric acid;3.(S)-malic acid;4.Protocatechuic acid;5.Schisandrin;6.Gomisin D;7.Gomisin J;8.Schisandrol B;9.Angeloylgomisin H;10.Schizantherin B;11.Schisanhenol; 12.Deoxyschizandrin;13.γ-schisandrin;14.Schizandrin C;15.Schisantherin
表45种目标成分的精密度、重复性、稳定性(%,n=6)
Table 4 Precisions,repeatabilities and stabilities of fifteen components(%,n=6)

化合物Compounds精密度RSDPrecision RSD重复性RSDRepeatability RSD稳定性RSDStability RSD12.43.51.123.12.12.331.83.21.242.32.53.353.10.73.161.11.51.272.03.03.082.62.40.892.51.63.1101.01.32.3112.64.91.5120.91.61.3131.90.51.1142.23.82.5150.72.21.0

表5 15种目标成分加样回收率(%,n=3)
续表5 (Continued Tab.5)

化合物Compounds样品含量Content in sample(μg)加入量Standard added(μg)测得值Measured加样回收率Recovery平均回收率±RSDAverage recovery ± RSDGomisin D32.44432.2006496.9632.44438.6407096.33戈米辛 J111.06588.83019998.6398.31±0.66Gomisin J111.065110.82622098.59111.065133.66824297.70五味子醇乙631.419505.440113299.0599.01±0.43Schisandrol B631.419631.800125698.85631.419758.160138399.13当归酰基戈米辛 H272.034218.00449099.8499.59±0.5Angeloylgomisin H272.034272.01454299.24272.034327.00659899.68五味子酯乙217.628173.76039099.0299.11±0.55Schizantherin B217.628217.92043398.98217.628261.12047799.33五味子酚68.87954.78012398.1997.92±1.95Schisanhenol68.87968.72413798.6368.87982.66814996.92五味子甲素166.465133.44029797.8398.71±0.82Deoxyschizandrin166.465166.08033198.86166.465199.68036599.42五味子乙素756.206604.404135899.6399.69±0.18γ-schisandrin756.206755.994151099.75756.206907.584166199.69五味子丙素162.472130.07429198.5798.15±0.63Schizandrin C162.472162.34832197.64162.472194.62235498.24五味子酯甲743.694595.149133899.8999.92±0.05Schisantherin743.694743.936148799.89743.694892.723163699.97
3.4 样品含量测定
取五味子供试品溶液,按照上述色谱-质谱条件测定,根据相应线性关系计算供试样品中15种成分的含量,测定结果见表6。

表6 五味子中15成分含量(μg / g,n = 3)
续表6(Continued Tab.6)

Serial No.108141312155116793241S5487.422936.48636.242836.60638.232017.586102.68284.6684.60406.511148.622407.116.539738.314314.82S6461.452906.51623.252776.67641.231957.656032.76254.69114.86483.421128.652786.6610.499208.955103.88S7473.432467.04566.322407.11539.3515.385783.06255.6978.61318.62961.852357.176.687341.194045.15S8456.452856.57575.312646.82597.2823.676292.45232.7278.01466.441078.712397.125.977980.424115.06S9798.882895.95653.092766.13656.0839.345951.67276.61117.84372.481158.383285.406.389896.156540.84S10738.972646.30572.202616.34590.1798.865712.00233.6764.01485.321028.562616.348.616620.733854.60S11500.302466.55545.242446.57541.2462.215592.17227.6899.26288.60995.612846.0211.084903.145522.27S12384.542307.23535.362297.24551.3439.755353.58227.7368.22269.68811.032616.868.954824.214874.15
3.5 灰色关联度法和TOPSIS法
按照文献[10,11]进行数据处理,各样品的关联度ri和相对接近度Ci及其排序(见表7)。

表7 评价对象的ri和Ci值及其排序
注:差异是指各评价对象与最优评价对象的差距,差异=(关联度或Ci最大值-各评价对象关联度或Ci值)/最大值×100%。
Note:Differences of rior Ciwere the distance between each sample and the best sample,difference=(MAX rior MAX Ci- rior Ci)/MAX×100%.
3.6 灰色关联度分析与TOPSIS分析比较
根据表7,对比2个排序,可知灰色关联度分析和TOPSIS 分析结果基本一致,均以S4样品综合质量最优,其次是S3、S1样品,分别为以聚乙烯密封袋、陶瓷缸、麻袋为包装材料贮藏于阴凉库的样品。以麻袋为包装材料考察不同贮藏温度的样品,贮藏于常温及阴凉库的样品综合质量较好,其余样品综合质量较差,尤其是贮藏于超低温的样品S12,可见不是贮藏温度越低越好。ri与Ci的最大差异分别达到57.5 %与81.3 %,因此TOPSIS 分析能够更好的区分样品的质量优劣。
4 结论
中药材的干燥储藏是最常见的一种药材保存方法,但不适宜的贮存条件会引起霉变、虫蛀及有效成分的含量变化,降低药材的质量[5,12]。有效的贮藏技术可以减少不良因素对药材质量的影响,确保临床疗效。针对目前五味子贮藏研究尚少、实际贮藏尚无规范标准的情况,本实验以15种功效成分为考察指标,探讨不同贮藏温度(常温、阴凉库、冷库、冰柜、低温柜)及不同包装材料(麻袋、塑料编织袋、陶瓷缸、聚乙烯密封袋、玻璃缸、牛皮纸袋、铝塑袋、布袋)对五味子药材质量的影响。含量测定结果表明,所分析的五味子样品中,五味子醇甲含量均大于0.04%,符合《中国药典》2015版一部的标准;木脂素类成分以五味子醇甲和五味子醇乙的含量较高,有机酸类成分以原儿茶酸和奎宁酸的含量较高。由于不同贮藏条件五味子样品中木脂素类及有机酸类15种目标成分的含量不一,难以直观判断,因而采用灰色关联度分析及TOPSIS分析进行综合评价,分析结果显示,S4的综合质量最好。聚乙烯密封袋具有较好的密封性,能有效防止潮湿空气的渗入,在贮存过程中减少外界环境的影响,这与如今大多数中药房五味子药材的包装材料一致。贮藏于阴凉库的样品S1、S3的综合质量也较好,显示麻袋和陶瓷缸也是较好的包装材料,麻袋具有良好的保温性和吸潮性,而陶瓷缸的防潮性和隔热性良好,一般情况下外界热空气和潮湿空气不易渗透进入。麻袋较陶瓷缸更为轻便,在实际大生产中可以考虑使用。贮藏于阴凉库的样品S1~S6综合质量较好,说明阴凉库是贮藏五味子较为适宜的温度。
本实验采用超快速液相色谱-串联四级杆/线性离子阱质谱(UFLC-QTRAP-MS/MS)同时测定五味子中木脂素类及有机酸类共15种指标成分的含量,并结合灰色关联度分析和TOPSIS法对不同贮藏条件五味子药材进行比较分析与综合评价。所建立的方法准确、可靠,可用于五味子药材内在质量的综合评价,本研究可为五味子适宜储藏条件的优选提供基础资料。
