火棘多糖铁(Ⅲ)复合物中铁含量检测方法的建立
2019-04-27付启明蔡易睿钟方旭鄢又玉
蒋 莉,付启明,王 磊,蔡易睿,钟方旭,鄢又玉
武汉轻工大学生物与制药工程学院,武汉 430023
火棘Pyracanthafortuneana(Maxin.)Li又名救军粮、火把果、红子、吉祥果、状元红等,是蔷薇科苹果亚科火棘属的一种常绿植物灌木,主产于云南、贵州、四川、湖南、湖北等地。其中全缘火棘、窄叶火棘、细圆齿火棘等三个品种在湖北分布较广,资源丰富。目前已被国家卫生部批准作为新食品资源[1]。火棘果资源丰富,每年仅在湖北省的年产量就高达5万吨[2]。火棘果中含有多种营养成分,如多糖、多酚、果胶、黄酮、原花青素等[3],其中可溶性多糖的含量占10%~13%左右。在现代科技中,人们将多糖与一些金属或者非金属相结合,产生了意想不到的功能效果[4]。
缺铁性贫血(IDA)是当前发病率最高的营养素缺乏病之一,同时伴有慢性疲劳、烦躁不安、免疫功能紊乱、情绪或认知障碍、记忆力减退等症状,婴幼儿及学龄前儿童缺铁更有可能影响儿童脑部发育[5,6]。铁补充剂的发展可分为三代:无机铁剂,小分子有机铁剂,多糖铁复合物。其中一代无机铁剂的铁腥味重,生物利用度低;二代小分子有机铁剂吸收易饱和,有游离铁毒性,治疗周期长[7];第三代于1947年证明静脉注射多糖铁复合物的安全性,多糖铁复合物可治疗缺铁性贫血[8]。多糖铁复合物作为铁元素补充剂在体内具有多糖的多种生物活性、普遍耐受性与较高的生物利用度,相对可减缓对胃肠道刺激,且吸收率不受胃酸减少及食物成分的影响。作为目前行之有效的缺铁性贫血补铁剂[9],多糖铁复合物在应用于静脉补铁方面取得了较大的发展[9]。
常见的多糖铁复合物的制备方法有氯化铁共热合成及硫酸铁铵化学合成等[10,11],制得植物多糖类铁复合物一般为棕黑色粉末,易溶于水、无臭无味且不溶于无水甲醇、乙醇及乙醚等有机溶剂[12]。本文是基于前人对多种植物多糖铁复合物的合成工艺优化[13-17],进而改良合成火棘多糖铁复合物。利用紫外分光光度计检测多糖铁复合物中铁含量的原理[18],结合其他植物多糖铁中铁含量的特定检测条件[19,20],优化得到火棘多糖铁复合物中铁含量检测的最优条件。此方法可应用于补铁剂的制备与检测,同时也可推广应用于其它植物多糖铁复合物的含量测定。
1 材料与方法
1.1 试剂与仪器
火棘果:2016年10月下旬采集于湖北省恩施来凤地区,经华中科技大学植物学博士杨悦鉴定为全缘火棘Pyracanthaatalantioides(Hance) Stapf的果实。FeCl3、邻菲啰啉、抗坏血酸、无水乙醇及氢氧化钠均为分析纯,实验用水为自制去离子水;UV-5900PC紫外可见分光光度计,上海元析仪器有限公司;BS系列分析天平,北京赛多利斯仪器系统有限公司;SB5200DTS双频超声波清洗机,宁波新芝生物科技股份有限公司;HSJ-6系列恒温水浴搅拌器,江苏金坛市科析仪器有限公司;HH-S1数显恒温水浴锅,江苏金坛市医疗仪器厂;XH-C漩涡混合器,江苏金坛市医疗仪器厂;GR21G高速冷冻离心机,日本HATACHI公司;DHG-9070A高速冷冻离心机,日本HATACHI公司;DHG-9070A电热恒温鼓风干燥箱,上海精宏实验设备有限公司。
1.2 实验方法
1.2.1 PPC的合成
称取一定量已脱色脱蛋白后的PPC冻干粉末,置于锥形瓶中,以去离子水溶解并加入柠檬酸三钠溶液,控制溶液pH在8.0~9.0之间,在搅拌状态下交替滴加FeCl3溶液和NaOH溶液,直到溶液中出现的红棕色沉淀不再溶解为止。70 ℃水浴1.5 h。待溶液冷却至常温后,在15 000 rpm的转速下离心15 min,将离心后的红棕色上清液转移至2倍体积的无水乙醇中,醇沉过夜。醇沉后的溶液再次离心,取沉淀用无水乙醇洗涤两次,15 000 rpm离心10 min,将离心后的沉淀冷冻干燥,保存备用,即为PPC冻干粉。
1.2.2 铁含量的测定
取冻干PPC粉末0.05 g,以去离子水溶解并定容至100 mL,即为待测样品溶液。取1.0 mL加入抗坏血酸溶液和邻菲啰啉溶液,去离子水定容至50 mL,摇匀水浴一定时间后作紫外全波段扫描并确定于510 nm处测吸光度。
1.2.3 单因素实验
考察了反应时间(1.0、1.5、2.0、2.5及3.0 h)、抗坏血酸浓度(2%、4%、6%、8%、10%、12%)和用量(0.5、1.0、1.5、2.0、2.5、3.0 mL)、邻菲啰啉溶液的浓度(0.05% 、0.10% 、0.15% 、0.20%、0.25%)和用量(1.0、2.0、3.0、4.0、5.0、6.0 mL)以及水浴温度(20、30、40、50、60、70 ℃)对PPC中铁含量检测的影响。
1.2.4 响应面优化实验
在单因素实验的基础上,运用响应面软件中Box-Behnken设计原则,选择反应时间(A),水浴温度(B)和10%抗坏血酸溶液的用量(C)这三个显著因素进一步优化,以吸光度值作为响应值。设计如下表1所示。

表1 Box-Behnken 设计因素水平及编码值
1.2.5 方法学验证
经过响应面优化得到PPC中铁含量检测的最优条件后,进一步对该方法进行方法学验证,即考察其重复性、重现性、稳定性及回收率等。
2 结果与讨论
2.1 单因素实验

图1 反应时间(A)、邻菲啰啉用量(B)、抗坏血酸用量(C)、邻菲啰啉浓度(D)、抗坏血酸浓度(E)及水浴温度(F)对火棘多糖铁Ⅲ复合物中铁含量的测定的影响Fig.1 The influence of reaction time(A),the dosage of O-phenanthroline (B) and ascorbic acid(C),O-phenanthroline concentration(D),ascorbic acid concentration(E)and incubation temperature (F) on the determination of iron content from PPC
如图1(A)所示,当反应时间小于2.0 h时,随着时间延长,吸光度先急剧上升再渐趋平缓,至2.0 h时吸光度最大。因为邻菲啰啉不能和Fe3+直接络合或与Fe3+形成的配合物稳定性差,说明此过程中抗坏血酸正不断将Fe3+还原为Fe2+,Fe2+与邻菲啰啉发生直接络合,反应时间接近2.0 h时,Fe3+全部被还原为Fe2+,吸光度达到极值。随反应时间继续延长,抗坏血酸在还原Fe3+时会使溶液酸性增强,一定程度上部分破坏邻菲啰啉与Fe2+的络合物,使吸光度值逐渐减小。由此可知,邻菲啰啉检测PPC中铁含量的最佳反应时间为2.0 h。由图1(B)可知,随着邻菲啰啉溶液用量增加,吸光度先增加并于添加量3.0 mL时达到极值,后趋于平缓,说明邻菲啰啉用量达3.0 mL时,已足够与体系中Fe2+完全反应。继续增加其用量吸光度无明显变化,故确定邻菲啰啉溶液的最佳用量为3.0 mL。由图1(C)可知,当抗坏血酸溶液的用量增加至1.0 mL期间,吸光度先增至极值,说明1.0 mL抗坏血酸已基本将体系中Fe3+完全还原为Fe2+,继续增加用量,体系酸性增强且体系含水量增加,反而破坏了络合物的稳定,因此抗坏血酸溶液用量取1.0 mL最适。同理,由图1(D)可知,随着邻菲啰啉溶液浓度增加,吸光度先升后渐趋平缓,邻菲啰啉为0.1%时吸光度达到极值,说明此时体系中已经有足量的邻菲啰啉可与Fe2+充分反应,选此浓度较为合适。由图1(E)可知,随抗坏血酸溶液浓度增加,吸光度先急剧上升,于10%时达到极值,而后趋于平缓。说明一定量10%抗坏血酸已足够将PPC中的Fe3+还原成Fe2+,继续增加用量已无现实意义,故抗坏血酸溶液浓度10%最佳。由图1(F)可知,随着水浴温度升高,吸光度总体呈先升后降趋势。说明一定范围内升高温度有助于加快进行,但温度过高易使络合物分解,故选40 ℃较适。
2.2 响应面优化实验
在单因素实验基础上,确定10%抗坏血酸、3.0 mL 0.1%邻菲啰啉溶液前提下,进一步以响应面Box-Behnken设计优化了反应时间、水浴温度和10%抗坏血酸溶液用量3个显著因素对含量检测的影响,具体如表2所示。
优化实验完成后,以Design Expert8.06软件对结果进行二次多项式拟合,得到回归方程:Y=0.43+0.006 25A+0.023B+0.013C-0.003AB-0.002AC+0.005 75BC-0.003 375A2-0.068B2-0.023C2。对其进行方差与显著性分析,结果如下表3所示。
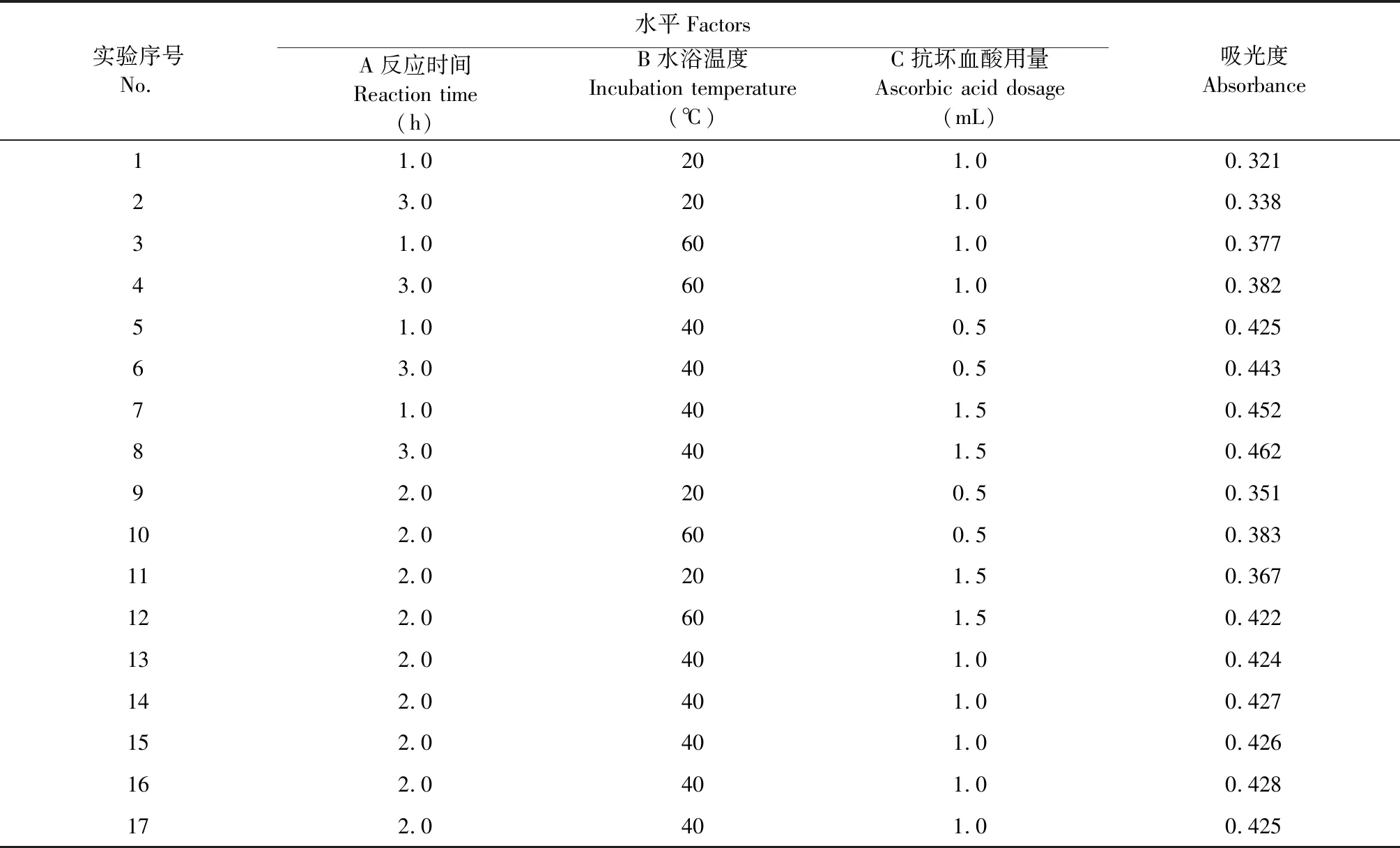
表2 响应面实验设计与结果

表3 方差分析
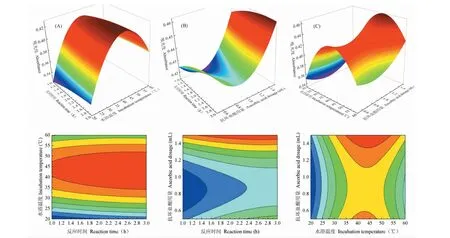
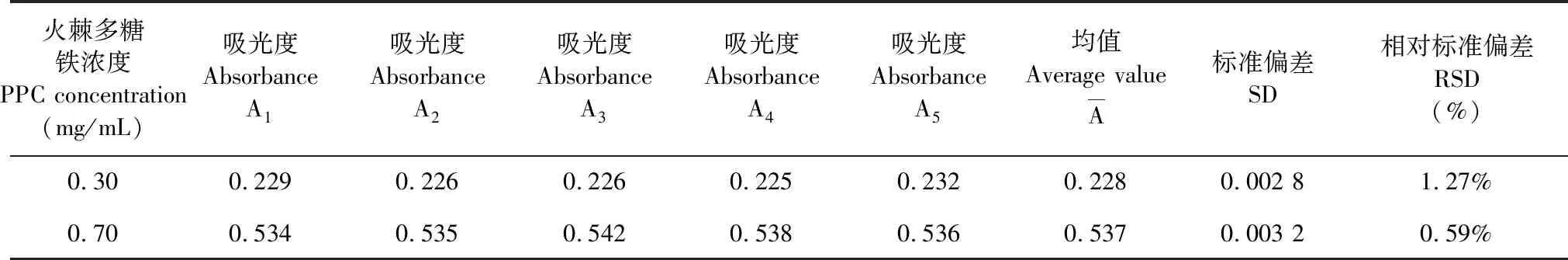
注:*表示差异性显著 (0.01 Note:*indicated significant difference,0.01 图2 火棘多糖铁Ⅲ复合物中铁含量测定响应面及等高线图Fig.2 Response surface and contour plot of iron content from PPC注:A.水浴温度与反应时间;B.抗坏血酸用量与反应时间;C.抗坏血酸用量与水浴温度。Note:A Reaction time and incubation temperature,B Reaction time and ascorbic acid dosage,C Incubation temperature and ascorbic acid dosage 由图2结合表3分析可知,水浴温度与反应时间交互作用较显著,吸光度随温度升高先增后减,在45 ℃左右达到极值,水浴温度对结果的影响比反应时间更为显著。反应时间与抗坏血酸溶液用量交互作用不显著,相对而言,水浴温度与抗坏血酸溶液用量交互作用最显著。 通过软件(Design Expert8.0.6)分析得到检测PPC中铁含量的最佳条件是反应时间为2.01 h,水浴温度为44.4 ℃,10%抗坏血酸溶液用量为1.5 mL,在此条件下测得吸光度值应为0.464。为了验证该响应面结果的可行性,对所得最佳条件进行了优化和验证实验。在反应时间2.0 h,水浴温度45 ℃,抗坏血酸溶液用量1.5 mL条件下进行了5组平行试验,平均值为0.449,相对标准偏差3.23%,在误差允许范围内,说明该响应面优化出的结果比较可靠。 2.3.1 标准曲线关系考察 配制不同浓度的PPC溶液(0.30、0.40、0.50、0.60、0.70 mg/mL)置于容量瓶中,按优化得到的最佳检测条件测定其中铁的含量。以吸光度为纵坐标,PPC溶液浓度为横坐标。得出标准曲线的回归方程为Y=0.728X+ 0.015 4 (R2=0.999 5),在浓度0.30~0.70 mg/mL范围内线性关系良好。 2.3.2 重复性实验 按最佳检测条件,配制PPC浓度为0.30及0.70 mg/mL的样品两份。由同一实验操作人员在510 nm波长下平行测定5组数据,计算标准偏差和相对标准偏差。结果如表4。 分析可知,两份样品测出的吸光度值的标准偏差分别为0.001和0.002,相对标准偏差分别是0.64%和0.37%,重复性良好。 表4 重复性实验 2.3.3 重现性实验 同上,配制PPC浓度为0.30及0.70 mg/mL的样品两份。在不同实验室环境下,由不同的实验操作人员在510 nm波长下平行测定5组数据,计算标准偏差和相对标准偏差。结果如下表5。 分析可知,两份样品测出的吸光度值得标准偏差为0.002 8和0.003 2,相对标准偏差为1.27%和0.59%,重现性良好。 2.3.4 稳定性实验 同上,配制PPC浓度为0.30及0.70 mg/mL的样品两份。待反应完全后,每隔10分钟取样品测吸光度,连续测6次,计算标准偏差和相对标准偏差。结果如表6。 表5 重现性实验 表6 稳定性实验 由表中数据可知,两份样品测出的吸光度值的标准偏差分别为0.001和0.003,相对标准偏差分别为0.51%和0.59%,说明此样品在1.0 h内测定吸光度较稳定。 2.3.5 回收率实验 同上,配制PPC浓度为0.30及0.70 mg/mL的样品5份,每份1 mL,分别加入0.20 g铁标准品,同上操作,反应完全后在510 nm波长测定吸光度并计算总铁含量。计算回收率和相对标准方差,结果如表7。经分析可知,此方法的相对标准偏差为0.320%,回收率可达99.93%。 在单因素实验的基础上,通过响应面软件优化建立火棘多糖铁复合物中铁含量检测条件。结果表明,最佳检测条件为:1.0 mL适宜浓度的PPC溶液,加1.5 mL 10%抗坏血酸溶液以及3.0 mL 0.1%的邻菲啰啉溶液后,定容至50 mL并于45 ℃水浴2.0 h,反应完全后以冰水快速冷却,于510 nm测定吸光度值。此方法的重复性和重现性良好,且在1.0 h内检测稳定,回收率高达99.93%。测定的体系中,虽然抗坏血酸溶酸性较大,对测定吸光度存在一定影响,但因加完试剂后定容稀释处理,基本可忽略pH对检测的影响。此方法操作简单,结果可靠,可推广至其他多糖铁复合物中铁含量的测定。 表7 回收率实验(n=5)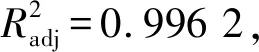
2.3 测定方法评价


3 结论

