离舌橐吾中艾里莫酚烷型倍半萜类化学成分的研究
2019-04-27徐健龙李文聪
徐健龙,邹 坤,杨 迪,李文聪,乔 婷,卢 颖,程 凡,王 慧
三峡大学生物与制药学院 天然产物研究与利用湖北省重点实验室,宜昌 443002
菊科(Asteraceae)橐吾属(Ligularia)植物大约有150种,主要分布于亚洲,其中超过100种分布于中国各地区[1]。离舌橐吾L.veitchiana为菊科橐吾属植物,主要分布于云南西北部、四川、贵州、湖北西部、甘肃西南部、陕西南部等地,生于海拔1 400~3 300米的河边、山坡及林下;其味辛、苦,性温,入肺经,具有润肺下气、清热解毒、抗菌消炎、化痰止咳、活血止痛等功效;在民间主要用作治疗流行性感冒、咳嗽、溃疡和肺结核等症[2-3]。据文献报道,离舌橐吾化学成分主要为艾里莫酚烷型倍半萜类、苯并呋喃类和三萜类等化合物[3]。为了进一步研究离舌橐吾中艾里莫酚烷型倍半萜类化合物,本课题组对其醇提物乙酸乙酯部位进行了系统分离,从中分离得到13个艾里莫酚烷型倍半萜类化合物,分别鉴定为:eremophilenolide(1),eremophila-7(11),9-dien-8-one(2),eremophil-6-en-11-ol(3),8-oxo-eremophil-6-en-11-one(4),(6α,8α)-6-hydroxyeremophil-7(11)-en-12,8-olide(5),8β-hydroxyeremophil-7(11)-en-12,8α-olide(6),6β-hydroxy-8α-methoxyeremophil-7(11)-12,8β-olide(7),2α-hydroxyeremophil-11-en-9-one(8),6β-methoxy-8β-hydroxyeremophil-7(11)-en-12,8α-olide(9),6β-hydroxyeremophil-7(11)-en-12,8β-olide(10),6β-hydroxy-8β-methoxyeremophil-7(11)-12,8α-olide(11), 6β,8β-dihydroxyeremophil-7(11)-en-12,8α-olide(12)和6β,8α-dihydroxyeremophil-7(11)-en-12,8β-olide(13)。其中,化合物5和10互为非对映异构体,化合物7和11为一对非对映异构体,化合物12和13为一对非对映异构体。除化合物3和5外,其余化合物均为首次从该植物中分离得到。
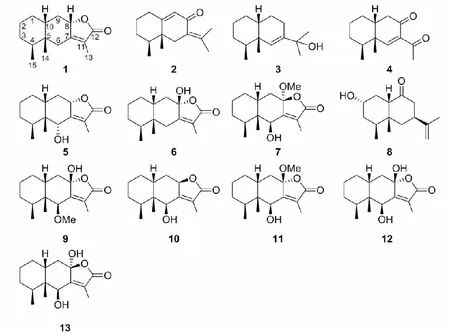
图1 化合物1~13的化学结构Fig.1 Chemical Structures of compounds 1-13
1 材料
1.1 仪器与材料
Bruker AV 400 核磁共振波谱仪(瑞士布鲁克公司);Thermo Scientific ISQ LT单四极杆质谱仪(美国赛默飞世尔科技公司);Dionex Ultimate 3000 型高效液相色谱仪(美国戴安公司);LC-6AD高效液相色谱仪(日本岛津公司);YMC-Pack ODS-A色谱柱(250 mm×10 mm,10 μm,半制备型;250 mm×4.6 mm,5 μm,分析型,日本 YMC公司);AL204-IC 电子天平(上海梅特勒-托利多仪器有限公司);低温冷冻干燥机(美国Labconco公司);正相色谱硅胶(青岛海洋化工有限公司);反相色谱硅胶(日本YMC公司)。薄层色谱硅胶板 GF254(青岛海洋化工厂);高效液相用甲醇、乙腈均为色谱纯(美国TEDIA公司),其他试剂均为分析纯(天津科密欧化学试剂有限公司)。
离舌橐吾药材于2015年7月采自湖北省神农架林区,经三峡大学生物与制药学院王玉兵博士鉴定为离舌橐吾L.veitchiana,植物标本(LV201510)存放于三峡大学天然产物研究与利用湖北省重点实验室。
1.2 细胞株
胃癌细胞HGC-27和宫颈癌细胞Caski均由三峡大学天然产物研究与利用湖北省重点实验室提供。
2 提取分离
取自然干燥的离舌橐吾药材1.45 kg,剪碎,用95%乙醇冷浸提取3次、每次48 h。提取液合并后减压蒸干。提取物经水混悬后,依次用石油醚(60~90 ℃)、乙酸乙酯、正丁醇萃取,将乙酸乙酯部位进行正相硅胶柱(200~300目)分离,以氯仿:甲醇(100∶0→1∶1)梯度洗脱,得Fr.1~127。TLC分析后,合并Fr.12-16(301.3 mg),进行高效液相色谱半制备分离纯化(乙腈-水=58∶42,2.5 mL/min),得到化合物1(3.8 mg)、2(10.3 mg)、3(3.9 mg);合并Fr.19-26(173.1 mg),进行高效液相色谱半制备分离纯化(乙腈-水=56∶44,2.5 mL/min),得到化合物4(3.7 mg);合并Fr.28-31,经反相硅胶柱(甲醇-水∶10%→100%)分离,得Frr.1~70,合并Frr.36-39(223.5 mg),经半制备柱制备(乙腈-水=47∶53,2.5 mL/min),得到化合物5(8.8 mg)、6(7.1 mg)、7(18.1 mg)和8(2.8 mg);合并Frr.33-35(550.9 mg),经两次半制备柱制备(乙腈-水=42∶58,2.5 mL/min),得到化合物5(44.4 mg)、9(10.1 mg)、10(14.9 mg) 和11(36.3 mg);合并Fr.34-37(932.6 mg),经凝胶柱分离(甲醇∶氯仿=1∶1),得Frr.1~57,合并Frr.25-29(359.8 mg),经半制备柱制备(乙腈-水=55∶45,2.5 mL/min),得到化合物12和13的混合物(共192.4 mg)。
3 结构鉴定
化合物1无色固体(CHCl3);EI-MS:m/z234 [M]+,分子式C15H22O2;1H NMR(CDCl3,400 MHz)δ:0.79(3H,d,J=6.5 Hz,15-CH3),1.04(3H,s,14-CH3),1.25(1H,m,H-3a),1.35(1H,m,H-1b),1.44(1H,m,H-3b),1.46(2H,m,H-2),1.62(1H,m,H-4),1.68(1H,m,H-10),1.74(1H,dd,J=13.2,10.8 Hz,H-9b),1.81(3H,t,J=1.6 Hz,13-CH3),1.85(1H,m,H-6b),1.88(1H,m,H-1a),2.09(1H,ddd,J=11.7,6.8,3.0 Hz,H-9a),2.90(1H,d,J=13.8 Hz,H-6a),4.64(1H,m,H-8);13C NMR(CDCl3,100 MHz)δ:8.3(C-13),16.1(C-15),20.6(C-2),21.7(C-14),26.7(C-1),30.0(C-4),30.7(C-3),35.1(C-9),36.5(C-6),39.9(C-5),40.2(C-10),80.5(C-8),120.6(C-11),161.3(C-7),175.1(C-12)。以上数据与文献[5]对照基本一致,故确定化合物1为eremophilenolide。
化合物2无色油状物(CHCl3);EI-MS:m/z218 [M]+,分子式C15H22O;1H NMR(CDCl3,400 MHz)δ:0.95(3H,d,J=6.3 Hz,15-CH3),0.97(3H,s,14-CH3),1.83(3H,s,13-CH3),2.09(3H,d,J=2.0 Hz,12-CH3),5.74(1H,dd,J=1.7,0.7 Hz,H-9);13C NMR(CDCl3,100 MHz)δ:15.4(C-15),16.0(C-14),22.0(C-12),22.5(C-13),26.5(C-2),30.5(C-1),32.5(C-3),41.0(C-6),41.8(C-5),42.5(C-4),126.1(C-9),128.1(C-7),142.2(C-11),168.7(C-10),192.3(C-8)。以上数据与文献[6]对照基本一致,故确定化合物2为eremophila-7(11),9-dien-8-one。
化合物3无色油状物(CHCl3);EI-MS:m/z222 [M]+,分子式C15H26O;1H NMR(CDCl3,400 MHz)δ:0.87(3H,d,J=6.4 Hz,14-CH3),0.91(3H,s,15-CH3),1.11(1H,m,H-8),1.13(3H,s,12-CH3),1.14(3H,s,13-CH3),1.20(1H,m,H-3),1.32(1H,m,H-10),1.39(1H,m,H-1),1.50(1H,m,H-3),1.56(1H,m,H-4),1.66(1H,m,H-1),1.71(1H,m,H-8),1.95(1H,m,H-2),1.96(1H,m,H-9),1.99(1H,m,H-2),2.25(1H,m,H-9),5.32(1H,s,H-6);13C NMR(CDCl3,100 MHz)δ:16.0(C-14),21.1(C-15),25.1(C-2),26.3(C-12),26.7(C-1),27.1(C-3),27.5(C-13),28.0(C-9),34.0(C-4),35.2(C-8),37.7(C-5),41.9(C-10),72.8(C-11),120.6(C-6),143.8(C-7)。以上数据与文献[7]对照基本一致,故确定化合物3为eremophil-6-en-11-ol。
化合物4黄色油状物(CHCl3);EI-MS:m/z240 [M]+,分子式C14H20O2;1H NMR(CDCl3,400 MHz)δ:0.95(3H,d,J=6.8 Hz,14-CH3),1.18(3H,s,13-CH3),1.36(1H,m,H-3a),1.38(1H,m,H-1b),1.46(1H,m,H-3b),1.49(1H,m,H-2a),1.58(1H,m,H-2b),1.75(1H,m,H-1a),1.85(1H,m,H-4),2.09(1H,m,H-10),2.31(1H,dd,J=17.0,4.3 Hz,H-9b),2.47(3H,s,12-CH3),2.74(1H,m,H-9a),7.50(1H,s,H-6a);13C NMR(CDCl3,100 MHz)δ:16.0(C-14),20.2(C-13),20.3(C-2),26.9(C-1),30.2(C-3),30.8(C-12),35.6(C-4),39.4(C-10),39.7(C-5),40.5(C-9),137.0(C-7),166.6(C-6),197.7(C-8),198.5(C-11)。以上数据与文献[5]对照基本一致,但文献未对此化合物进行命名,根据系统命名法,将化合物4命名为8-oxo-eremophil-6-en-11-one。
化合物5无色晶体(CHCl3);EI-MSm/z:250 [M]+,分子式C15H22O3;1H NMR(CDCl3,400 MHz)δ:0.78(3H,d,J=6.3 Hz,15-CH3),1.11(3H,s,14-CH3),1.85(3H,d,J=1.6 Hz,13-CH3),4.69(1H,d,J=2.3 Hz,H-6),5.10(1H,ddd,J=10.6,6.9,1.8 Hz,H-8);13C NMR(CDCl3,100 MHz)δ:8.7(C-13),16.2(C-15),16.3(C-14),20.0(C-2),25.8(C-1),29.5(C-4),30.6(C-3),33.8(C-10),35.0(C-9),42.9(C-5),70.0(C-6),78.4(C-8),121.7(C-11),161.4(C-7),174.7(C-12)。以上数据与文献[7]对照基本一致,故确定化合物5为(6α,8α)-6-hydroxyeremophil-7(11)-en-12,8-olide。
化合物6无色晶体(CHCl3);EI-MS:m/z250 [M]+,分子式C15H22O3;1H NMR(CDCl3,400 MHz)δ:0.79(3H,d,J=6.4 Hz,15-CH3),1.05(3H,s,14-CH3),1.80(3H,d,J=1.6 Hz,13-CH3),2.12(1H,m,H-9b),2.77(1H,d,J=13.7 Hz,H-9a);13C NMR(CDCl3,100 MHz)δ:8.3(C-13),16.0(C-15),20.5(C-2),21.5(C-14),26.2(C-1),29.6(C-4),30.5(C-3),35.0(C-6),39.0(C-9),39.5(C-10),40.4(C-5),103.9(C-8),122.6(C-11),159.1(C-7),172.5(C-12)。以上数据与文献[8]对照基本一致,故确定化合物6为8β-hydroxyeremophil-7(11)-en-12,8α-olide。
化合物7无色晶体(CHCl3);EI-MS:m/z280 [M]+,分子式C16H24O4;1H NMR(CDCl3,400 MHz)δ:0.80(3H,s,14-CH3),1.00(3H,d,J=7.2 Hz,15-CH3),3.18(3H,s,8-OMe),4.97(1H,dd,J=5.0,2.2 Hz,H-6a);13C NMR(CDCl3,100 MHz)δ:8.9(C-13),15.6(C-15),18.4(C-14),20.0(C-2),28.1(C-1),28.6(C-3),31.7(C-4),35.9(C-10),37.6(C-9),45.6(C-5),50.1(OMe),70.7(C-6),106.9(C-8),126.3(C-11),158.7(C-7),171.9(C-12)。本文首次采用CDCl3为溶剂,得到了该化合物的13CNMR数据,其结构与文献[9]对照基本一致,故确定化合物7为6β-hydroxy-8α-methoxyeremophil-7(11)-12,8β-olide。
化合物8无色晶体(CHCl3);EI-MS:m/z236 [M]+,分子式C15H24O2;1H NMR(CDCl3,400 MHz)δ:0.80(3H,d,J=7.2 Hz,15-CH3),1.03(3H,s,14-CH3),1.75(3H,s,13-CH3),4.06(1H,d,J=6.0 Hz,H-2),4.74(1H,s,H-12a),4.79(1H,s,H-12b);13C NMR (CDCl3,100 MHz)δ:15.0(C-15),20.6(C-13),21.5(C-14),26.5(C-1),27.2(C-4),37.8(C-3),39.7(C-7),41.2(C-5),42.0(C-6),46.5(C-8),56.1(C-10),65.3(C-2),109.8(C-12),147.3(C-11),216.8(C-9)。本文首次采用CDCl3为溶剂,得到了该化合物的1H NMR和13C NMR数据,其结构与文献[10]对照基本一致,故确定化合物8为2α-hydroxyeremophil-11-en-9-one。
化合物9无色晶体(CHCl3);EI-MS:m/z280 [M]+,分子式C16H24O4;1H NMR(CDCl3,400 MHz)δ:0.78(3H,d,J=5.4 Hz,15-CH3),1.10(3H,s,14-CH3),1.91(3H,s,13-CH3),2.08(2H,m,H-9),3.36(3H,s,OCH3),4.11(1H,s,H-6);13C NMR(CDCl3,100 MHz)δ:8.4(C-13),16.1(C-15),16.3(C-14),20.0(C-2),25.5(C-1),29.3(C-4),30.4(C-3),34.4(C-10),39.2(C-9),43.1(C-5),58.4(OCH3),80.7(C-6),103.7(C-8),127.0(C-11),153.9(C-7),171.1(C-12)。以上数据与文献[8]对照基本一致,故确定化合物9为6β-methoxy-8β-hydroxyeremophil-7(11)-en-12,8α-olide。
化合物10无色晶体(CHCl3);EI-MS:m/z250 [M]+,分子式C15H22O3;1H NMR(CDCl3,400 MHz)δ:0.81(3H,s,14-CH3),1.01(3H,d,J=7.2 Hz,15-CH3),2.06(3H,d,J=2.0 Hz,13-CH3),4.80(1H,m,H-8),5.07(1H,s,H-6);13C NMR(CDCl3,100 MHz)δ:9.0(C-13),15.2(C-15),19.0(C-14),20.2(C-2),28.4(C-1),28.4(C-3),31.8(C-4),35.3(C-10),35.9(C-9),44.8(C-5),71.4(C-6),77.5(C-8),122.2(C-11),162.6(C-7),175.0(C-12)。以上数据与文献[8]对照基本一致,故确定化合物10为6β-hydroxyeremophil-7(11)-en-12,8β-olide。
化合物11无色油状物(CHCl3);EI-MS:m/z280 [M]+,分子式C16H24O4;1H NMR(CDCl3,400 MHz)δ:0.76(3H,d,J=6.1 Hz,15-CH3),1.09(3H,s,14-CH3),1.88(3H,s,13-CH3),2.74(1H,d,J=9.8 Hz,6-OH),3.29(3H,s,8-OCH3),4.51(1H,d,J=9.1 Hz,H-6a);13C NMR(CDCl3,100 MHz)δ:8.7(C-13),16.2(C-15),16.3(C-14),19.9(C-2),25.6(C-1),29.5(C-4),30.6(C-3),33.4(C-10),36.5(C-9),43.4(C-5),51.1(OCH3),70.8(C-6),106.5(C-8),126.2(C-11),154.2(C-7),171.1(C-12)。本文首次采用CDCl3为溶剂,得到了该化合物的13CNMR数据,其结构与文献[9]对照基本一致,故确定化合物11为6β-hydroxy-8β-methoxyeremophil-7(11)-12,8α-olide。
化合物12无色晶体(DMSO);EI-MS:m/z266 [M]+,分子式C15H22O4;1H NMR(DMSO-d6,400 MHz)δ:0.71(3H,d,J=5.7 Hz,15-CH3),0.99(3H,s,14-CH3),1.89(3H,s,13-CH3),4.48(1H,s,H-6);13C NMR(DMSO-d6,100 MHz)δ:8.7(C-13),16.6(C-15),16.7(C-14),20.1(C-2),25.8(C-1),29.1(C-4),30.9(C-3),33.9(C-10),39.4(C-9),43.1(C-5),69.1(C-6),105.3(C-8),123.6(C-11),157.4(C-7),171.6(C-12)。以上数据与文献[8]对照基本一致,故确定化合物12为6β,8β-dihydroxyeremophil-7(11)-en-12,8α-olide。
化合物13无色晶体(DMSO);EI-MS:m/z266 [M]+,分子式C15H22O4;1H NMR(DMSO-d6,400 MHz)δ:0.67(3H,s,14-CH3),0.92(3H,d,J=7.2 Hz,15-CH3),1.74(3H,s,13-CH3),4.48(1H,s,H-6);13C NMR(DMSO-d6,100 MHz)δ:9.0(C-13),15.9(C-15),18.8(C-14),20.3(C-2),28.6(C-3),28.8(C-1),31.2(C-4),35.9(C-10),39.5(C-9),45.6(C-5),68.9(C-6),104.9(C-8),122.8(C-11),162.7(C-7),172.3(C-12)。以上数据与文献[8]对照基本一致,故确定化合物13为6β,8α-dihydroxyeremophil-7(11)-en-12,8β-olide。
4 体外细胞毒活性筛选
采用MTT比色法测定单体化合物对胃癌HGC-27细胞和宫颈癌Caski细胞的细胞毒活性。
收集处于对数生长期的胃癌HGC-27细胞和宫颈癌Caski细胞,制成单细胞悬液,用培养液稀释,使细胞浓度为(0.8~1)×105个/mL左右,每孔100 μL接种于96孔板,四周用PBS液封,置于37 ℃,5% CO2饱和湿度培养箱中孵育待细胞贴壁后,约10小时后将不同浓度(终浓度,6.25、12.5、25、50、100 μM/L)的化合物加入孔中,每一浓度设置3个复孔,每孔终体积为200 μL,另设空白对照孔若干个,空白孔加100 μL的培养液。培养48 h后取出96孔板,在倒置显微镜下观察,对染菌和药物未溶解的细胞孔做好标记。之后在超净工作台中每孔加入10 μL MTT(5 mg/mL),继续培养4 h后,小心吸去96孔板内培养液,每孔加入150 μL的DMSO,低速震荡5 min,使紫色结晶完全溶解。用酶标仪在波长490 nm下测定吸光值,计算出细胞抑制率:细胞生长抑制率=(正常细胞OD值-提取物处理组OD值)/提取物处理组OD值×100%,每次MTT实验重复3次。
结果表明,所有化合物对胃癌细胞HGC-27和宫颈癌细胞Caski未显示细胞毒作用(IC50>50 μM)。
5 结论
离舌橐吾在我国分布广泛,民间用于治疗流行性感冒、咳嗽、溃疡和肺结核等症。国内外学者从离舌橐吾中分离鉴定了倍半萜类,苯并呋喃类、三萜皂苷类、甾醇类、脂肪酸类等化合物,并发现其具有抗肿瘤、抗菌和抗炎等多种生物活性。倍半萜类化合物是其主要次级代谢产物。为进一步研究离舌橐吾的倍半萜类化合物,我们对离舌橐吾醇提物乙酸乙酯部位进行了深入研究,从中分离鉴定了13个艾里莫酚烷型倍半萜类化合物(包括3对非对映异构体),其中11个为首次从该植物分离得到。采用MTT法评价了所得单体化合物的抗肿瘤活性,结果表明,所有化合物均未表现出显著活性。该研究成果不仅丰富了离舌橐吾来源的倍半萜类化合物种类,而且为离舌橐吾中次级代谢产物的进一步研究奠定了基础。
