青藤碱磷脂复合物纳米结构脂质载体的制备、表征及药动学研究
2019-04-27李月灵王丽华
李月灵,王丽华,周 竞
1黄河科技学院,郑州 450005;2上海市中药研究所,上海 201401
青藤碱是从中药青风藤SinomeniumacutumRehd.etWils中提取得到的一种生物碱单体。青藤碱具有抗肿瘤、镇痛、降压及抗心律失常等药理活性[1]。近年来随着对青藤碱的深入研究,发现其对肺癌、食道癌、胃癌、肝癌等肿瘤细胞的增殖具有明显的抑制作用,因此非常有希望开发成为一种中药抗肿瘤药物。但青藤碱吸收较差,导致生物利用度较低。目前已有青藤碱微乳、固体脂质纳米粒和脂质体等方面的研究[2-4]。
本课题组前期采用磷脂复合物技术成功制备了青藤碱磷脂复合物(sinomenine phospholipids complex)[5],并对青藤碱磷脂复合物存在状态和结合机制进行了研究。但青藤碱磷脂复合物分散性较差,体外溶出度收到很大限制[6-8]。纳米结构脂质载体(nanostructured lipid carriers,NLC)系采用固态和液态混合脂质为载体制备的一种纳米微粒给药系统,不仅可极大提高药物的分散性、促进药物顺利吸收、具有较高的载药量及制剂稳定性等优势,在药物靶向方面也极具吸引力,有助于降低药物毒副作用。为改善青藤碱磷脂复合物的分散性及给药便捷性,本文进一步将青藤碱磷脂复合物制备成纳米结构脂质载体,并对纳米结构脂质载体进行体外和体内进行研究,期望为青藤碱的制剂的开发、研究提供有价值的借鉴。
1 材料与仪器
1.1 材料与试剂
青藤碱(宝鸡方晟生物开发有限公司,批号:201607005,纯度:99.2%);茶碱(中国科学院成都生物研究所,批号:20171015,纯度:99.4%);磷脂酰胆碱(批号:PC-98T,上海艾韦拓医药科技有限公司,含量>85%);单硬脂酸甘油酯、油酸、泊洛沙姆188(国药集团化学试剂有限公司);肝素(南京新百药业有限公司);四氢呋喃为色谱纯,其他试剂均为分析纯。
1.2 仪器与设备
U3000型高效液相色谱仪(戴安中国有限公司);BP 210D型电子天平(赛多利斯科学仪器有限公司); ZRS-8型智能溶出试验仪(天津大学无线电厂);HWS-12型智能水浴锅(上海一恒科技有限公司);旋转蒸发仪(艾卡仪器设备有限公司);JY92-II型探头超声仪(上海净信实业发展有限公司);Nano ZS90型纳米粒度仪(英国 Malvern 公司);Nanosep®超滤离心管(截留相对分子质量 10 000,美国 PALL 公司); DZF-6050型真空干燥箱(上海跃进医疗器械厂); MD200-2型氮气吹扫仪(杭州奥威仪器有限公司)等。
1.3 动物
SD大鼠,雄性,7~8周龄,体质量300±20 g,购自上海斯莱克实验动物有限公司,许可证号:SCXK(沪)2012-0002。
2 试验方法与结果
2.1 青藤碱磷脂复合物的制备
称取青藤碱0.33 g和卵磷脂0.82 g置于圆底烧瓶中,并加入200 mL四氢呋喃。45 ℃条件下磁力搅拌加热4 h后,减压旋蒸除去有机溶剂,将残留物置于真空干燥箱内过夜。由于青藤碱不溶于无水乙醚,而其磷脂复合物在无水乙醚溶解良好,因此采用无水乙醚进行纯化。具体过程为:加入无水乙醚溶解磷脂复合物粗品,0.45 μm微孔滤膜过滤除去游离的青藤碱。减压旋蒸除去无水乙醚,真空干燥箱内过夜干燥后,将青藤碱磷脂复合物密封保存,备用。制备的磷脂复合物呈半固体状态,青藤碱与卵磷脂的复合率接近100%[5],质量分数为28.62%。
2.2 青藤碱磷脂复合物纳米结构脂质载体的制备
取80 mg的青藤碱磷脂复合物,250 mg的单硬脂酸甘油酯及40 mg的油酸置于50 mL的圆底烧瓶中。加入6 mL无水乙醇后,置于温度为65 ℃水浴中磁力搅拌溶解,作为油相。另称取0.15 g的泊洛沙姆188置于20 mL的蒸馏水中,磁力搅拌加热至相同温度,作为水相。于搅拌速度为1 000 rpm条件下将油相缓慢滴加至水相中(用时约5 min),2 h后即可形成纳米结构脂质载体初乳。将初乳进行超声15 min,迅速放入-20 ℃的冰箱进行固化3 h。采用0.45 μm的微孔滤膜过滤,即得青藤碱磷脂复合物纳米结构脂质载体。空白纳米结构脂质载体采用相同质量的卵磷脂代替青藤碱磷脂复合物,同法制备即可。
2.3 方法学研究
2.3.1 色谱条件
Angilent C18柱(4.6 mm×150 mm,5 μm);流动相为乙腈-水-乙二胺(v∶v∶v=40∶60∶0.3);检测波长为262 nm;柱温为30 ℃;流速为1.0 mL/min;进样体积为20 μL。
2.3.2 标准曲线的制备及方法学验证
精密称取经干燥处理的青藤碱对照品10.00 mg,置于100 mL的容量瓶中。加入约70 mL的乙腈进行超声8 min,于室温放置30 min后,采用乙腈定容,即得浓度为100 μg/mL的青藤碱对照品储备液。取适量储备液进一步配制一系列浓度为1.0、2.0、5.0、10.0、25.0、50.0 μg/mL的对照品溶液,HPLC测定各个浓度(C)的峰面积(A)。以C对A进行线性回归,得出回归方程为A=13.552 7C-0.0932 2(r=0.999 9)。根据相关系数r判断,青藤碱在1.0~50.0 μg/mL浓度范围内线性关系良好。
选取1.0 μg/mL(低)、25.0 μg/mL(中)和50.0 μg/mL(高)3种浓度,连续进样6次考察精密度。结果显示精密度分别为1.12%、0.66%和0.13%(n=6);取空白纳米结构脂质载体,分别加入低、中、高浓度的青藤碱对照品,加入乙腈进行超声溶解,0.22 μm的微孔滤膜进行过滤,测定青藤碱含量,并计算回收率。结果显示,平均加样回收率为98.89%(n=6),RSD均小于1.58%。按照“2.2”项下操作,制备6份青藤碱磷脂复合物纳米结构脂质载体,HPLC测定青藤碱含量,考察方法的重复性。结果显示,RSD小于1.80%(n=6)。任取一份样品,分别于0、1、2、3、4、5 h进行HPLC分析,考察样品的稳定性。结果显示,RSD小于1.91%(n=6)。
2.4 纳米结构脂质载体粒径及Zeta电位的测定
取青藤碱磷脂复合物纳米结构脂质载体混悬液,蒸馏水适当稀释,并放入比色池中,测定其粒径分布情况及Zeta电位。测定结果显示,青藤碱磷脂复合物纳米结构脂质载体平均粒径为201.32±5.05 nm,聚合物分散系数(polymer dispersion index,Pdi)为0.180±0.048,见图1;经测定其Zeta电位为-22.2±1.5 mV(见图2)。

图1 青藤碱磷脂复合物纳米结构脂质载体粒径分布Fig.1 Particle size distribution of sinomenine-phospholipids complex nanostructured lipid carries
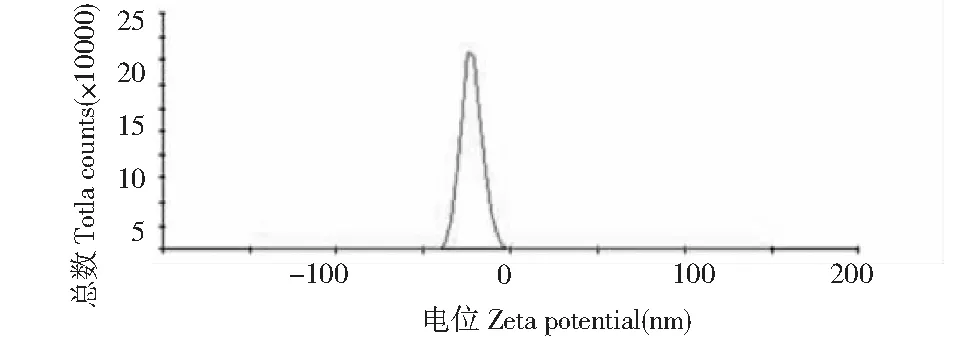
图2 青藤碱磷脂复合物纳米结构脂质载体Zeta电位Fig.2 Zeta potential of sinomenine-phospholipids complex nanostructured lipid carries
2.5 包封率及载药量的测定
精密量取1.0 mL青藤碱磷脂复合物纳米结构脂质载体混悬液,加入到超速离心管内管中,并于转速为12 500 rpm离心45 min。HPLC测定滤液中青藤碱的含量(m游离)。另精密量取1.0 mL的青藤碱磷脂复合物纳米结构脂质载体混悬液,置于10 mL容量瓶中,乙腈超声破乳后定容。HPLC法测定青藤碱的总含量(m总),计算青藤碱磷脂复合物纳米结构脂质载体包封率和载药量。计算公式为:包封率(%)=[(m总-m游离)/m总]×100%;载药量(%)=[(m总-m游离)/(m总脂质+m总-m游离)]×100%。式中m总表示青藤碱的总含量,m游离表示游离的青藤碱含量,m总脂质表示青藤碱磷脂复合物纳米结构脂质载体中固态和液态脂质总量。
测定及计算结果显示,青藤碱磷脂复合物纳米结构脂质载体包封率为80.31%±1.01%;其载药量为4.42%±0.28%。
2.6 体外释放研究
取青藤碱磷脂复合物纳米结构脂质载体混悬液3 mL,置于经处理后的透析袋中,两端扎紧。取适量青藤碱原料药加入蒸馏水制备混悬液,两端扎紧。2种供试品分别加入到含50 mL蒸馏水的具塞锥形瓶中,置于温度为37 ℃,速度为75 rpm恒温振荡器中进行青藤碱原料药和青藤碱磷脂复合物纳米结构脂质载体3种供试品体外释放研究。分别于0、0.5、1、2、3、4、6、8、10、12、24 h不同时间点取样2 mL,同时补进同体积的蒸馏水。HPLC测定释放介质中青藤碱的含量,计算不同时间点的药物累积释放率,绘制时间-累积释放度的释放曲线。
青藤碱原料药混悬液在4 h内累积释放度为96.84%,基本释放完毕。而青藤碱磷脂复合物纳米结构脂质载体在8 h内累积释放度为61.61%,属于快速释药期,8 h后释药相对较慢,具有明显的缓释特征。分别采用零级释药模型、一级释药模型、Higuchi释药模型及Weibull释药模型对青藤碱磷脂复合物纳米结构脂质载体体外释药过程进行模型拟合。结果发现,青藤碱磷脂复合物纳米结构脂质载体体外释药模型符合Weibull释药模型,拟合方程为:LnLn(1/1-Mt/M∞)=0.576 6Lnt-1.478 1(r=0.988 8)。
2.7 体内药动学研究
2.7.1 分组、给药及血样采集
取12只SD大鼠,雌雄兼用,随机分为2组,每组6只。实验前12 h禁食,自由饮水。采用0.5%的CMC-Na溶液配制青藤碱混悬液(以青藤碱计60 mg/kg),取适量青藤碱磷脂复合物纳米结构脂质载体的混悬液(以青藤碱计60 mg/Kg),分别对SD大鼠进行灌胃给药。于0、0.5、0.75、1.0、1.5、2、3、4、6、8、12、16 h眼眶静脉采血,置于离心管中(肝素化)。立即于转速为3 000 rpm条件下,离心3 min,转移上层血浆置于-20 ℃冰箱冷冻保存,待测。
2.7.2 血浆样品的处理
精密吸取大鼠血浆样品100 μL置于离心管中,依次分别加入内标溶液50、200 μL甲醇和2.0 mL二氯甲烷,涡旋4 min后,在转速为8 000 rpmn的条件下离心15 min。转移上层有机相,于温度为40 ℃条件下氮气缓慢吹除有机溶剂。残留物加入100 μL的流动相进行复溶,进HPLC测定青藤碱含量。
2.7.3 对照品溶液的配制及标准曲线
取经干燥处理的茶碱对照品10.0 mg置于50 mL容量瓶中,乙腈溶解后定容。进一步配制浓度为5.0 μg/mL的茶碱对照品溶液,备用。
取“2.3.2”项下青藤碱对照品储备液,用乙腈稀释配制成浓度为20.0 μg/mL。分别精密取200、100、50、20、10、5 μL置于含50 μL内标溶液的离心管中,挥去有机溶剂,加入200 μL大鼠空白血浆,分别得20.0、10.0、5.0、2.0、1.0、0.5 μg/mL的一系列青藤碱血浆样品对照品溶液。按照“2.7.2”项下血浆处理方法进行处理,进HPLC测定青藤碱(As)与内标的峰面积(Ai),计算两者比值(As/Ai)。以As/Ai对青藤碱浓度(C)进行线性回归。得出回归方程为C=183.47As/Ai+6.17,r=0.998 8。因此,线性范围为0.5~20.0 μg/mL,在此范围内线性关系良好。
2.7.4 方法学考察
取SD大鼠空白血浆,对照品溶液和处理后的血浆溶液,按照“2.7.2”项下处理方法处理。结果显示,血浆内源性物质不影响延胡索乙素的含量测定。
选取0.5 μg/mL(低)、10.0 μg/mL(中)和20.0 μg/mL(高)3种浓度分别进行日内精密度及日间精密度考察。考察结果显示,低、中、高3种浓度血浆样品的日内精密度RSD值均小于8.81%(n=3);日间精密度RSD值均小于10.27%(n=3)。取青藤碱低、中和高浓度的血浆样品,每种浓度测定3次,分别进HPLC测定峰面积,带入“2.7.3”项下回归方程,计算测定浓度。以测定浓度与配制浓度进行比较,得出回收率。考察结果显示,3种质量浓度的血浆样品回收率在88.10%~93.57%之间,RSD值为10.51%(n=9)。任取一含药血浆样品,经5天反复冷冻,每天1次,分别测定青藤碱与内标峰面积的比值,结果显示其As/Ai变化无统计学意义(P>0.05),血浆样品在5天内基本稳定。因此,所建立的青藤碱血药浓度测定方法可用于分析测定血浆中青藤碱的浓度。
2.8 药动学结果
以青藤碱血药浓度-时间点绘制青藤碱及其磷脂复合物纳米结构脂质载体的血药浓度-时间曲线(见图4)。主要药动学参数采用3P97程序统计矩模型进行计算,结果见表1。青藤碱磷脂复合物纳米结构脂质载体的tmax与青藤碱原料药相比无统计学意义,但Cmax由8.83±1.97 μg/mL极显著性提高至15.73±3.86 μg/mL(P<0.01),且T1/2显著性延长,说明磷脂复合物纳米结构脂质载体改变了青藤碱的药动学行为,增强了体内吸收,延长了青藤碱在体内滞留时间。青藤碱制备成青藤碱磷脂复合物纳米结构脂质载体后,其相对生物利用度提高到了1.75倍。

图4 青藤碱及其磷脂复合物纳米结构脂质载体药-时曲线Fig.4 Drug concentration-time curves of sinomenine-phospholipids complex and its nanostructured lipid carriers
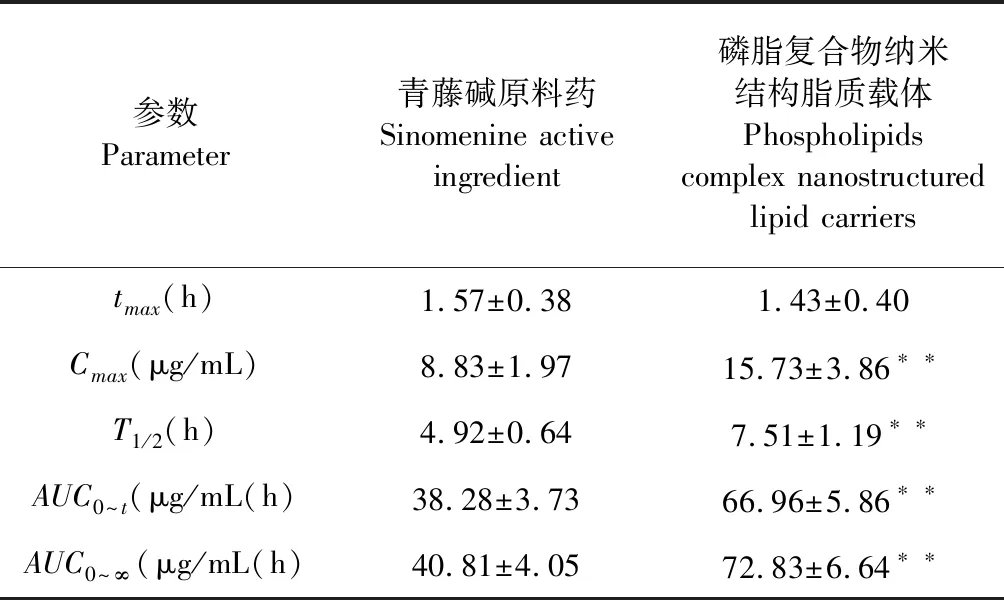
表1 青藤碱及其磷脂复合物纳米结构脂质载体主要药动学参数
注:与青藤碱原料药相比,**P<0.01。
Note:Compared to sinomenine,**P<0.01.
3 讨论
李熙等[4]制备的青藤碱微乳制剂中添加了大量的表面活性剂和助表面活性剂,进入人体后存在一定的溶血风险。张先洲等[2]对青藤碱固体脂质纳米粒进行了研究,但平均包封率仅为65.7%,霍仲坚等[3]制备的脂质体包封率不足63%。包封率较低的原因可能是由于青藤碱脂溶性不佳,导致青藤碱和脂质载体之间的亲和性较差。磷脂复合物技术可同时改善中药活性成分的水溶性及脂溶性,促进顺利吸收,提高其生物利用度已获得中药研究工作者的认可,是一种非常具有潜力的中药新型给药系统。但磷脂复合物一般呈半固体状态,分散性很差,且稳定性也存在一定问题[9]。本研究将青藤碱磷脂复合物制备成纳米结构脂质载体后,其分散性得到极大改善,也有助于提高磷脂复合物的稳定性,为进一步提高药物的生物利用度及药物抗肿瘤等疗效奠定了基础。由于磷脂复合物技术改善了青藤碱的脂溶性,青藤碱磷脂复合物纳米结构脂质载体的包封率达到80.31%±1.01%,且处方中表面活性剂和助表面活性剂的用量大大降低,安全性相对较高。研究表明[10],当两种以上的乳化剂联合使用时,可以发挥协调作用,有助于增加Zeta电位,提高稳定性。本文中用到的磷脂除了与青藤碱形成磷脂复合物外,还与非离子表面活性剂泊洛沙姆188发生协同作用,从而使制备的纳米结构脂质载体粒径分布均匀。
青藤碱磷脂复合物纳米结构脂质载体在体外释药具有明显的缓释特征,经口服进入体内后tmax有所提前,说明纳米结构脂质载体在体内具有独特的吸收途径。生物素受体主要分布于十二指肠和空肠,该肠段分布着丰富的毛细血管,是吸收的主要部位。纳米结构脂质载体进入小肠后,在生物素介导的转运途径的作用下迅速吸收进入血液循环,最终导致tmax有所提前,增强了体内吸收,延长了青藤碱在体内滞留时间,相对生物利用度提高到1.75倍。分析原因[11-14]:纳米结构脂质载体由于纳米级别的粒径可增加与胃肠道黏膜的接触面积,有助于增加药物吸收。纳米结构脂质载体可在淋巴结构Peyer’s parches中聚集,通过M细胞吸收进入体循环,从而促进了药物吸收。另外,纳米结构脂质载体中的磷脂及泊洛沙姆188可增加胃肠道黏膜的通透性,也有助于增加药物进入体循环的量[15]。本研究证明了青藤碱磷脂复合物制备成纳米结构脂质载体的必要性、可行性及有效性。前期对青藤碱磷脂复合物促进透皮效果进行了研究[5],对于青藤碱磷脂复合物纳米结构脂质载体比如能否进一步提高青藤碱透皮效果有待于进一步研究。另外,由于纳米结构脂质载体胶体溶液在水相环境中可能会发生一系列物理或化学变化,最终产生凝聚、沉淀及包封率下降等现象,因此青藤碱磷脂复合物纳米结构脂质载体冻干粉针研究也是下一步研究工作的重点[16]。
