响应面法优化水酶法提取辣木籽蛋白质的工艺及其功能性质研究
2019-04-27王标诗李雪儿梁小慧胡小军张卫国张世奇
王标诗,李雪儿,梁小慧,胡小军,2,张卫国,2,江 敏,2,杨 娟,2,张世奇,2
1岭南师范学院化学化工学院;2广东省辣木资源开发与利用工程技术研究中心,湛江 524048
辣木(Moringaoleifera),又称鼓槌树、辣根树、奇迹之树等,也被称为穷人的牛奶树,日本誉其为不可思议之树[1]。辣木是一种具有独特经济价值的热带植物,被誉为植物中的钻石,受到了食品界、医学界以及营养学界的重视。与普通的食品对比可知,辣木籽中蛋白质、膳食纤维、钙、镁、钾等含量较普通的食品高很多,营养成分丰富[2]。在我国广东和云南是辣木种植发展速度较快的区域。目前,辣木产业发展仍处于初级阶段,远不能满足持续增长的辣木产业发展需求,急需获得辣木精深加工技术的支持和推动。广东湛江地区岭南师范学院和中国热带农业科学院农产品加工所等单位对辣木研究较为深入,已联合成立广东省辣木资源开发与利用工程技术研究中心。
辣木的种子即为辣木籽。辣木籽中含有丰富的蛋白质、油脂及矿物元素,可用于食品、医药、化妆品等方面的产品开发,具有良好的应用前景。辣木籽的蛋白含量高,占总量的30%以上,含有17种氨基酸[3]。目前,辣木蛋白在饲料、净水和化妆品等方面都有应用[4,5]。植物蛋白质的提取方法主要为碱溶酸沉法。目前,水酶法已在多种植物种籽中都得到了应用[6-8],水酶法在提取蛋白质的同时可以有效的回收油料中其他营养物质,如油脂等,具有广阔的市场前景。但是目前对于辣木籽中蛋白质的研究鲜有报道。
本论文以辣木籽为研究对象,通过响应面法优化了水酶法提取辣木籽中蛋白质的工艺条件,并对其部分功能性质进行了研究,以期为辣木的综合开发和高值化利用提供技术支持。
1 材料与方法
1.1 材料与仪器
材料:辣木籽(购于湛江市旭昇南药种植专业合作社)。胰蛋白酶(5万U/g,国药集团化学试剂有限公司);Alcalase碱性蛋白酶(20万U/g,北京奥博生物科技有限责任公司);木瓜蛋白酶(20万U/g,北京奥博生物科技有限责任公司);中性蛋白酶(20万U/g,北京奥博生物科技有限责任公司);其他化学试剂均为分析纯。
摇摆式高速万能粉碎机:DFY-800,温岭市林大机械有限公司;电子天平:FA1004N, 上海精密科学仪器有限公司;自动定氮仪:KDN-103F,上海纤检仪器有限公司;消化炉:上海纤检仪器有限公司;高速离心机:HC-3518,安徽中科中佳科学仪器有限公司;精密pH 计:pHS-3C,上海雷磁仪器厂;电热恒温鼓风干燥箱:DHG-9240A,上海精宏实验设备有限公司。
1.2 实验方法
1.2.1 原料预处理
选择色泽均匀、无虫蛀、无霉变的辣木籽,置于50~55 ℃烘箱中烘72小时。取出放置干燥器中冷却,用高速万能粉碎机进行破碎,再用40目筛进行处理,得到辣木籽粉。然后把辣木籽粉置于50~55 ℃的烘箱中烘36小时。取出放置干燥器中冷却,备用。
1.2.2 酶种类的选择
参考李杨等研究方法[9]。分别将1.0 g辣木籽粉和水加入3个反应容器,其料液比为1∶10,调节pH 和温度至蛋白酶水解的最适条件(胰蛋白酶pH8.0,37 ℃;,中性蛋白酶pH 7.5,40 ℃;Alcalase碱性蛋白酶pH9.0,55 ℃;木瓜蛋白酶pH 6.5,60 ℃)反应一定的时间。蛋白酶的添加量为4%。反应结束后将水解液于90 ℃条件下灭酶处理10 min,快速冷却后4 000 rpm离心20 min,去除油脂层后上清液通过凯氏定氮法来测定其蛋白含量,以蛋白质提取率为指标评价酶的提取效果。
1.2.3 水酶法提取辣木籽蛋白质工艺流程
辣木籽粉→加水调配→调pH 和温度→加入蛋白酶酶解→灭酶→离心分离→弃去残渣和上层油→酶解液→测定蛋白质含量。
参考王胜男等研究方法[10]。准确称取1.0 g辣木籽于干净的烧杯中,按照一定的料液比加入水,调节pH 和温度至蛋白酶水解的所需要的条件,按照一定比例添加蛋白酶,反应一段时间后于90 ℃条件下处理10 min进行灭酶,冷却后在4 000 rpm的离心机下常温离心30 min,弃去残渣及上层油脂层后得到酶解液,用于蛋白质提取率的测定。
1.2.4 单因素试验
单因素试验分别探讨料液比、酶添加量、时间、温度和pH 对蛋白质提取率的影响。料液比分别选取1∶5、1∶10、1∶15、1∶20、1∶25 g/mL;酶添加量分别选取2%、3%、4%、5%、6%;温度分别选取40、45、50、55、60、65 ℃;pH 分别选取8、8.5、9、9.5、10;时间分别选取2.5、3.0、3.5、4.0、4.5 h。
1.2.5 响应面试验
在单因素试验的基础上,采用响应面中心组合试验设计优化Alcalase碱性蛋白酶在料液比为1∶10下提取辣木籽蛋白质的工艺参数。以温度、pH 、时间、酶添加量为影响因素,以蛋白质提取率为试验指标,响应面试验设计因素与水平如表1所示。

表1 响应面试验因素与水平表
1.2.6 蛋白质提取率的测定
蛋白质测定方法为凯氏定氮法,参考GB 5009.5-2010。
式中,E—蛋白质提取率,以%表示;m1—酶解液中蛋白质的含量,单位为g;m0—样品质量,单位为g;c—样品中粗蛋白的含量,以%表示。
1.2.7 辣木籽蛋白质氮溶解指数的测定
参考朱国君等研究方法[13]。首先将酶解液调整到辣木籽蛋白质的等电点,再将沉淀物冷冻干燥得到辣木籽分离蛋白。用分析天平称取0.1 g辣木籽蛋白,配制成1%的蛋白质溶液,调整pH (2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0)和温度(25、35、45、55、65、75 ℃),然后用磁力搅拌50 min,在4 000 rpm离心25 min,分别用凯氏定氮法测定上清液和辣木籽蛋白粉中蛋白质的含量,氮溶解指数(nitrogen solubility index)的计算方法如下:
式中,NSI—氮溶解指数,以%表示;m—上清液中蛋白质含量,单位为g;m0—样品中蛋白质的质量,单位为g。
1.2.8 辣木籽蛋白质持水性的测定
参考朱国君等研究方法[13]。用分析天平称取 0.1 g辣木籽粉蛋白于烧杯中,溶于加有 10.0 mL的蒸馏水中,分别调整pH (2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0)和温度(30、40、50、60、70 ℃),磁力搅拌50 min,充分吸水后,在2 000 rpm离心20 min,除去上清液,在50.0 ℃恒温干燥箱中干燥2 h后称重。计算辣木籽粉蛋白的持水力(Water holding capacity),以每g蛋白所吸附水分的重量来表示,计算方法如下:
式中,WHC—持水力,单位为g/g;m—吸收水分的质量,单位为g;m0—样品中蛋白质的质量,单位为g。
1.2.9 辣木籽蛋白质吸油性的测定
参考范三红等研究方法[14]。用分析天平称取0.5 g辣木籽蛋白置于10 mL离心管中,加入3 mL花生油,振荡1 min后,分别置于25、35、45、55、65、75 ℃的水浴锅中保温30 min,使之充分吸油,1 000 rpm离心20 min ,吸去上层未被吸附的色拉油后称重,计算辣木籽蛋白的吸油性,以每g蛋白样品吸附油的g数表示,计算方法如下:
式中,OA—吸油性,单位为g/g;m0—蛋白质的质量,单位为g;m1—蛋白质质量+离心管质量,单位为g;m2—吸油后蛋白质的质量+离心管的质量,单位为g。
1.3 数据分析
以上试验数据均重复测定3次,其结果以平均值±标准偏差的形式表示。采用Excel软件和Design-Expert 软件对实验数据进行处理与分析。
2 结果与分析
2.1 辣木籽蛋白质含量的测定结果
通过凯氏定氮法测定了辣木籽的粗蛋白含量为38.08%±1.36%。刘华勇[3]测定了辣木籽中蛋白质含量为38.49%,段琼芬等[4]测定了辣木籽的蛋白含量为37.00%,樊建麟等[11]研究表明,辣木籽的蛋白含量为37.80%,这些数据都与本实验的测定结果比较接近,产生差异可能是由原料的来源和成熟度等不同所致。
2.2 酶种类的选择结果
由图 1可知,在其他条件相同及各种酶的最适条件下,蛋白质提取率最高的是Alcalase碱性蛋白酶,提取率达61.20%,其次是中性蛋白酶。而最低的为木瓜蛋白酶,提取率仅为33.56%。所以确定提取辣木籽蛋白质的最适酶为Alcalase碱性蛋白酶。

图1 酶的种类对辣木籽蛋白质提取的影响Fig.1 Effects of enzymes on the extraction rate of protein from the Moringa oleifera seed
2.3 辣木籽油水酶法提取单因素实验结果
2.3.1 料液比对辣木籽蛋白质提取率的影响结果

图2 料液比对辣木籽蛋白质提取率的影响Fig.2 Effects of the rate of liquid to solid on the extraction rate of protein from the Moringa oleifera seed
由图2可知,在料液比从1∶5到1∶25范围内,呈现出先增加后降低的趋势,料液比从1∶5到1∶10,提取率略有上升,在1∶10时提取率最大,达到55.68%。1∶10之后呈下降趋势。料液比从1∶15到1∶25时,蛋白质的提取率变化不大。因此,确定水酶法提取辣木籽蛋白质的最佳料液比为1∶10。

图3 酶添加量对辣木籽蛋白质提取的影响Fig.3 Effects of enzyme amount on the extraction rate of protein from the Moringa oleifera seed
2.3.2 酶添加量对辣木籽蛋白质提取率的影响结果
由图3可知,在酶添加量为2%~4%之间时,提取率逐渐增加,4%时提取率最高为63.70%,当用酶量超过4%时,提取率开始缓慢下降,进一步增加酶用量,提取率略有降低,这可能是因为蛋白质受到酶的过度水解,空间结构受到影响[12]。再者,考虑到酶的价格较高,酶用量过高加大产品的成本,因此选择最佳酶添加量为4%。
2.3.3 pH对辣木籽蛋白质提取率的影响结果
由图4可知,pH从8.0增加到9.0,蛋白质提取率也随之增大,当pH为9时,有最大值59.88%,当pH从9.0增加到10.0时,提取率逐渐降低,这是由于在pH为9时接近于此条件下的最适pH,此时其活性最高,因此选择最佳pH为9.0。

图4 pH对辣木籽蛋白质提取率影响Fig.4 Effects of pH on the extraction rate of protein from the Moringa oleifera seed
2.3.4 温度对辣木籽蛋白质提取率的影响结果
由图5可知,在40~55 ℃时,随着温度的提高,番木瓜蛋白质的提取率逐渐增大;当温度达到55 ℃时,提取率达到最大值59.23%;当温度超过55 ℃后,提取率随着温度的增加而逐渐降低,这主要是由于在超过55 ℃时使其偏离碱性蛋白酶的最适温度,导致酶的作用变弱,因而提取率降低。因此选择55 ℃作为最佳温度。
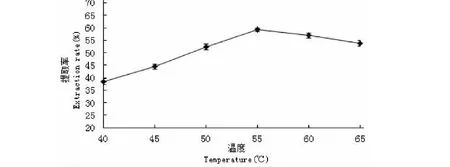
图5 温度对辣木籽蛋白质提取率的影响Fig.5 Effects of temperature on the extraction rate of protein from the Moringa oleifera seed
2.3.5 时间对辣木籽蛋白质提取率的影响结果
由图6可知,在提取时间为2.5~3.0 h时,蛋白质提取率增加较快,之后增加过缓,4 h后增加非常缓慢,到4.5 h达到最大值63.53%,从控制成本角度考虑,时间越久需要的成本越高。综合考虑后,选择4.0 h为最佳时间。
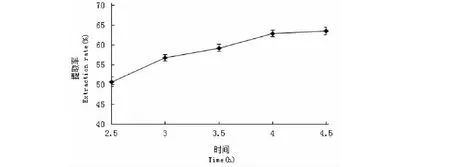
图6 时间对辣木籽蛋白质提取的影响Fig.6 Effects of time on the extraction rate of protein from the Moringa oleifera seed
2.4 响应面分析法优化水酶法提取辣木籽蛋白质的工艺
2.4.1 响应面试验结果与分析
以温度、加酶量、时间和pH为因素,以蛋白质提取率为试验指标,响应面中Box-Behnken试验方案和结果见表2。对表2的数据经回归拟合后,得到回归方程:
y=+61.55+2.90X1+2.08X2+1.26X3+1.77X4-0.95X1X2-0.092X1X3-0.42X1X4+0.25X2X3-0.095X2X4+1.45X3X4-1.31X12-1.13X22+0.33X32-1.76X42(其中X1为温度,X2为加酶量,X3为时间,X4为pH )。

表2 辣木籽蛋白质提取率的响应面设计方案和结果
由Design Expert软件进行回归及方差分析结果如表3所示。方差分析可知,模型的F=6.82,P=0.0001,表明实验所采用的二次模型是极显著的,在统计学上是有意义的。对该数学模型的回归系数检验可知:因素X1的P值<0.000 1,说明温度对蛋白质提取率%的影响是极其显著的。而因素X2、X3、X4的二次方的P值<0.05,说明酶添加量、时间、pH对蛋白质提取率%的影响是显著的。交互项X1X2、X1X3、X1X4、X2X3、X2X4、X3X4、X12、X22、X32的P值均大于0.05,所以交互项对提取率没有显著影响。对数学模型进行方差分析,结果表明模型的总回归也极显著(P<0.01)。对数学模型进行失拟检验,显示其失拟性呈不显著(P>0.05),说明该实验自变量和响应面值之间线性关系显著,实验误差小。由F检验可以得到各因素对辣木籽提取率的贡献率为:X1>X2>X4>X3,即温度>加酶量>pH >时间。
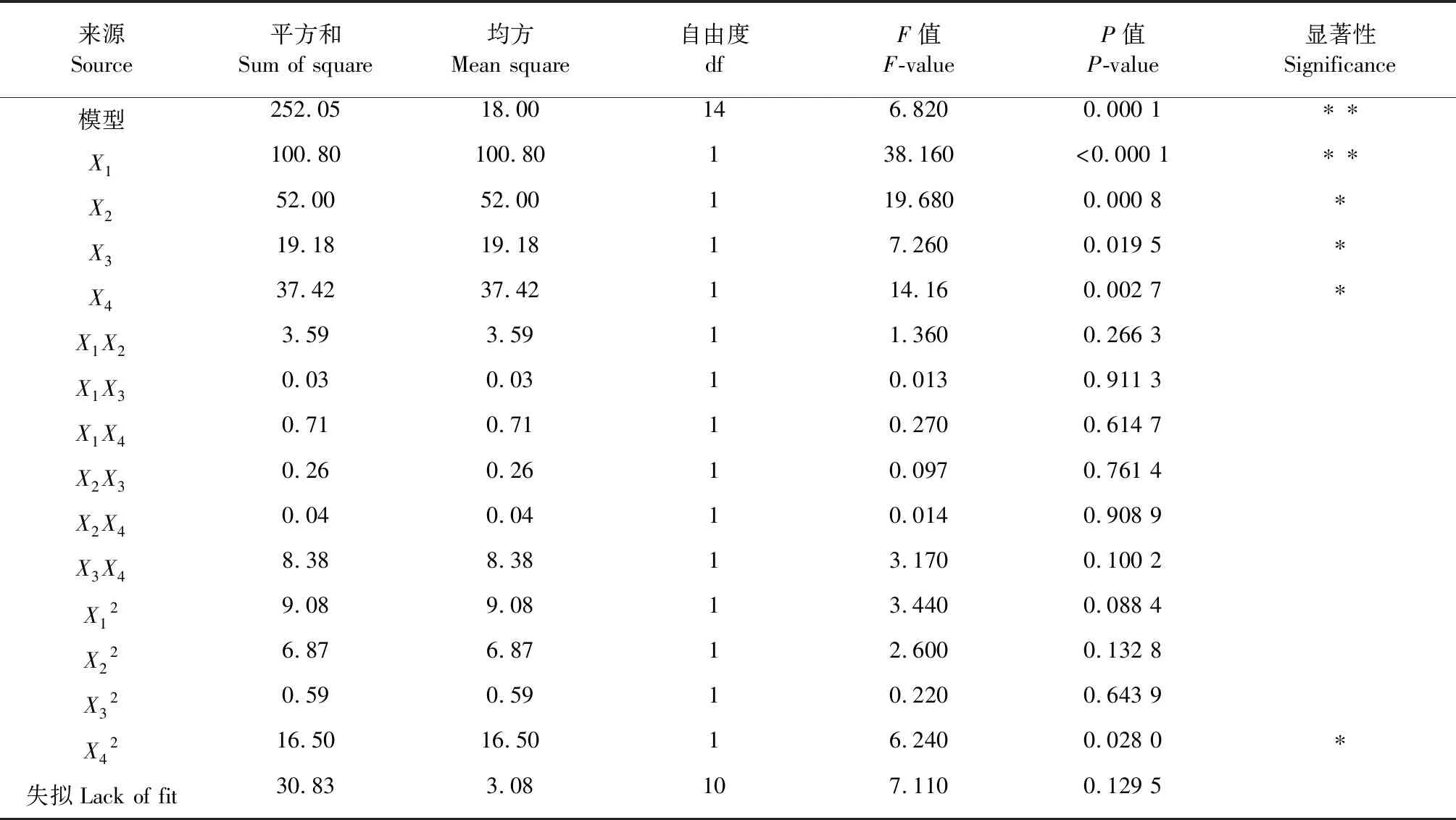
表3 回归模型与方差分析结果
注:P<0.05,差异显著,用*表示;P<0.001,差异极显著,用**表示。
Note:*P<0.05,significant difference;**P<0.001,extremely significant difference.
2.4.2 响应面分析与最优条件的确定
三维响应面图是回归方程的图形表现形式,可用来预测和检验测试变量和响应值与各变量水平之间的相互作用关系。从图7到图12可看出,响应面图形是响应值对应各实验因素X1、X2、X3、X4所构成的三维空间曲面图。若曲线越陡峭,则说明该因素对辣木籽蛋白质提取率影响越显著。向上凸起为三维图的总体趋势,说明该数学模型具有最大值,经分析可知,当X1=60,X2=4.5,X3=4.46,X4=9.0时,即温度为60 ℃、加酶量为4.5%、时间为4.46 h、pH 为9.0时,理论辣木籽蛋白提取率为67.84%,由于试验条件限制,在X1=60 ℃,X2=4.5%,X3=4.5 h,X4=9.0下对该条件进行验证试验,实际测得的结果为68.23%±0.13%,这与理论预测值相差不大,这也说明了该模型可以用于预测辣木籽蛋白质的提取。此实测值高于刘华勇[3]研究的结果,其蛋白质回收率仅为63.69%。
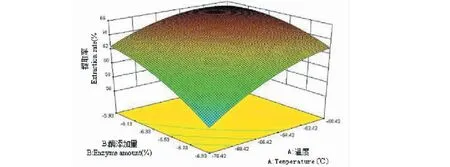
图7 温度和酶添加量对辣木籽蛋白质提取率影响的响应面图Fig.7 Response surface plot for temperature and enzymes amount effect on the extraction rate of protein from the Moringa oleifera seed
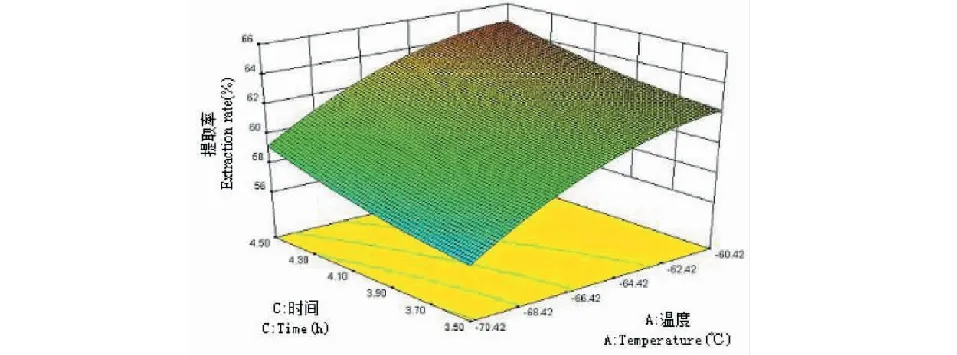
图8 温度和时间对辣木籽蛋白质提取率影响的响应面图Fig.8 Response surface plot for time and temperature effect on the extraction rate of protein from the Moringa oleifera seed

图9 温度和pH对辣木籽蛋白质提取率影响的响应面图Fig.9 Response surface plot for temperature and pH effect on the extraction rate of protein from the Moringa oleifera seed
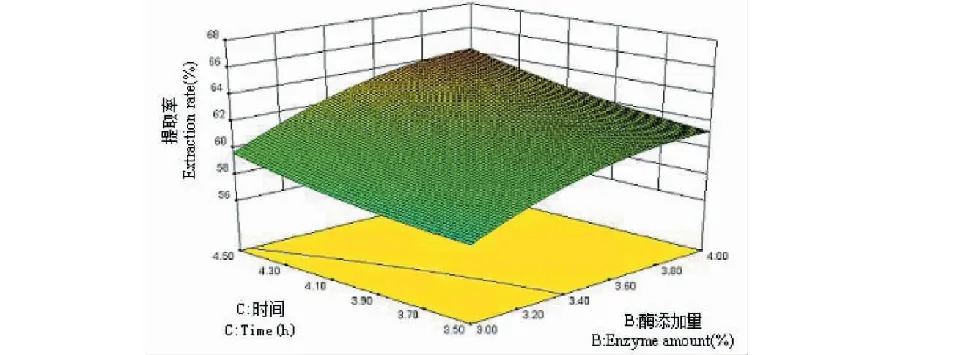
图10 时间和酶添加量对辣木籽蛋白质提取率影响的响应面图Fig.10 Response surface plot for enzymes amount and time effect on the extraction rate of protein from the Moringa oleifera seed

图11 酶添加量和pH对辣木籽蛋白质提取率影响的响应面图Fig.11 Response surface plot for enzymes amount and pH effect on the extraction rate of protein from the Moringa oleifera seed
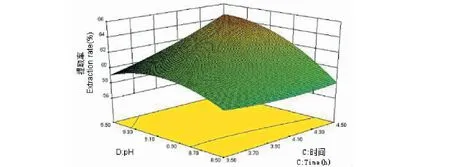
图12 时间和pH 对辣木籽蛋白质提取率影响的响应面图Fig.12 Response surface plot for time and pH effect on the extraction rate of protein from the Moringa oleifera seed
2.5 辣木籽蛋白质氮溶解指数的测定结果
2.5.1 pH对辣木籽蛋白质氮溶解指数的影响

图13 pH对辣木籽蛋白氮溶解指数的影响Fig.13 Effects of pH on NSI of protein from the Moringa oleifera seed
由图13可知,辣木籽蛋白在pH=3.0(等电点附近)时,其NSI值最小。蛋白质是两性分子,在等电点时静电斥力较弱而导致分子间聚合程度增大,使得大部分蛋白质发生聚集沉淀,故此时NSI值最小。当溶液pH为3.0~8.0时,随着pH 的增大,静电斥力也逐渐增大,NSI随之增大,当pH升到10以后,NSI略有减少。
2.5.2 温度对辣木籽蛋白质氮溶解指数的影响
由图14可知,当温度为 55 ℃时,辣木蛋白的 NSI 达到最大。温度为25~55 ℃时,NSI随温度的升高而增大;随着温度的增加,辣木籽蛋白的分子的立体结构伸展,有利于水分子和蛋白质的相互运动,此时蛋白质的氮溶解指数随着温度的升高而升高。但当温度超过55 ℃时,NSI又逐渐降低,此时辣木籽蛋白质分子已经开始变性,蛋白质分子开始发生凝聚和沉淀,使得蛋白质的溶解性发生显著的下降。
2.6 辣木籽蛋白质持水性的测定结果
2.6.1 pH对辣木籽蛋白质持水性的影响
由图15可知,当pH值在等电点附近时(pH=3),辣木籽蛋白的持水力最小,只有0.269 0 g /g。
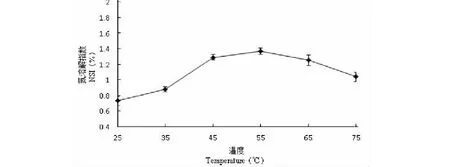
图14 温度对辣木籽蛋白氮溶解指数的影响Fig.14 Effects of temperature on NSI of protein from the Moringa oleifera seed
这是因为在等电点处,蛋白质呈现最弱的水合作用,所以持水力性最差。当pH为3.0~10.0时,蛋白质的持水性逐渐升高,这是因为随着pH值的升高,蛋白质分子之间的净电荷和排斥力的增加使蛋白质肿胀而能够结合较多的水。

图15 pH对辣木籽蛋白持水性的影响Fig.15 Effects of pH on WHC of protein from the Moringa oleifera seed
2.6.2 温度对辣木籽蛋白质持水性的影响
由图16可知,在 30~40 ℃范围内,辣木籽蛋白的持水能力随着温度的升高而升高。在 40~70 ℃范围内,蛋白质持水能力有所下降,这是因为温度升高,蛋白质分子开始变性,蛋白质构象也发生了变化,进而致使蛋白质氢键作用和离子基团水合作用减弱,导致蛋白质的持水能力降低。

图16 温度对辣木籽蛋白持水性的影响Fig.16 Effects of temperature on WHC of protein from the Moringa oleifera seed
2.7 辣木籽蛋白质吸油性的测定结果
蛋白质的吸油性是指蛋白质与游离脂肪相结合的能力。由图17可知,在55 ℃时,辣木籽蛋白的吸油性最高为2.687 g/g。随后随着温度的升高,辣木籽分离蛋白的吸油性逐渐下降。这是因为蛋白质和脂类之间的作用力是脂类的非极性链和蛋白质非极性区间的疏水相互作用,随着温度的升高,油的粘度降低,脂类分子的流动性增强,从而降低了与蛋白质的结合,使蛋白质的吸油性降低。
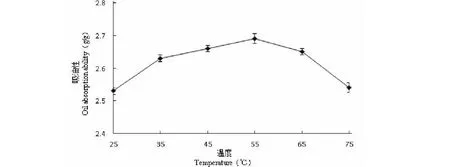
图17 温度对辣木籽蛋白吸油性的影响Fig.17 Effects of temperature on oil absorption ability of protein from the Moringa oleifera seed
3 结论
本试验在单因素试验基础上,利用响应面分析法优化了水酶法提取辣木籽蛋白质的工艺条件。得出最佳工艺条件为:使用Alcalase碱性蛋白酶在料液比为1∶10,酶添加量为4.5%,pH为9.0,温度为60 ℃,时间为4.5 h,此时辣木籽蛋白质的提取率最高为68.23%。四个因素对辣木籽蛋白质提取率的影响为温度>酶添加量>pH>时间。辣木籽蛋白具有良好的功能特性,如溶解性、持水性、吸油性等。在pH为10、温度为55 ℃时辣木籽蛋白质的氮溶解指数最高;辣木籽蛋白质持水性随着pH 的增加而增加,在温度为40 ℃时持水性最好;在温度为55 ℃时,辣木籽分离蛋白的吸油效果最明显。由于辣木浑身都是宝,具有良好的开发应用前景,对辣木籽的高值化综合开发利用必将带来良好的经济效益和社会效益。
