勿动蛋白-A在慢性前脑缺血致血管性痴呆大鼠中的表达及意义
2019-04-26云中芹刘淑清朱正禹程宝艳
云中芹 刘淑清 朱正禹 程宝艳
(山东大学第二医院 1招远分院(玲珑英诚医院)神经内科,山东 招远 265400;2神经内科)
慢性脑缺血为多种因素作用于脑组织,引起脑供血不足、缺血缺氧,脑细胞代谢、功能障碍的一系列病理生理过程〔1,2〕。通过永久性结扎大鼠双侧颈总动脉,使其脑组织慢性缺氧、缺血,脑组织正常功能受损,这与血管性痴呆的发病过程相近。相关研究显示〔3〕,脑组织长期缺血可引起大脑皮层神经元坏死、梗死灶形成。神经细胞的再生受到多种因素的影响,如神经影响因子、抑制性蛋白等,而勿动蛋白(Nogo)-A是对神经修复较为不利的一种细胞因子〔4〕。Nogo-A广泛存在于中枢神经元、少突胶质细胞中。本研究探讨Nogo-A在慢性前脑缺血致血管性痴呆大鼠中的表达及意义。
1 材料与方法
1.1试剂 多克隆兔抗鼠Nogo-A 抗体(BDBiosciences 公司);Nogo-A检测试剂盒,上海江莱生物公司;Morris水迷宫、低温高速离心机,中国医学科学院药物研究所提供。
1.2分组 64只Wistar大鼠,体重280~320 g,由山东大学动物中心专门购买饲养。在整个实验过程中,严格遵循山东大学基础实验中心的相关准则和管理规范。
1.3建立血管性痴呆模型 随机选择32只大鼠造模,纳入痴呆组。大鼠禁食6 h,10%水合氯醛(1.25 ml/100 g)麻醉。颈前部去毛,仰卧手术台,颈部正中做1 cm切口,对切口进行钝性分离,结扎双侧颈总动脉。其余32只大鼠纳入对照组,除不结扎血管外,其余操作相同。操作完成后,缝合皮肤送至饲养房,室温保持20℃。造模后第5天行Morris水迷宫试验,每次2 min,每日5次。第3日记录成绩,若逃避潜伏期大于20 s或两次进入其他盲端则为血管性痴呆模型成功〔5〕。
1.4水迷宫试验 Morris水迷宫由一个直径90 cm、高度50 cm的圆柱形水池构成,水池的水位为29 cm,水温(24±1)℃。利用蓝色墨水染色,使其颜色呈现出不透明状态。在水池之中,设置一个高度为28cm,直径为9.5 cm的圆柱形平台,并确保这个平台可以移动,并使其顶部没于水下1 cm处。将水池内的空间划分为4个象限,在第三象限的中央放置此平台;对其他3个象限进行特殊标记,确保整个实验过程中不发生位移。首先将大鼠置入水池2 min,熟悉水迷宫环境。随机将32只痴呆组大鼠分为4个亚组,每组8只,分别在缺血1 w、2 w、3 w、4 w后分别进行该实验,检测跨越平台次数、逃避潜伏期及游泳路程〔6〕。对照组在与研究组同步的时间点分别各取8只,测定相关指标。
1.5Nogo-A含量检测 将各时间点大鼠腹腔注射麻醉,取出脑组织,研磨、离心,取上清液-20℃保存备用。采用酶联免疫吸附试验(ELISA)检测,将3、6、12、24 ng/ml浓度的样品加入酶标板上的标准孔中。将10 μl的待测样本及40 μl的样本稀释液加入到样本孔之中。每孔加入辣根过氧化物酶标记的抗体100 μl,封膜、水浴保温60 min。每孔加满、甩去洗涤液并拍干,加底物 A、B各50 μl,避光孵育15 min,加终止液50 μl,在450 nm的波长下测量各孔OD值即吸光度值,绘制酶标曲线,计算样本浓度。
1.6统计学分析 采用SPSS22.0软件行t检验。
2 结 果
2.2各组水迷宫测试相关指标比较 各组大鼠空间探索实验轨迹图见图1。缺血1、2、3、4 w时,痴呆组跨越平台次数显著低于对照组(P<0.05),逃避潜伏期、游泳路程显著高于对照组(P<0.05),见表1~3。
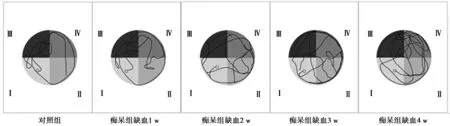
图1 各组水迷宫测试空间探索实验轨迹图
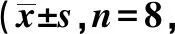
表1 各组跨越平台次数的比较次)
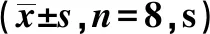
表2 各组逃避潜伏期比较
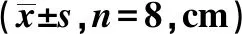
表3 各组游泳路程比较
2.2各组Nogo-A含量比较 缺血1、2、3、4 w时,痴呆组脑组织Nogo-A含量显著高于对照组(P<0.05);且缺血2 w时脑组织Nogo-A含量最高,见表4。

表4 两组不同时间点脑组织液中Nogo-A含量的比较
3 讨 论
关于慢性脑缺血的发病机制研究较少〔7〕,研究成果也有限。慢性脑缺血引起的继发性血管性痴呆较为常见,其在发病初期可表现为认知、学习能力下降,最后引起持久性认知及神经功能损伤。慢性脑缺血的重要病理改变为脑白质疏松,缺氧引起神经纤维稀疏、轴突减少,胶质细胞大量增生、血脑屏障破坏。中枢神经系统损伤后常难以再生,其具体原因尚不完全清楚且较为复杂,多种神经细胞因子及蛋白分子参与其中〔8〕。相关学者研究发现〔9~11〕,中枢神经系统损伤后常伴有促神经生长因子合成、分泌显著降低,而生长抑制性神经因子显著增高或过表达,如轴突抑制因子Nogo-A、少突胶质细胞白多糖(OMgp)等〔12〕。因此,分析和探讨Nogo-A对神经再生的影响对于脑缺血致血管性痴呆的研究具有重要意义。
神经组织对缺血、缺氧极其敏感,导致能量代谢减低,代谢障碍严重者甚至无法满足神经组织正常需求,从而发生一定程度的认知、学习功能障碍。笔者研究发现,痴呆组大鼠学习、认知能力均损伤;同时,随着慢性脑缺血时间延长,大鼠学习、认知能力还有逐渐下降的趋势。痴呆组大鼠Nogo-A含量显著增高,可提示其抑制神经纤维再生可能是导致大鼠认知功能减退或障碍的重要因素之一〔13,14〕。相关学者研究发现〔15〕,哺乳动物神经细胞受损后可伴有一定程度的Nogo-A过表达,通过Nogo-A中和抗体促进神经轴突细胞生长,恢复其相应的神经功能。
因此,慢性脑缺血导致认知功能障碍,且随缺血时间延长呈进行性发展,Nogo-A表达升高可能是神经细胞功能恢复缓慢的重要因素之一。
