益肾调督法电针对β-淀粉样蛋白1~42诱导的阿尔茨海默病大鼠血清和脑内炎性因子的调节作用
2019-04-26王芸陶一鸣孙国杰肖佳欢杜艳军
王芸 陶一鸣 孙国杰 肖佳欢 杜艳军,2
(1湖北中医药大学针灸骨伤学院,湖北 武汉 430061;2湖北省针灸治未病协同创新中心)
阿尔茨海默病(AD)属于一种原发性大脑退行性疾病,隐匿性是其起病特点,以进行性认知功能障碍和行为学改变为主要临床表现。本病的发病机制十分复杂,淀粉样蛋白假说、tau蛋白假说、炎症和免疫假说、胆碱能功能低下假说、基因突变假说、氧化应激和兴奋性毒性假说等都是目前较为被接受的学说〔1〕。AD病位在脑,肾虚髓减、神机失用是AD发生的根本病机,结合AD发病年龄特点,肾虚尤被重视。本研究基于前期研究〔2,3〕,旨在探讨益肾调督法电针对β-淀粉样蛋白(Aβ)1~42诱导的AD模型大鼠血清、不同脑区内的不同经典炎性因子的影响。
1 材料与方法
1.1实验材料与试剂 Morris水迷宫(成都泰盟科技有限公司);大鼠脑立体定位仪;牙科钻;微量注射器;华佗牌Φ0.30×25.00 mm不锈钢毫针;G6805-Ⅱ型电针治疗仪;高速冷冻离心机;显微镜(Olympus,Japan);酶联免疫吸附试验(ELISA)试剂盒(欣博盛生物科技有限公司);肿瘤坏死因子(TNF)-α一抗(ab6671)、干扰素(IFN)-γ一抗(ab133566)、白细胞介素(IL)-1β一抗(sc7884)、IL-4一抗(sc53084)、IL-10一抗(ab9969)、转化生长因子(TGF)-β1一抗(ab66043);10%水合氯醛、4%多聚甲醛等。
1.2实验方法
1.2.1实验动物及分组 40只SPF级雄性Wistar大鼠(购自湖北省实验动物研究中心),8月龄,体重(380±20)g。适应性喂养在温度(22±2)℃的动物室,自然光线,自由饮水,普通饲料(非铝制品的器皿中存放)。随机分为对照组、假手术组、模型组和治疗组各10只。
1.2.2动物模型的复制 10%的水合氯醛(350 mg/kg)腹腔注射麻醉,于脑立体定位仪上呈俯卧固定,保持前后囟同一水平。剪开头皮暴露前囟,按照大鼠脑立体定位图谱〔4〕定位海马区域(前囟后3.3 mm,中线左右各旁开1.5 mm,深度3 mm),微量注射器缓慢注入5 μl聚集肽的 Aβ1~42(制备法:0.1 mg Aβ1~42单体,二甲基亚砜50 μl溶解,离心,加入50 μl 0.01 mol/L的磷酸盐缓冲液,稀释配制成1 μg/μl的溶液,37℃水浴箱孵育7 d),5 min内注射完,静置3 min,缓慢出针(速度1.0 mm/min),防止药物溢出,牙托粉封固,缝合皮肤,造模完成。肌注青霉素G 10万U,连续3 d。
1.2.3干预方法 治疗组于模型复制成功后,参考《实验针灸学》动物穴位图谱选取百会(GV20,顶骨正中)和肾俞(BL23,第2腰椎下两旁)穴〔5〕,采用0.30 mm×25.00 mm不锈钢针灸针,百会向前平刺3~5 mm,肾俞穴稍向内斜刺5 mm,接 G6805-Ⅱ型治疗仪(双侧肾俞穴交替选择),连续波,频率5 Hz,强度以后爪轻微抖动为度。1次/d,20 min/次,每疗程连续6 d,疗程间间隔1 d,共2个疗程。对照组与模型组不予电针刺激。假手术组仅在造模过程中注射等量生理盐水,余步骤同模型组。
1.2.4动物取材 经10%水合氯醛(350 mg/kg)腹腔注射麻醉,仰卧固定,行胸腹联合切口,先暴露腹主动脉,采血针管取血,离心取上清液。再切断肋骨、膈肌,心脏暴露时从左心室插入灌注针头,并快速灌入无菌生理盐水,同时剪开右心耳,冲洗血液至肝脏发白。继改用4%多聚甲醛灌注固定至躯干四肢僵硬状。断头取脑,视交叉平面后4 mm冠状切脑,置于4%多聚甲醛外固定24 h。
1.2.5检测方法 ELISA严格按照试剂盒说明书操作。加入100 μl稀释的样品于已包被之反应孔中;温育1~2 h;洗涤后,将稀释好的100 μl生物素化抗体工作液加入各孔中;温育1 h;洗涤;已稀释的100 μl酶结合物工作液加入各孔中;温育30 min;将100 μl四甲基联苯胺(TMB)底物溶液加入各孔中显色,37℃,避光反应10~30 min;将100 μl 2 mol/L硫酸加入反应孔中终止反应,颜色由蓝变黄的10 min之内,450 nm酶标下调零空白对照孔,继测各孔OD值。根据标准品的浓度和OD值做出标准曲线,计算出样本的浓度。免疫组化法,常规石蜡切片脱蜡至水;乙二胺四乙酸(EDTA)缓冲液抗原修复;37℃,用3%H2O2孵育25 min,置磷酸盐缓冲液(PBS)中摇床洗涤3次,5 min/次;吸干,适当滴入3%牛血清蛋白(BSA)均匀覆盖组织,封闭30 min;一抗4℃孵育过夜,后置PBS中摇床洗涤3次,5 min/次;吸干,加入二抗,孵育50 min,再置于PBS中摇床洗涤3次,5 min/次;二氨基联苯胺(DAB)显色,自来水冲洗终止反应;苏木精复染、脱水、透明、封片。用显微镜采集图像,每组随机选取10张400倍视野下图片,图片应让组织填满整个视野。应用 Image-Pro Plus6.0软件分析,记录每张图片阳性累积光密度值(IOD值)和面积(Area),用 IOD/Area求得平均光密度值(MOD)。数值越大表示含量越多,指标阳性表达越强,数值越小表示阳性表达越弱。
1.3统计分析 采用SPSS22.0软件进行单因素方差分析、LSD-t检验。
2 结 果
2.1电针对各组血清不同炎性因子的影响 模型组血清TNF-α、IFN-γ和IL-1β水平明显高于假手术组和对照组(均P<0.01),IL-4、IL-10、TGF-β1水平明显低于假手术组和对照组(均P<0.01)。与模型组比较,治疗组血清TNF-α、IFN-γ、IL-1β水平显著下调,IL-4、IL-10、TGF-β1水平显著上调(均P<0.01),提示电针百会、肾俞穴能够下调AD大鼠血清促炎因子TNF-α、IFN-γ和IL-1β的浓度,并上调AD大鼠血清抗炎因子IL-4、IL-10、TGF-β1的浓度,对血清炎性反应的持续性发生具有抑制作用。见表1。
2.2电针对各组脑内不同炎性因子的影响 模型组海马区TNF-α、IFN-γ和 IL-1β的 MOD值均明显高于对照组和假手术组(P<0.05,P<0.01),IL-4、IL-10和 TGF-β1的MOD值明显低于对照组和假手术组(P<0.05,P<0.01)。与模型组比较,治疗组下调海马区TNF-α、 IFN-γ和IL-1β和上调海马区IL-4、IL-10和TGF-β1的MOD值(P<0.05,P<0.01)。见表2。

表1 各组血清促炎因子TNF-α、IFN-γ、IL-1β和抗炎因子IL-4、IL-10、TGF-β1水平的比较
与对照组和假手术组比较:1)P<0.01;与模型组比较:2)P<0.01
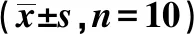
表2 各组海马区促炎因子TNF-α、IFN-γ、IL-1β和抗炎因子IL-4、IL-10、TGF-β1的MOD值比较
与对照组和假手术组比较:1)P<0.05,2)P<0.01;与模型组比较:3)P<0.05,4)P<0.01
2.3各组脑内不同部位免疫组化染色情况 由图1可见,对照组大鼠皮质、海马区的神经细胞大小均一、齿状回区细胞排列致密,未见TNF-α深染;假手术组在皮质区可见少量棕褐色阳性表达,其他部位TNF-α阳性表达尚不明显;模型组皮质、海马、齿状回均可见大量棕褐色阳性表达,海马区神经细胞层次较紊乱,有细胞核固缩,且附近胶质细胞有轻度增生现象;而治疗组皮质、海马和齿状回细胞TNF-α抗体染色则明显减弱。由图2可见,在对照组与假手术组的海马齿状回,可见到呈棕褐色的阳性表达。由图可见,IFN-γ主要表达于海马部神经元和胶质细胞的胞质。模型组同对照组比较,阳性胞质数量上较多,染色偏浓;治疗组同模型组比较,阳性表达胞质较少,且染色偏淡。由图3可见,对照组、假手术组大鼠皮质、海马、齿状回神经细胞大小均一、排列较整齐;AD大鼠皮质及海马区神经细胞明显棕色阳性表达,细胞排列较紊乱;IL-1β棕褐色阳性表达在治疗组皮质、海马区明显减弱。由图4可见,对照组皮质、海马区神经细胞形态清晰,层次紧密,大量神经细胞呈棕褐色深染;模型组皮质及海马神经细胞IL-4棕褐色阳性表达明显减少;治疗组皮质神经细胞染色明显增强。由图5可见,在对照组与假手术组大鼠海马齿状回,神经细胞胞核和胞质均可见到呈棕褐色的阳性表达,且细胞核的密度较高,数目较多,轮廓较清晰。模型组同对照组比较,细胞排列稀疏,IL-10染色偏淡;治疗组同模型组比较,阳性表达细胞增多,且IL-10染色偏浓。由图6可见,对照组皮质、海马、齿状回大量神经细胞呈棕褐色深染;假手术组皮质、海马、齿状回神经细胞棕褐色阳性表达虽不如对照组明显,但仍可见到均匀分布的棕褐色细胞;模型组各区TGF-β1阳性表达明显减少;治疗组较模型组神经细胞染色显著加深,数量增多。

A:对照组;B:假手术组;C:模型组;D:治疗组;下图同图1 各组脑组织TNF-α免疫组化法染色(×400)

图2 各组脑组织IFN-γ免疫组化法染色(×400)

图3 各组脑组织IL-1β免疫组化法染色(×400)

图4 各组脑组织IL-4免疫组化法染色(×400)
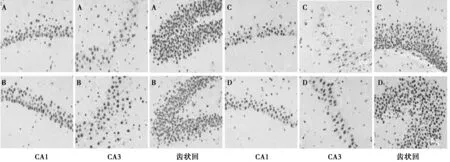
图5 各组脑组织IL-10免疫组化法染色(×400)

图6 各组脑组织TGF-β1免疫组化法染色(×400)
3 讨 论
AD病理特征主要为神经元外的Aβ聚集形成老年斑,神经元内tau蛋白异常聚集形成神经原纤维缠结,脑皮质及海马胆碱能神经元及其突触大量丢失,累及的皮质动脉出现血管淀粉样变性〔6〕。目前大脑的持续性炎性反应已被公认为AD的重要病理表现〔7,8〕,研究也表明炎性反应在AD发生发展过程中起重要作用〔9,10〕。
细胞因子是由免疫原、丝裂原或其他因子刺激细胞所产生的低分子质量可溶性蛋白质,具有调节固有免疫和适应性免疫应答,促进造血、刺激细胞活化、增殖和分化等功能〔11〕。细胞因子按照对机体的效应可分为促炎因子和抗炎因子两大类。在促炎因子中,TNF-α是具有广泛生物学效应的细胞因子,可以诱导其他前炎性细胞因子及炎性相关蛋白表达,IL-1β是炎症免疫反应初始调控因子,以诱发炎性反应及机体防御反应为主。Aβ可持续激活小胶质细胞,并过量表达炎症因子TNF-α、IL-1β等,TNF-α反馈性刺激小胶质细胞和星形胶质细胞分泌更多的炎症因子,如TNF-α、IL-6、IFN-γ,在促成与放大炎性级联反应的过程中,AD 患者脑中不可避免形成慢性炎性效应〔12〕。 研究发现单独的TNF-α不影响淀粉样前体蛋白(APP)的产生和代谢,但IFN-γ可诱导APP的转录和翻译,使APP 释放增多;TNF-α对小胶质细胞Aβ1~42 趋化受体表达的上调作用加剧了Aβ过度生成,从而加速AD病理进程。临床上发现 AD患者血液和脑脊液中IL-1β和TNF-α水平升高〔6,13〕,已不怀疑IL-1β和 TNF-α可能为介导AD炎症病理反应的关键因子, 本实验也得出了一致的结果。IFN-γ主要来源于T淋巴细胞,是一个促炎性细胞因子,在中枢神经系统疾病中,IFN-γ除已知的促炎和破坏效果也是一个保护性和调节性的细胞因子〔14〕。临床研究发现〔15〕AD患者随着病情的加重,血清IFN-γ水平存在逐渐增高的趋势。同样有实验观察到AD大鼠脑内IFN-γ表达明显增加〔16〕。
在抗炎因子中IL-4、IL-10是胶质细胞分泌的主要免疫抑制性细胞因子。Aβ1~42刺激会引起脑免疫细胞释放IL-4,后者能为神经干细胞提供危险信号〔17〕,而 IL-10在维持神经元稳态和能量代谢平衡、细胞存活等方面发挥重要作用〔18〕。已知AD患者血清和脑脊液中炎性因子水平与病情严重程度相关,其中IL-10尤其与Aβ42、Aβ42/p-tau比值呈明显负相关〔19,20〕,提示血清IL-10水平可作为判断脑内Aβ沉积的标志物。也说明AD不是单纯的脑部神经炎症,脑炎症因子可能穿过血脑屏障引发外周炎症。TGF-β1是TGF-β的一种亚单位,是由活化的T细胞和单核-巨噬细胞产生的细胞因子。研究〔21〕发现预先脑室内注射外源性TGF-β1,能够预防海马注射 Aβ1~42诱导的 AD认知功能损害,可能与TGF-β1能够抑制胶质细胞和T细胞介导的神经炎性反应有关。
本研究表明,电针能够调节中枢和外周抗炎因子IL-4、IL-10、TGF-β1与促炎因子TNF-α、IFN-γ、IL-1β的失衡状态,且炎性因子在中枢和外周的变化趋势基本一致。提示AD的脑内炎性物质和外周炎性物质相互作用,虽然有血脑屏障存在,但是这一类炎性小分子可能很容易穿过血脑屏障,至于哪一方占主导因素,根据当前的实验结果尚不足以阐明。
中医认为“正气存内、邪不可干”,从某种角度看,慢性炎症似乎相当于人体邪正斗争的相持状态,当人体正气充足时,Aβ被清除能力增强,抗炎保护效应占优势,则抗炎因子水平升高;当人体正气不足时,Aβ清除减少,促炎破坏效应占优势,则促炎因子水平升高。炎症失衡相当于AD将病而未病的状态,中医讲究治病必求于本,因此,延缓AD病程的关键在于提高患者的正气。最近的研究逐步转向固有免疫(先天免疫)紊乱导致胶质细胞清除Aβ障碍,而不再单纯局限于从神经炎症的角度来考察AD,把对AD的认识提高到一个较宏观的视角,与中医的整体观念有异曲同工之妙。 综上,AD大鼠脑内存在慢性神经炎性反应,在外周也伴随着慢性炎性反应的进展,电针能够有效改善AD症状,可能与改善抗炎/促炎的失衡状态有关。由于AD神经炎症与多种炎性细胞因子相关,因此,阐明各炎症因子的作用及抗炎因子与促炎因子的相互关系也是进一步研究的方向。
