GPC1和PD-1在非小细胞肺癌组织中表达及其与患者预后的相关性
2019-04-26刘彤媌宋卓王玫红赵焕
刘彤媌 宋卓 王玫红 赵焕
(齐齐哈尔医学院附属第三医院呼吸一科,黑龙江 齐齐哈尔 161000)
肿瘤免疫研究表明,免疫抑制是肿瘤的主要特征之一,T细胞介导的肿瘤抗原识别、提呈及活化在肿瘤免疫应答中具有重要意义〔1〕。协同刺激分子包括共刺激分子和共抑制分子,负责提供T细胞活化所需的第二信号。程序性细胞死亡蛋白(PD)-1是目前研究较多的共抑制分子,与相应配体结合后,对T 细胞的激活发挥负调节作用。GPC1是一种广泛存在的蛋白聚糖大分子,为肝素结合生长因子的共受体,与HBGFs促细胞有丝分裂活动有关。研究发现 GPC1在胰腺癌、乳腺癌及神经胶质瘤中均有高表达〔2〕。本研究通过分析非小细胞肺癌(NSCLC)患者GPC1和PD-1的表达情况,探讨其与NSCLC发生发展及预后的相关性。
1 资料与方法
1.1临床资料 选取2010年1月至2012年1月齐齐哈尔医学院附属第三医院收治的70例NSCLC患者为患者组,均经病理诊断证实。根据世界卫生组织(WHO)标准进行病理学检查,并根据 TNM 国际分期法(UICC,2009)进行分期。男42例,女28例,年龄37~71岁,平均(52.4±5.8)岁;鳞癌45例,腺癌25例;TNM分期:Ⅰ期18例,Ⅱ期21例,Ⅲ期24例,Ⅳ期7例。另取同期来院体检的健康人群30例为对照组,男17例,女13例,年龄35~76岁,平均(56.7±6.6)岁。两组性别、年龄等相比无显著性差异(P>0.05),具有可比性。
1.2方法 两组空腹采集肘静脉血5 ml,3 000 r/min离心15 min,取上层血浆,置于EP管中并做好标记,采用Elivison二步法检测血清中GPC1和PD-1水平,一抗4℃过夜孵育,室温下与二抗结合30 min,切片采用DAB显色,苏木精复染。采用ABCOM公司的PD-1鼠抗人单克隆抗体(1∶100稀释)及GPC1试剂盒进行检测。对70例患者进行术后随访,随访时间从手术结束后开始,至2017年1月,观察患者是否出现复发或转移,比较GPC1和PD-1阴性表达组与阳性表达组患者的生存率,分析GPC1和PD-1与疾病预后的相关性。
1.3质量控制 纳入标准:(1)患者均有影像学和病理学资料证实为原发NSCLC;(2)所有患者知情同意并且签署知情同意书。排除标准:(1)复发肿瘤或者多重癌;(2)患者存在严重感染;(3)并发血液系统、免疫系统病变者。质量控制要求:(1)根据纳入、排除标准严格筛选入组病例。(2)所有病例术前未接受过放化疗,未使用糖皮质激素及非甾体类药物;术中癌组织和癌旁组织病理标本齐全;半年内体重减轻<10%,术后无严重并发症;Ⅰ期患者至复发后才接受全身化疗,Ⅱ、Ⅲ期患者术后接受过至少2个周期含铂方案的联合化疗或放疗。(3)根据试剂说明书和预实验结果确定最佳的试剂稀释浓度及抗原修复方法。(4)免疫组化染色过程中设立阴性对照。(5)使用前调校实验相关仪器,准确控制实验温度及时间。(6)实验结果采用盲法进行判定。
1.4统计学分析 采用SPSS20.0软件,计量资料组间比较采用t检验;计数资料组间比较采用χ2检验;采用Kaplan-Meier(K-M)生存分析法比较阳性组与阴性组患者的生存情况。
2 结 果
2.1两组GPC1、PD-1阳性率比较 患者组GPC1、PD-1阳性率分别为80.0%(56例)与72.9%(51例),远高于对照组的10.0%(3例)与6.7%(2例),差异具有统计学意义(χ2=42.538,39.935;均P<0.05)。
2.2GPC1、PD-1表达与患者临床病理参数的关系 GPC1、PD-1阳性表达与的TNM分期及淋巴结转移情况密切相关(P<0.05),与患者的性别、年龄、病理分型无明显相关性(P>0.05)。见表1。
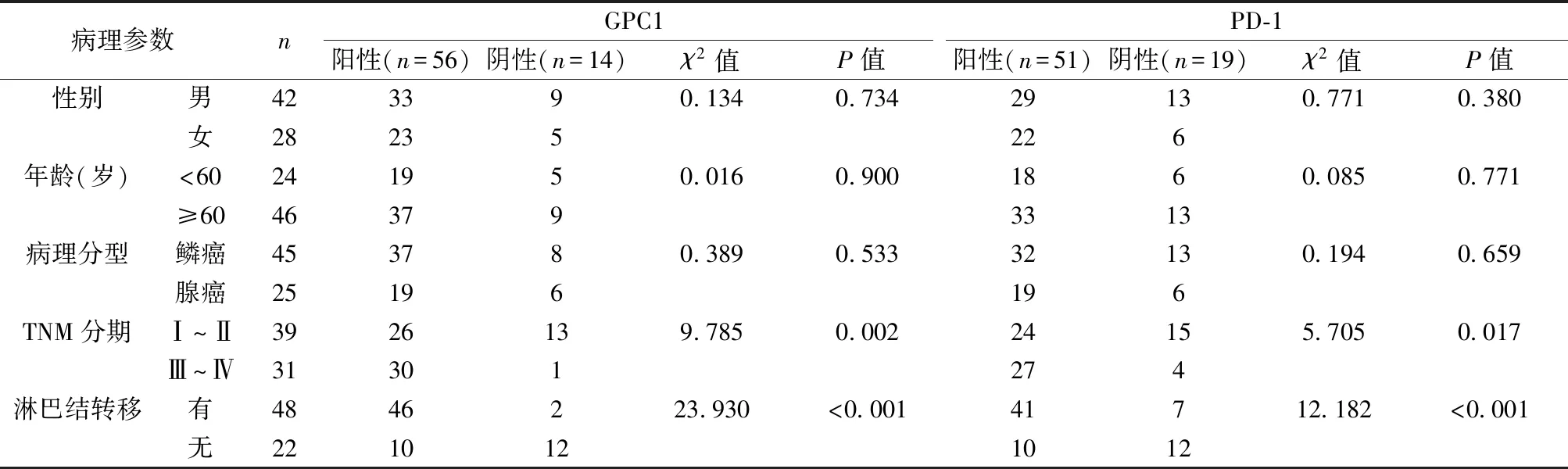
表1 GPC1、PD-1表达与患者临床病理参数的关系(n)
2.3GPC1阳性组和阴性组生存时间比较 随访患者时间最短8个月,最长60个月。GPC1阳性组中位生存时间31.0个月,3年、5年累计生存率分别为32.1%(18例)和7.1%(4例);GPC1阴性组中位生存时间54.5个月,与阳性组比较差异显著(K-M生存分析χ2=5.42,P=0.019 9);GPC1阴性组3年、5年累计生存率分别为64.3%(9例)与35.7%(5例),均高于PD-1阳性组(χ2=4.45,5.81;均P<0.05)。见图1。
2.4PD-1阳性组和阴性组生存时间比较 PD-1阳性组中位生存时间29.0个月,其3年、5年累计生存率分别为31.4%(16例)和7.8%(4例);PD-1阴性组中位生存时间51.0个月,3年、5年累计生存率分别为68.4%(13例)与31.6%(6例),组间比较PD-1阴性组的生存时间(K-M生存分析χ2=10.82,P=0.001)及3、5年累计生存率均高于PD-1阳性组(χ2=7.83,4.58;均P<0.05)。见图2。
2.5生存时间影响因素分析 TNM分期、淋巴结转移、GPC1阳性及PD-1阳性是NSCLC患者生存时间的影响因素。见表2。
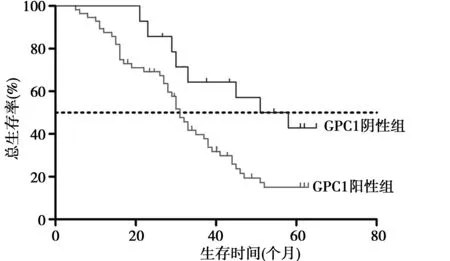
图1 GPC1阳性组和阴性组生存率比较
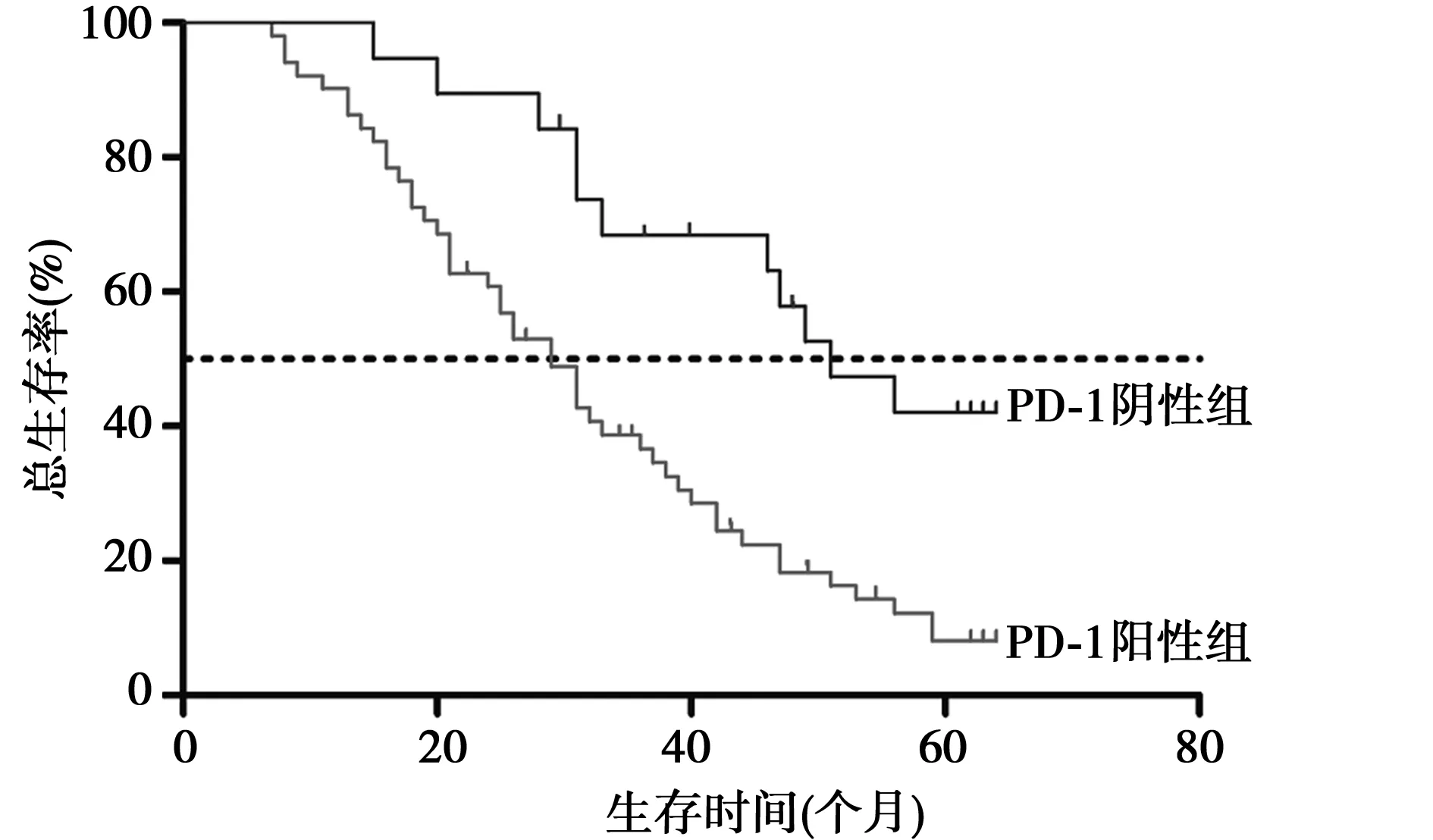
图2 PD-1阳性组和阴性组生存率比较
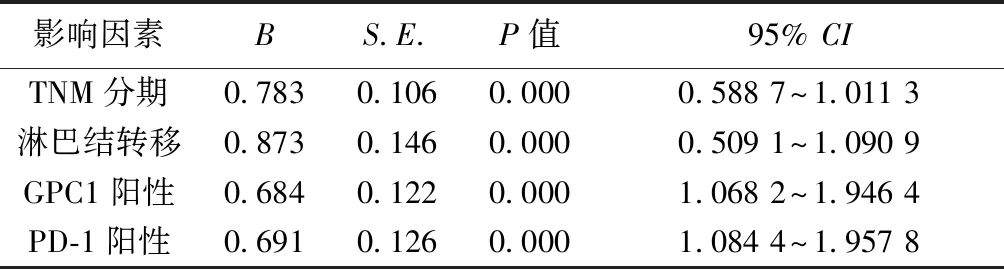
影响因素BS.E.P值95% CITNM分期0.7830.1060.0000.588 7~1.011 3淋巴结转移0.8730.1460.0000.509 1~1.090 9GPC1阳性0.6840.1220.0001.068 2~1.946 4PD-1阳性0.6910.1260.0001.084 4~1.957 8
3 讨 论
肺癌的发病率和死亡率在全球恶性肿瘤范围内均居首位,每年约新增病例130万例。大部分患者在发现时已属晚期,错过最佳治疗时机,因此寻找早期敏感的诊断指标一直为人们所关注〔3〕。
PD-1多表达于活化T细胞表面,与相关配体PD-L1结合后为T细胞提供抑制性第二信号,使T细胞信号通路上的转录因子去磷酸化失活,从而抑制T细胞的活化增殖和白细胞介素(IL)-10、干扰素(IFN)-γ等细胞因子的产生,发挥免疫自稳功能,避免免疫激活带来的机体损伤,这也成为肿瘤细胞逃避免疫系统攻击的主要机制之一〔4〕。目前研究已证实,PD-1在肺癌、乳腺癌、黑色素瘤等多种恶性肿瘤组织中高表达,且与患者的预后相关〔5,6〕。本研究结果显示,GPC1、PD-1高表达与肿瘤的发生、发展及预后均具有相关性。GPC1是硫酸乙酰肝素蛋白多糖(HSPGs)家族的成员之一,通过糖基磷脂酰肌醇附着于细胞膜表面,与肿瘤细胞的增殖、转移和血管生成有关,在多种肿瘤细胞上高表达〔7〕。GPC1多附着于细胞膜表面,因此之前研究结论也均是基于组织或细胞获得的〔8〕。外泌体是在多泡体内形成的小囊泡,可通过胞吐释放至血液、尿液等多种体液中,外泌体膜表面分布的蛋白与其来源细胞的分子指纹和细胞状态带有契合性,且可通过非侵入性途径检测到。已有报道在胰腺癌患者的血清中检测到了GPC1阳性的外泌体,提示外泌体膜蛋白GPC1检测可作为肿瘤诊断的一种便捷手段〔9〕。本研究结果显示GPC1、PD-1在NSCLC组织中表达增加,并提示肿瘤恶性程度高、预后不良,可作为判断患者预后的指标,为NSCLC的治疗提供了新靶点。
