具有降胆固醇功能益生菌的筛选及其体外降胆固醇机制初探
2019-04-25李雅迪柳陈坚龚福明李晓然
李雅迪,柳陈坚,龚福明,2,李晓然
(1.昆明理工大学 生命科学与技术学院,云南 昆明650500;2.德宏职业学院 基础医学部,云南 芒市 678400)
胆固醇又称胆甾醇,是一种环戊烷多氢菲衍生物,它通常以高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、极低密度脂蛋白胆固醇等形式存在于血清脂蛋白中。随着人民物质生活水平的普遍提高,人们通过日常饮食所摄取的胆固醇量也不断增加,由此导致以血脂异常为主要表现的高脂血症,进而诱发动脉粥样硬化,引起以心脑血管疾病为首的一系列循环系统疾病。近年的研究表明,全世界每年大约有1 730多万人死于心脑血管疾病,且发病率呈现逐年上升趋势[1],而WHO(世界卫生组织)的调查结果表明,动脉粥样硬化是心脑血管疾病发生的主要病理基础,血浆胆固醇尤其是低密度脂蛋白胆固醇升高更是动脉粥样硬化发生与发展的必备条件[1],因此有效控制血清总胆固醇含量就成为预防心脑血管疾病的关键[2]。常用降胆固醇药物虽然具有降胆固醇效果显著、快速等优势,但是存在严重威胁人类健康的副作用[3];如他汀类药物就具有肌肉疼痛等副作用,该副作用最终导致横纹肌溶解症,也会导致肝脏细胞损伤,进而破坏人体内部新陈代谢系统的正常工作,相当数量的服药人已经出现记忆力丧失或判断功能混乱等症状。因此探寻能有效降低胆固醇且副作用小的防治方法势在必行。
以不同形式服用益生菌,如酸奶和奶酪等发酵食品,可以带来许多潜在的健康益处,包括降胆固醇作用。研究表明,服用益生菌可以降低血清胆固醇水平[4]。对大鼠进行的动物实验表明,在高胆固醇饮食的同时饲喂益生菌 (植物乳杆菌和芽孢杆菌)可以有效降低大鼠血清中的甘油三酯、胆固醇及低密度脂蛋白的含量,减缓高胆固醇饮食对机体的伤害[5]。这些益生菌已经被建议用于降低胆固醇添加在食品中[6]。关于益生菌降低胆固醇水平的机制已经提出了许多假设,大多来自体外实验,比如,益生菌细胞表面通过胆盐水解酶活性结合胆固醇分子[7-8];益生菌可以产生短链脂肪酸[9];胆固醇与胆汁共沉淀[6];胆固醇转化为粪甾醇[10]等。最主要的机制应该归因于胆盐水解酶活性,大多数益生菌如乳杆菌属、乳球菌属和双歧杆菌属等常见的用于食品发酵的益生菌具有胆盐水解酶活性[11-12],这些益生菌产生的胆盐水解酶可以裂解酰胺键[13]。应用益生性乳酸菌防治高胆固醇血症所引发的心脑血管疾病,不仅效果显著,而且几乎无任何毒副作用[14]。然而,研究表明,不同的菌株具有不同程度的降低胆固醇作用[15]。因此,本研究利用本研究室保存的云南传统发酵食品由来的益生乳酸菌实施胆固醇体外降解试验,从中筛选胆固醇吸收同化率高的菌株,为后续降胆固醇功能性发酵食品的研发提供菌种保证和理论基础。
1 材料与方法
1.1 试验菌株
本研究所使用的菌株全部分离自云南传统发酵食品,详见表1,目前均保存于昆明理工大学生命科学与技术学院应用微生物研究室。
1.2 实验用主要培养基
①de Man-Rogosa-Sharpe(MRS)肉汤培养基(pH 6.2±0.2,Oxoid);② MRS 改良琼脂培养基[16-17]则需在每升MRS肉汤培养基中加入15 g琼脂、10 g CaCO3和 0.04 g溴甲酚紫(0.004%,w/v);③ 降胆固醇菌株初筛培养基(g/L):精确称取胆固醇(磨碎)2.0;KH2PO41.6;MgSO4·7H2O 0.2;MnSO40.2;NH4NO30.2;NaCl 15;琼脂 20;溶于去离子水;④降胆固醇菌株复筛培养基 (g/L):精确称取胆固醇(磨碎)0.15;蛋白胨 10.0;牛肉粉 8.0;酵母浸出液4.0;Tween-80 1 mL;K2HPO42.0; 乙 酸 钠 5.0;MgSO4·7H2O 0.2;MnSO4·4H2O 0.05; 柠檬酸铵 2.0,溶于去离子水。
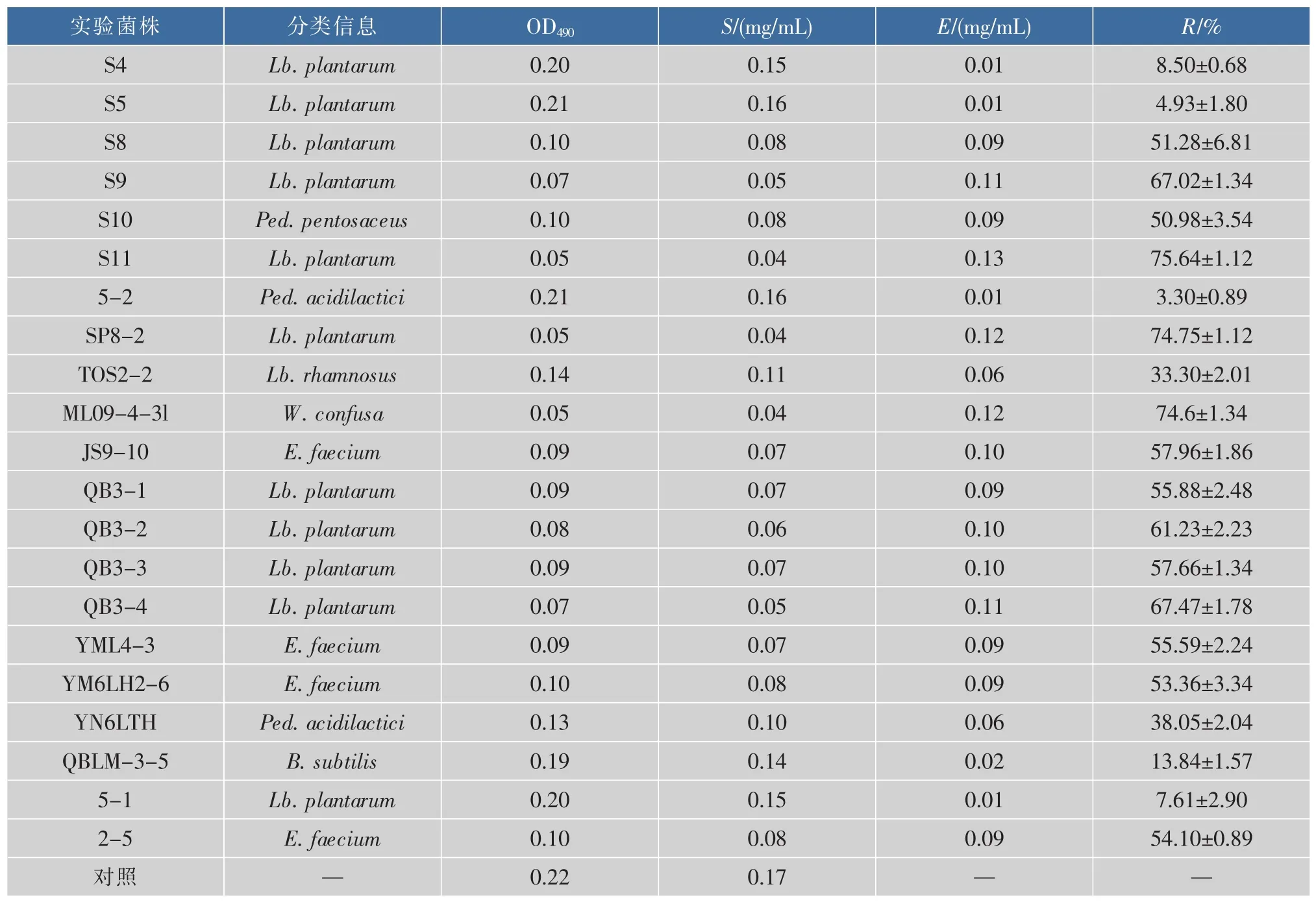
表1 具有降胆固醇能力益生性菌菌株的复筛结果Table 1 Re-screening of cholesterol-reducing probiotics
1.3 试验用主要生化试剂及溶液
1.3.1 试验用主要试剂胆固醇;KOH;甲醇;冰乙酸;正己烷;浓硫酸;上述试剂除特别注明外,所有试剂均为分析纯。
1.3.2 试验用主要溶液①FeSO4-冰乙酸-浓硫酸显色剂[18],将FeSO4100 mg溶于1 mL蒸馏水中,再加入100 mL冰乙酸混合溶解,然后与100 mL浓硫酸缓慢混匀,冷却后备用;②胆固醇标准液,精确秤取0.192 g胆固醇,用蒸馏水定容至1 L,即得浓度0.192 mg/mL的胆固醇标准液,然后梯度稀释得浓度依次为 0、0.048、0.096、0.144、0.192 mg/mL 的标准液。
1.4 主要仪器及设备
恒温培养摇床(GHP-9160):上海一恒科技有限公司;电子分析天平(YP1002N):德国赛多利斯;超声波细胞破碎机(SCIENTZ-ⅡD):上海珂淮仪器有限公司;PCR 仪(2720):ABI公司;高速冷冻离心机(Sigma 3-18K):德国SIGMA公司;紫外分光光度计(Genova):英国 GENOVA 公司;恒温水浴槽(TR-1A):日本 AS ONE 公司;电子天平(YP1002N):上海恒平科学仪器有限公司;恒温金属浴(IC20):日本AS ONE公司。
1.5 降胆固醇功能性益生菌的复筛
对初筛获得的具有降胆固醇能力的益生菌菌株进行复筛,利用略作改良的皂化-比色法对初筛菌株的降胆固醇能力进行检测[19],具体步骤如下:将初筛得到的益生菌菌株用MRS液体培养基复壮两次后,按4‰的接种量将菌株接种至5 mL复筛培养基中,37℃厌氧培养72 h后,2 000 r/min离心取上清(4 ℃,10 min),随后将 500 μL 上清与 2 500 μL饱和KOH-甲醇溶液(200 g/L)充分混匀,80℃水浴中皂化10 min,要求每隔1 min剧烈震荡混匀一次。皂化结束后,将冷却至20℃的皂化物与3 mL正己烷充分混匀1 min,然后静置分层并取上层溶液离心(4 ℃,2 000 r/min,10 min)。 将离心上清1 mL 加入离心管中60℃干燥,待溶剂全部挥发后,用400 μL冰乙酸进行充分洗脱,最后在洗脱液中加入1 mL显色剂,60℃金属浴反应15 min,于490 nm波长下测定被测样品的OD值。同法处理胆固醇标准液和空白对照样品,以胆固醇标准液浓度为横坐标,吸光度值为纵坐标绘制标准曲线。最终根据被测样品的吸光度值计算样品中胆固醇含量,并以公式计算菌株对胆固醇的去除率为
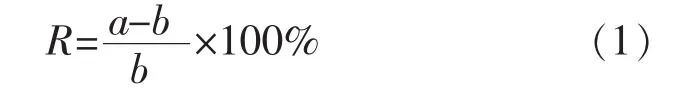
式中:a表示培养基初始培养时的胆固醇质量浓度;b表示培养结束后培养液中胆固醇质量浓度。
1.6 菌株的耐酸能力和耐胆盐能力测定
1.6.1 菌株的耐酸能力测定用普通的MRS液体培养基对保存于-80℃的具有降胆固醇功能的益生菌进行复壮,在复壮2次后,按4‰接种量分别接至pH 2.0和pH 3.0的50 mL的MRS培养基中,37℃静置培养 3 h。 在 0、1、2、3 h 处分别提取 1 mL 样品,10 000 r/min离心2 min收集菌体,再用灭菌的0.85%的生理盐水洗涤并悬浮菌体。按一定的稀释比例(10-1、10-2、10-3)稀释菌体,将稀释后的菌体涂布于MRS固体培养基上,37℃静置培养24 h。培养过后,用平板计数法观察菌株在酸性条件后的生长情况。上述实验重复3次。
1.6.2 菌株的耐胆盐性能力测定培养基的配制:用牛胆盐粉末配制含有0.3%、0.5%和1%胆盐浓度的MRS培养基。用普通的MRS液体培养基对保存于-80℃的具有降胆固醇功能的益生菌进行复壮,在复壮2次后,按4‰接种量分别接至含0.3%、0.5%和1%胆盐浓度的50 mL的MRS培养基中,37℃静置培养12 h。培养12 h后,提取1 mL样品,10 000 r/min离心2 min收集菌体,再用灭菌的0.85%的生理盐水洗涤并悬浮菌体。按一定的稀释比例(10-1、10-2、10-3)稀释菌体,将稀释后的菌体涂布于MRS固体培养基上,37℃静置培养24~48 h。培养过后,用平板计数法观察菌株在胆盐条件后的生长情况。上述实验重复3次。不含有牛胆盐的无菌水作为空白对照。
1.7 Lb.plantarum S11体外降胆固醇机制初探
用MRS液体培养基对保存于-80℃的菌株Lb.plantarumS11进行复壮,在复壮2次后,按4‰接种量接至5 mL降胆固醇复筛培养基中,37℃静置培养72 h,2 000 r/min 4℃离心10 min后,分别取菌体及上清液备用。同时,按4‰接种量将Lb.plantarumS11菌株接种至同体积的MRS培养基中作对照,37℃静置培养72 h,2 000 r/min,4℃离心10 min后,分别取菌体及上清液备用。随后用灭菌生理盐水对上述两实验组中离心得到的菌体进行洗涤,然后再使用灭菌生理盐水悬浮实验组的菌体并定容至10 mL,同时使用灭菌生理盐水将等量对照组的菌体悬浮并定容至10 mL,冰浴静置10 min;加入溶菌酶(0.2 mg/mL)后,37℃孵育 15 min,孵育后超声破碎菌体(功率950 W;时间15 min,工作3 s,间隔 5 s),最后 2000 r/min 4 ℃离心 10 min,收集上清即为菌体破碎后的无细胞上清液,沉淀溶于10 mL灭菌生理盐水后即为菌体细胞碎片悬浮液。按照1.5节中的皂化-比色法检测实验组的培养上清、菌体破碎后上清液及菌体细胞碎片悬浮液中胆固醇含量,在测定培养上清时以阴性对照组进行调零,菌体破碎后的上清液及菌体细胞碎片悬浮液在测定胆固醇含量时使用灭菌的生理盐水调零。另外,将复壮的Lb.plantarumS11菌株按4‰接种量分别接种至5 mL降胆固醇复筛培养基与MRS培养基中,37℃静置培养72 h,经梯度稀释后取适宜浓度的稀释液(10-6倍稀释)涂MRS琼脂平板进行计数。
1.8 数据处理与分析
本研究在检测益生性乳酸菌菌株降胆固醇活性时所得实验数据都经RSD值计算统计软件处理得到,所得平均值和标准偏差均由两个以上样品的测量结果经计算得到,结果均以 “平均值±标准误差”形式表示。
2 结果与讨论
2.1 具有降胆固醇能力的功能性益生菌的复筛
通常除使用比色法筛选具有降胆固醇能力的功能性益生菌外,还使用酶法、液相色谱法、气相色谱法及试剂盒分析法(酶法)等方法进行筛选,而这些方法与比色法相比,酶法由于技术含量较高,特异性强,而其他两种方法又需要特殊的设备,所以都难于推广使用[20]。本研究使用含胆固醇固体初筛培养基配以含胆固醇液体复筛培养基(胆固醇含量150 mg/mL),再以略加改良的皂化-比色法检测胆固醇转化率的两步筛选体系筛选具有降胆固醇能力的益生菌菌株,该筛选体系与常用的高效液相色谱法及试剂盒分析法等方法相比,具有快捷简便,分离筛选效率高,成本较低,适用于大规模筛选等优点。经过皂化-比色法检测,以标准胆固醇浓度为横坐标,检测波长为490 nm的吸光度值为纵坐标做线性回归,得线性回归方程y=1.36x-0.000 6,R=0.999(R2=0.999 7)。经检测得到的在体外具有降胆固醇活性的21株益生性乳酸菌,依据16SrRNA基因序列比对,可将21株菌株分为5属8种,乳杆菌属(12 株)、片球菌属(3 株)、魏斯氏菌属(1 株)、肠球菌属(4 株)、芽孢杆菌属(1 株)(图 1),且它们对胆固醇的吸收同化率为 3.30%(±0.89)~75.64%(±1.12)之间,平均吸收同化率为44.34%,共有14株益生菌的胆固醇转化去除率高于平均值,而编号S11菌株的胆固醇吸收同化率更是高达75.64±1.12%(表 1)。在文献[20]中,10株具有降低胆固醇含量的菌株中,乳杆菌属(8株)、片球菌属(2株),这些菌株对胆固醇的吸收同化率为12.10%~47.54%,其中Lb.agilisBK10-47的胆固醇吸收同化率为47.54%。本文筛选得到的编号S11菌株与之相比,其吸收同化率明显高出。且在文献[21]中,对供试菌株进行胆固醇吸收同化能力的检测中,乳酸菌属所占的比例最高,这与本文的研究结果相一致。
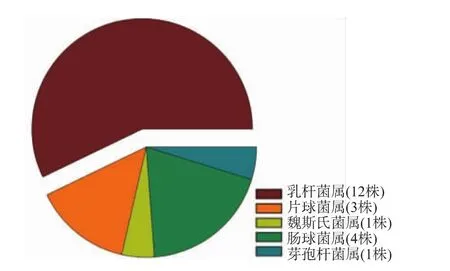
图1 本研究中益生菌基于16S rRNA基因序列的菌种鉴定结果Fig.1 Classification of probiotics in this study by 16S rRNA gene sequencing
2.2 菌株耐酸能力和耐胆盐能力测定
将上述复筛得到的具有降胆固醇能力的菌株进行耐酸和耐胆盐能力的鉴定。模拟胃液的pH的浓度,通过体外培养菌株3 h,利用平板计数法测定菌株的耐酸性能力;在不同浓度的牛胆盐MRS培养基中,培养菌株12 h后,同样利用平板计数法测定菌株的耐胆盐能力,所得结果见表2。由表2可知,只有植物乳杆菌QB3-1、QB3-2、S11这三株菌株具有一定的耐酸和耐胆盐能力。这三株菌株在培养环境达到pH 2.0时,还是可以生存的,证明这三株菌株还是具有一定的耐酸能力。在耐胆盐能力实验中,只有QB3-2可以在胆盐浓度达到1%时还可以生长。QB3-1在胆盐浓度为0.5%时,还是可以生长的。而植物乳杆菌S11的将弹股率最高,也具有一定的耐酸能力,但是在胆盐存在的环境下,不可生长,初步推断该菌株不含有胆盐水解酶,即该菌株降胆固醇的机制是通过结合在细胞表面而被去除。
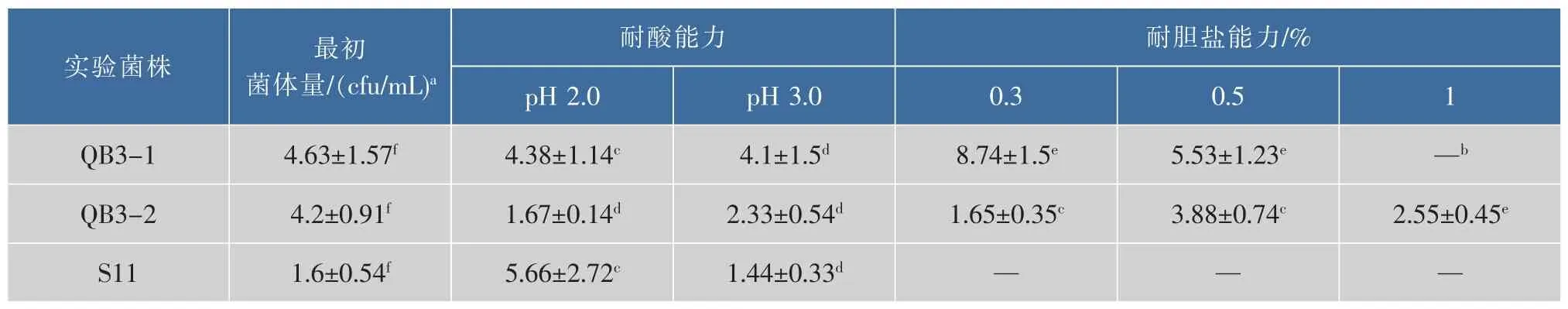
表2 益生菌的耐酸和耐胆盐能力测定Table 2 Acid and bile tolerance of LAB strain probiotics (log cfu/mL)
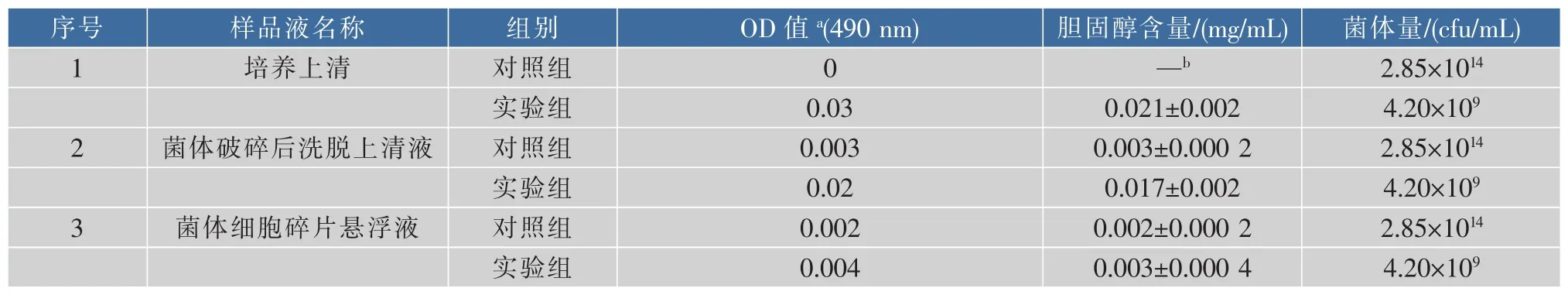
表3 Lb.plantarum S11不同培养部分胆固醇含量变化Table 3 Changes of cholesterol content in different cultures of Lb.plantarum S11
2.3 菌株Lb.plantarum S11体外降胆固醇机制初探
本文通过植物乳杆菌在正常MRS培养基和含胆固醇的培养基中培养后,用皂化-比色法分别检测培养上清、破碎上清及细胞碎片悬浮液中胆固醇含量,然后通过比较各组分中胆固醇含量,初步分析Lb.plantarumS11菌株体外降胆固醇机制。对Lb.plantarumS11实验组培养上清、菌体破碎的无细胞上清液及菌体细胞碎片悬浮液中胆固醇含量测定结果见表3,由表3可知MRS培养基更利于菌株Lb.plantarumS11生长,其菌体生物量可高达2.85×1014cfu/mL,而含胆固醇的复筛培养基则不利于该菌株生长,其菌体生物量则为4.20×109cfu/mL,但在这种不利的生长情况下,该菌株对培养基中所含胆固醇的去除率仍可高达79.17%,说明它具有极强的吸收同化胆固醇能力。在文献[21]的研究中,4株分离于科菲谷物的植物乳杆菌通过平板计数法和测定胆固醇含量,得到乳酸菌同样具有有对胆固醇吸收同化的能力。菌体对胆固醇可能有一定吸附能力,能通过吸附及掺入细胞膜的方式达到降低培养基中的胆固醇含量,但吸附及掺入细胞膜的作用非常微小,4.20×109cfu/mL的菌体仅能吸附沉淀0.002 mg的胆固醇(仅占1.30%)。由此可推测,吸收同化作用仍是Lb.plantarumS11菌株在体外降胆固醇的主要机制,而吸附及掺入细胞膜的降胆固醇机制仅是该菌株降胆固醇的次要途径。正如在文献[22]的研究中,通过菌株降低胆固醇含量能力的检测得到上述体外降胆固醇可能的机制。胆固醇可能是通过吸收同化的作用被去除,也可能是促进胆盐的降解而去除,或者是益生菌的死细胞和活细胞将胆固醇结合在细胞表面而去除。而且也有报道称益生性酵母同样也具有降低胆固醇的功效[24]。
综上所述,云南传统发酵食品中确实存在具有降胆固醇功效的益生菌资源,而本研究所创建的具有降胆固醇功效益生菌的两步筛选体系确实可行。因此,为研发降胆固醇功能性发酵食品,后续研发将以Lb.plantarumS11为主要研究对象,深入探讨降胆固醇功能性发酵豆豉或食品开发的可能性。
3 结 语
1)本研究所创建的以降胆固醇菌株筛选的液体复筛培养基进行复筛并以皂化-比色法检测胆固醇吸收同化率的两步筛选体系确实可行,可用于云南传统发酵豆豉等传统发酵制品中降低胆固醇量的菌株的分离与筛选。
2)通过鉴定复筛得到的具有降胆固醇能力的益生菌的耐酸和耐胆盐能力,得到只有Lb.plantarumQB3-1、QB3-2、S11这三株菌株具有一定的耐酸和耐胆盐能力。Lb.plantarumQB3-2既具有一定的耐酸能力,而且可以在胆盐浓度为1%的环境下生存,但是Lb.plantarumQB3-1稍差于QB3-2。Lb.plantarumS11具有一定的耐酸能力,但是没有耐胆盐能力,故初步推断该菌株不含有胆盐水解酶,其降低胆固醇的机制很有可能是通过菌株细胞膜表面吸附而去除胆固醇。
3)本研究从云南传统发酵豆豉中成功分离到具有较高的降低胆固醇率的菌株Lb.plantarumS11,其胆固醇降低率可高达(75.64±1.12)%,筛选出降胆固醇率高的植物乳杆菌,可用于酸奶和其他发酵食品的制作,这样的发酵食品在降低胆固醇的同时,它还可也能抑制其他潜在致病菌的生长、延长食品储存时间。因此该菌株可应用于后续降胆固醇功能性发酵豆豉或食品的研发。
4)经本研究对Lb.plantarumS11体外降胆固醇机制初探,可知吸收同化作用是Lb.plantarumS11在体外降胆固醇的主要机制 (吸收同化率可达79.17%),而吸附及掺入细胞膜的降胆固醇机制仅是该菌株降胆固醇的次要途径(仅占1.30%)。
