肥胖大鼠经Roux-en-Y胃旁路术减重后脂肪组织差异基因表达的生物信息学分析
2019-04-25苗俊秋高丽娟王德平曹济民
申 晶,苗俊秋,高丽娟,王德平,左 琳,曹济民*
(1山西医科大学生理学系,太原 030001;2细胞生理学教育部重点实验室;3山西医科大学药学院药物化学教研室;*通讯作者,E-mail:caojimin@126.com)
肥胖是一种重要的代谢疾病,并已逐渐成为日益严重的全球公共卫生问题。肥胖患者往往都患有一系列并发症,包括2型糖尿病(T2D)、心血管疾病(CVD)、胃肠道疾病等,这些问题使其死亡风险急剧增加。一般超重可通过适当运动、调整饮食或药物等多种方法进行控制,而对于病态性肥胖,定义为体质量指数(body mess index,BMI)>40 kg/m2或BMI>35 kg/m2合并多种内科疾病,这种肥胖采用保守治疗很难取得预期减重效果,而手术治疗是目前治疗病态肥胖的唯一治疗方法[1]。根据其原理减肥手术可分为三种:减少吸收型、限制摄入型(胃减容术)和混合型手术。其中Roux-en-Y减重手术(Roux-en-Y gastric bypass,RYGB)是胃减容术的一种,它可以重建胃肠道同时缩小胃容积,被称为减肥手术的“金标准”[2]。
本研究收集了6个接受行RYGB减重术的肥胖SD大鼠的芯片数据,利用多种芯片数据发掘工具进行生物信息学分析,探索胃旁路术减重大鼠脂肪组织基因表达的特征以及生物学意义。
1 材料和方法
1.1 研究对象
本研究所用的表达谱数据(GSE8314),是以美国国立生物技术信息中心(National Center of Biotechnology Information, NCBI)基因表达数据库(Gene Expression Omnibus database,GEO)(https://www.ncbi.nlm.nih.gov/geo/)为数据源,设定“weight loss”为关键词检索获得。基因芯片信息平台为GPL1355,即Affymetrix Rat Genome 230 2.0 Array类型。该数据集包含6个样本,包括3个对照组与3个实验组,对照组为高脂饮食诱导肥胖的SD大鼠,实验组为经历胃旁路术且成功的肥胖SD大鼠,取大鼠的腹部脂肪组织进行测序。
1.2 研究方法
1.2.1 差异基因的筛选 利用R语言中“limma”包筛选差异基因[3],筛选标准为P<0.05和|logFC|>1。
1.2.2 差异基因的GO功能和KEGG Pathway富集分析 采用DAVID在线数据库(https://david.ncifcrf.gov/)对差异基因进行Gene Ontology(GO)和Kyoto Encyclopedia of Genes and Genomes(KEGG)Pathway富集分析,以P<0.01为筛选标准确定差异表达基因参与的生物学过程和通路,寻找可能的作用通路。
1.2.3 差异基因所编码蛋白质相互作用(protein-protein interaction,PPI)网络的构建 将差异基因导入STRING数据库(http://string-db.org),验证蛋白质之间的相互作用,设定评分标准为大于0.9,筛选有高密度相互作用的蛋白质。并用Cytoscape软件绘制蛋白质相互作用图。
2 结果
2.1 差异基因的筛选结果
本研究共得到890个差异基因,其中上调基因386个,下调基因504个(见图1)。取前100个差异最明显的基因构建分层聚类图(见图2)。
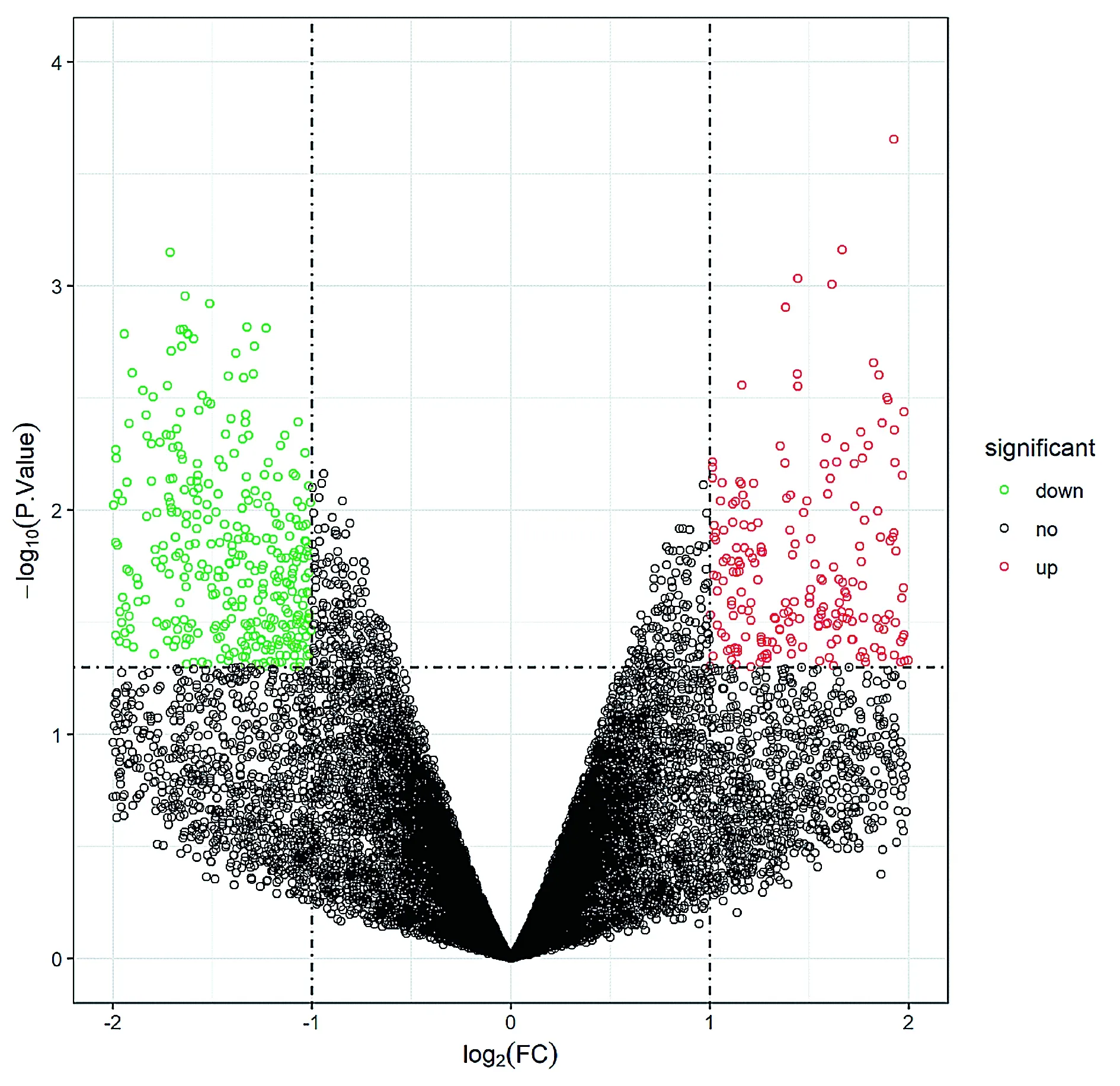
图中每个点代表一个基因,其中黑色的点代表表达无差异的基因,红色代表上调基因,绿色代表下调基因图1 差异基因的火山图Figure 1 Volcano plot of the differenrially expressed genes
2.2 差异基因的GO功能和KEGG Pathway富集分析结果
通过DAVIDE在线软件对差异基因进行GO分析,结果见图3。这些差异基因主要参与25个生物学过程,包括胶原纤维组织(GO:0030199)、伤口愈合(GO:0042060)、对雌二醇的反应(GO:0032355)、对药物的反应(GO:0042493)、细胞增殖的负调节(GO:0008285)、炎症反应(GO:0006954)等生物学过程。分子功能主要涉及3个功能,钙离子结合(GO:0005509)、肝素结合(GO:0008201)、碳水化合物结合(GO:0030246)。细胞组分结果显示,差异基因主要分布在细胞外空间(GO:0005615)、细胞外外泌体(GO:0070062)、细胞外基质(GO:0031012)等12个细胞组分(见图3、表1)。
使用基于KEGG的通路分析发现这些差异基因共涉及信号通路9条,主要的信号通路有:蛋白质消化吸收(rno04974)、细胞色素P450对异生素的代谢(rno00980)、药物代谢-细胞色素P450(rno00982)、花生四烯酸代谢(rno00590)、脂肪细胞因子信号通路(rno04920)、化学致癌作用(rno05204)、ECM-受体相互作用(rno04512)、脂肪因子信号通路(rno04920)、苯丙氨酸代谢(rno00360)、胆汁分泌(rno04976)(见图4)。
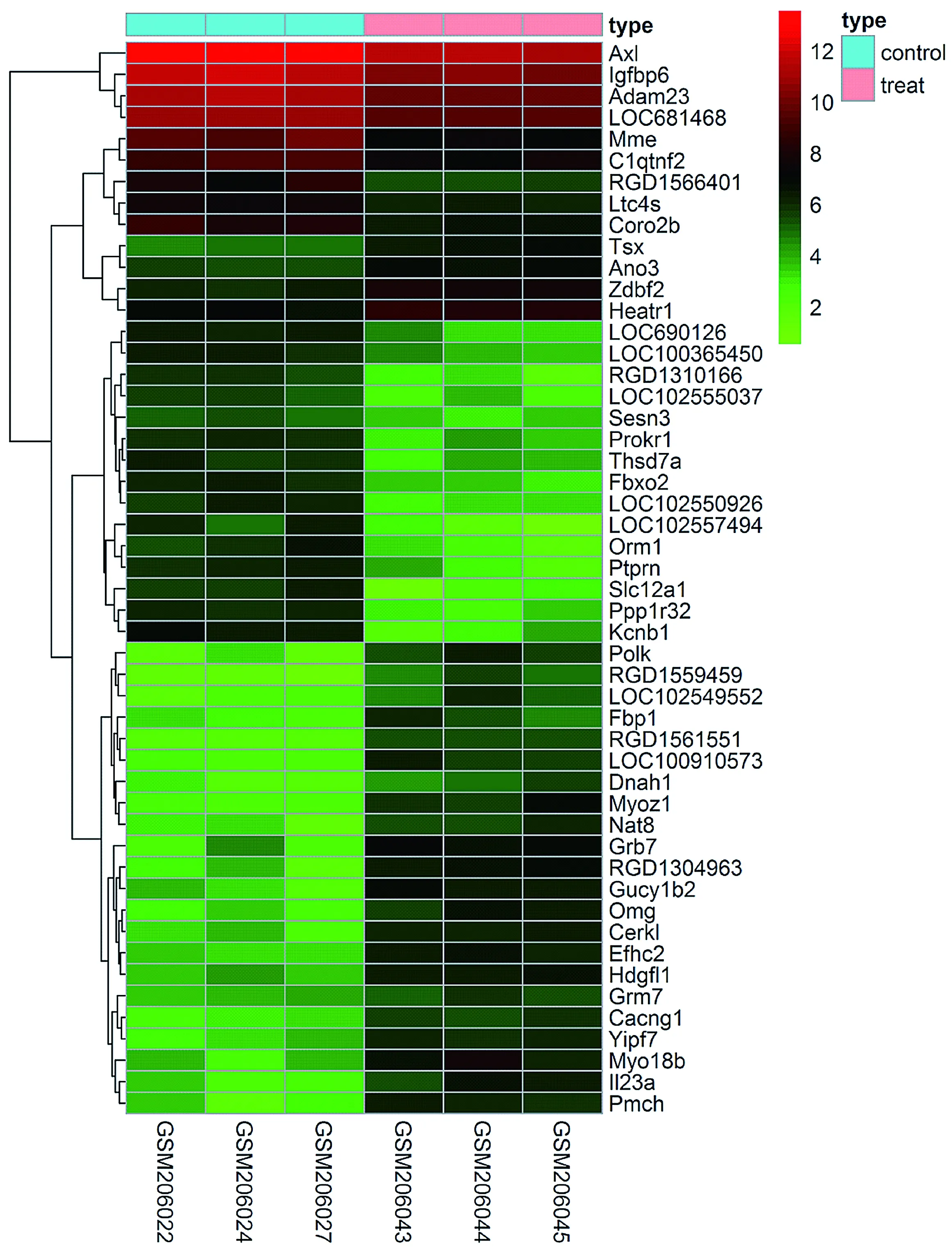
图中每列代表样本,其中前三列代表RYGB减重手术前肥胖大鼠脂肪组织,后三列代表RYGB减重手术后肥胖大鼠脂肪组织。每行代表差异基因,颜色由绿到红代表基因的表达情况图2 差异表达的基因热图Figure 2 Heatmap of the differentially expressed genes
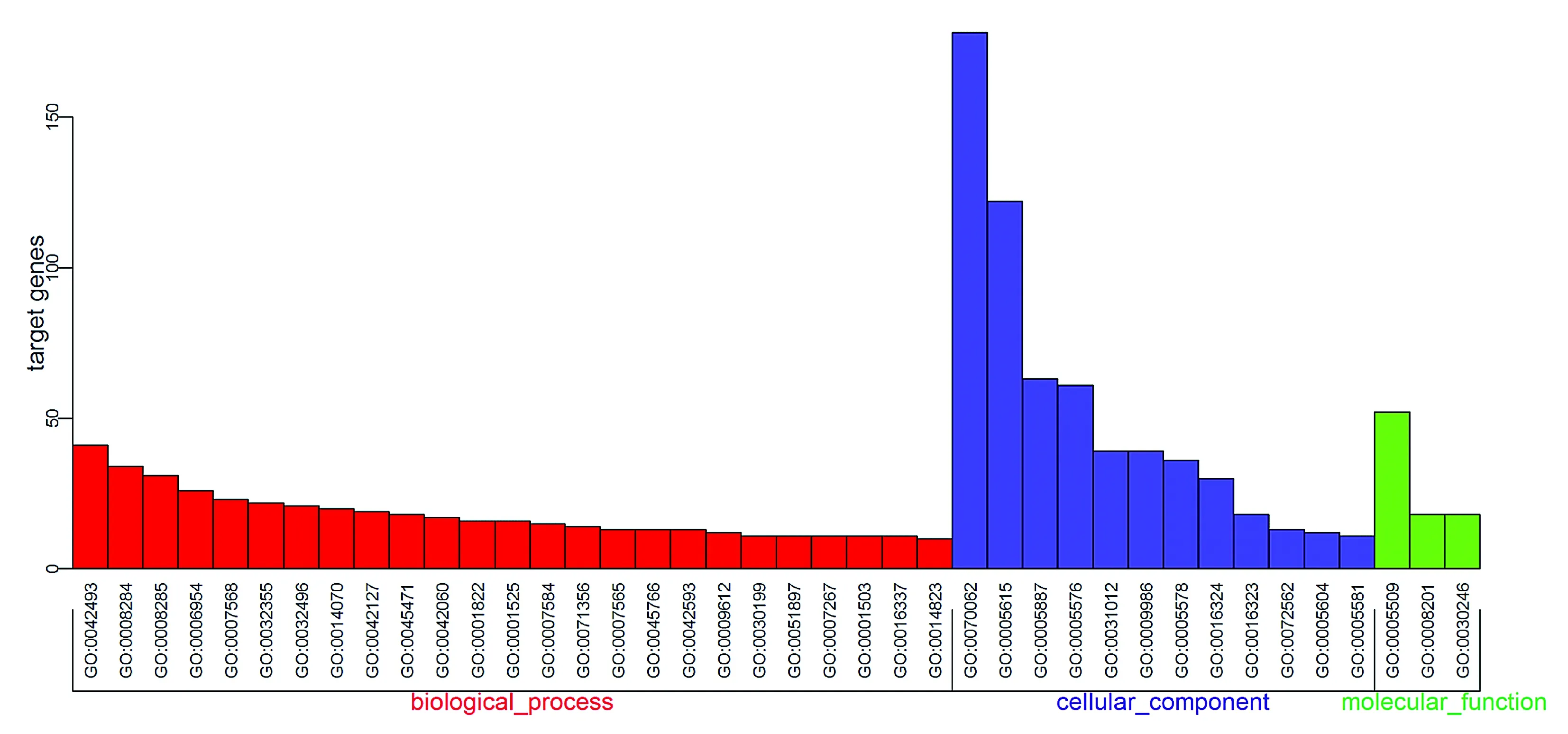
图中每个柱子代表一个生物学功能,其中红色代表生物过程,紫色代表细胞组分,绿色代表分子功能。图3 GO功能富集分析差异基因Figure 3 The result of gene ontology(GO) function analysis of differentially expressed genes
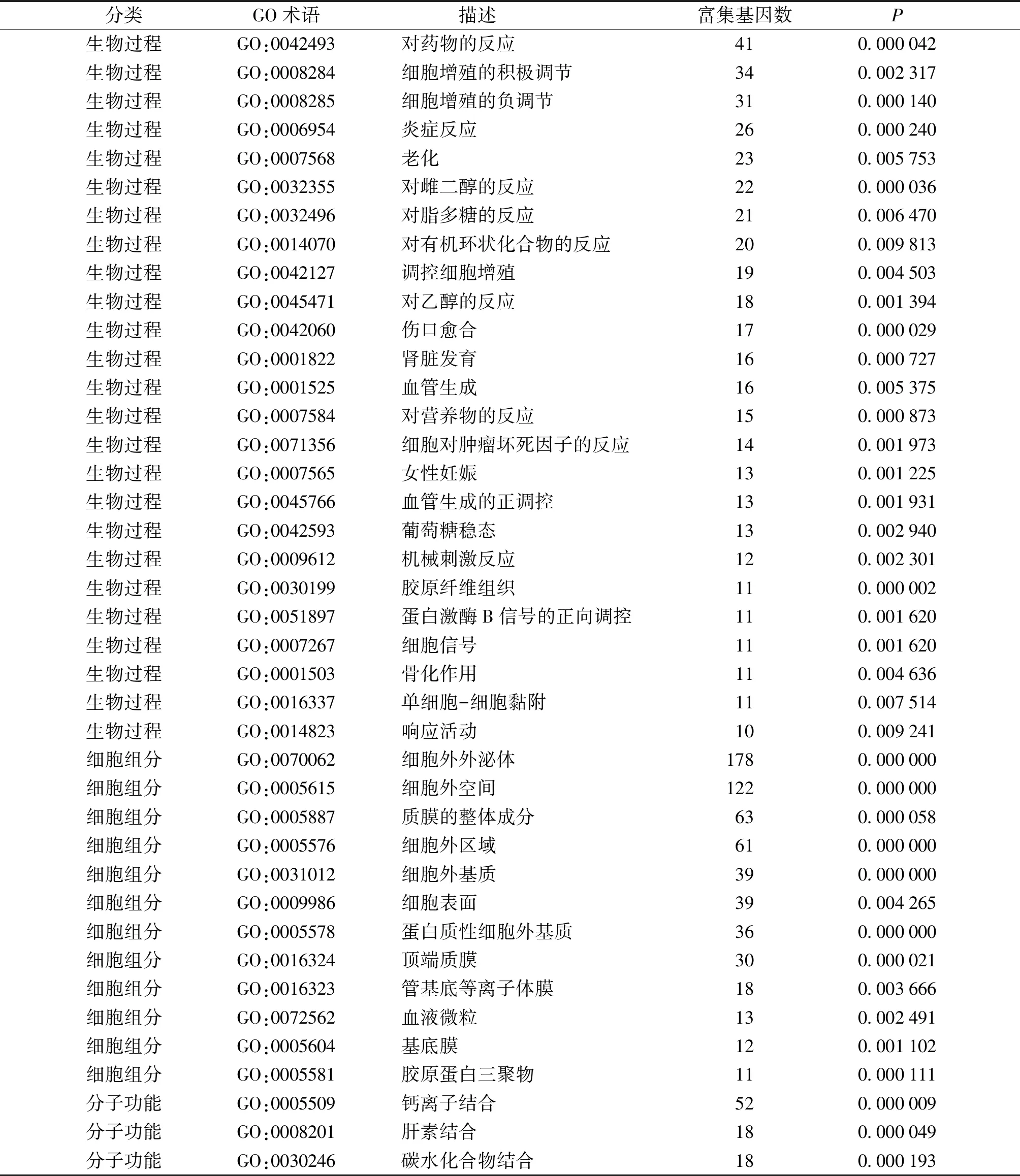
表1 差异基因GO功能富集分析结果
2.3 差异基因所编码蛋白质的相互作用结果
将差异表达基因相对应的蛋白名称导入STRING数据库,在线分析蛋白-蛋白相互作用,设定评分标准为大于0.9,筛选高度相互作用的蛋白质。并用Cytoscape软件绘制蛋白质相互作用图。图中节点表示差异基因表达的蛋白,每条边则表示蛋白与蛋白之间的相互作用关系。一个节点的度(Degree)则表示网络中和节点相连的边的条数。根据节点的Degree绘制出了前30个关键蛋白质节点的条形图,网络中以Bdkrb1(count=15),Ccl6(count=15),Pf4(count=15)有较高的节点值,说明其为蛋白-蛋白相互作用网络中的中心节点(见图5,6)。

图4 差异基因的Pathway分析Figure 4 Pathway analysis of differentially expressed genes
3 讨论
本研究对RYGB减重手术前后肥胖SD大鼠脂肪组织的基因数据进行了深入挖掘,经过R语言处理数据,结合DAVIDE、STRING等数据库对差异基因进行初步筛选和深入分析,从基因水平揭示了胃旁路术减重对机体的影响,最后得到Bdkrb1、PF4等核心基因。
缓激肽B1受体(bradykinin B1 receptor,Bdkrb1)是G蛋白偶联受体超家族A类亚家族的成员。其内源性配体缓激肽,是激肽释放酶-激肽系统的一员,在维持心血管稳态、炎症等生理学进程中起着非常重要的作用[4]。Bdkrb1为诱导性受体,在正常生理状态下低表达,在应激、炎症等状态下如在肥胖、糖尿病患者中其表达急剧增高。越来越多的研究表明,Bdkrb1在肥胖以及糖尿病发生发展中有着非常重要的作用。在基因型肥胖鼠ob/ob鼠中,Bdkrb1表达量增加[5]。在Bdkrb1缺乏[6]以及给予Bdkrb1的拮抗剂[7,8]的肥胖鼠模型中,其脂肪含量下降,血中胰岛素含量下降,胰岛素抵抗及其并发症可明显改善。这一现象是由于在Bdkrb1缺乏的小鼠其体内瘦素敏感性增加[6,9],脂肪组织的炎症受到抑制[6,9]。越来越多的研究证明抑制Bdkrb1的活性能够改善肥胖,本文的结论与此一致。随着抑制Bdkrb1的活性在改善肥胖中作用机制的进一步明确以及Bdkrb1拮抗剂的进一步研究,可为临床上选择性地干预Bdkrb1,优化肥胖及其并发症治疗的措施提供理论基础。
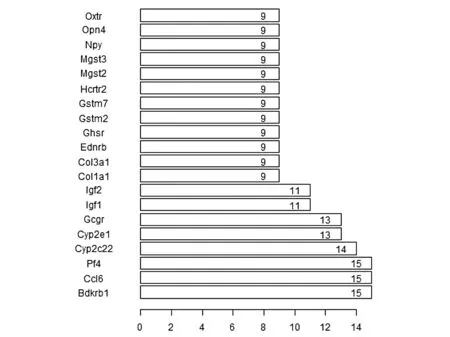
图5 差异基因表达蛋白相互作用节点数Figure 5 Counts of the differentially expressed genes in PPI network
血小板第4因子(platlet factor 4,PF4)又称CXCL4(Chemokine(C-X-C motif)ligand 4),是一种在巨核细胞中合成后,由激活的血小板a颗粒分泌的特异性蛋白质,也是体内血小板激活的特异性指标。作为血小板活化的标记物及活化后释放的含量最丰富的活性因子之一,PF4已被证实在促进动脉粥样硬化形成中起着重要的作用[10]。Ohkura等[11]发现在ob/ob鼠中,其血浆中PF4含量显著增加。肥胖的儿童患者在低热量饮食3周后,体重下降,其血浆中PF4含量也明显下降[12]。说明PF4可能会影响机体的糖脂代谢,提示其在肥胖发生发展中的重要作用。但目前的研究还未阐明其具体机制。Vandercappellen等[13]研究发现,PF-4/CXCL4能够影响单核细胞和巨噬细胞的激活、分化和迁移,并能够抑制机体的血管生成。而肥胖作为一种与慢性轻度炎症相关的疾病[14],与脂肪组织中血管的生成一样是肥胖发生发展的关键环节[15]。目前抗血管生成化合物被用作可能的抗肥胖和抗糖尿病治疗的新方法[16]。这些研究均提示,PF4有望成为治疗肥胖的新靶点。
目前手术治疗是治疗病态性肥胖及其并发症唯一的有效手段。研究发现,减重手术不仅能够降低胃容积限制吸收,并且能够改善机体能量代谢。在本研究中,通过挖掘行RYGB减重手术前后肥胖SD大鼠脂肪组织芯片的基因表达数据,并进行相关生物信息学分析,从而进一步了解减重手术改善代谢的潜在机制,以其发现在肥胖发生发展过程中的一些关键因子,为临床治疗提供一定的参考。
