青春期前高脂饮食诱导的多囊卵巢综合征大鼠氧化应激和低度炎症变化
2019-04-25古兰托合提木拉提叶尔努尔吐苏甫汗马玉兰
古兰·托合提木拉提 叶尔努尔·吐苏甫汗 马玉兰
1.新疆维吾尔自治区人民医院(乌鲁木齐,830001);2.新疆医科大学第二附属医院
多囊卵巢综合征(PCOS)是一种多因素疾病,临床上表现出雄激素过多症,高胰岛素血症,肥胖症,胰岛素抵抗,无排卵和卵巢囊性卵泡等特征[1]。如未及时治疗可能导致其他严重疾病[2]。近年研究发现机体氧化应激(OS)和低度炎症可能是发生PCOS潜在原因[3]。与正常对照组比较,PCOS患者血清中OS标志物,超氧化物歧化酶(SOD)、丙二醛(MDA)、脂质过氧化物(LPO)水平显著变化,提示PCOS患者体内存在OS[4]。另有研究发现,胰岛素抵抗和代偿性高胰岛素血症可诱导PCOS低度炎症产生,PCOS患者血清中低度炎症标志物高敏C-反应蛋白(hsCRP)水平升高[5]。但OS和低度炎症诱导PCOS发病机制尚未阐明。有研究建立了青春期前高脂饮食诱导PCOS大鼠模型[6]。为探讨OS和低度炎症在PCOS发病机制的作用,本研究探讨青春期前高脂饮食诱导的PCOS大鼠卵巢组织氧化应激分子及血清低度炎症标志物的变化。
1 材料与方法
1.1 实验动物
8~10周龄、体重200~250g、SPF级SD雌性大鼠18只和3~4周龄、体重45~55g、SPF级SD雌性大鼠36只,均购置于新疆医科大学实验动物中心(SYXK(新)2013-0002)。饲养温度22±2℃,相对湿度55%±5%,12h昼夜交替,清洁饲养,自由饮水,环境安静,饲养环境符合SPF要求。本实验获新疆医科大学动物伦理委员会通过。
1.2 试剂与仪器
普通颗粒饲料(100%基础饲料,含65%碳水化合物、21.5%蛋白质、4%脂肪、9.5%其他)和高脂肪饲料(50%基础饲料,17%猪油、19%豆油、6%蔗糖、6%酪蛋白、2%其他,含36%碳水化合物、20%蛋白质、40%脂肪、4%其他)购自于新疆医科大学实验动物中心,血糖仪、全自动生化分析仪均购自于德国罗氏诊断有限公司。酶标仪购置于MD公司。SOD、MDA、LPO试剂盒购自于南京建成生物工程研究所。
1.3 实验方法
1.3.1动物分组及模型制作雌性大鼠随机分为对照组(n=18)采用普通颗粒饲料连续喂养105d;诱导组(n=18),采用高脂饲料连续喂养105d[7]。
1.3.2体重及动情周期监测每日称重大鼠,分别于第42~49d、 70~77d、98~105d对每只雌性大鼠阴道涂片检查, 0.9%NaCl生理盐水清洗阴道收集阴道壁细胞并涂片。显微镜下检查玻片上有核上皮细胞、角化上皮细胞和白细胞相对丰度,观察大鼠动情周期变化。
1.3.3卵巢重量及组织学检查分别于第49d、77d、105d采两组大鼠空腹尾静脉血,105d取血后处死大鼠并分离卵巢匀浆备用。另取喂养105d大鼠卵巢,称重后取一侧卵巢石蜡包埋,切片,染色后观察。
1.3.4糖耐量试验、胰岛素抵抗指数及胰岛素敏感检测指数[7]糖耐量试验:禁食过夜后,次日空腹采尾静脉血测定空腹血糖(FG),随后以葡萄糖2g/kg灌胃大鼠,分别在0、30、60和120min后尾静脉取血测定血糖值,计算曲线下面积(AUC)。胰岛素抵抗指数(HOMA-IR):放射免疫法检测空腹胰岛素(FI),HOMA-IR =FI×FG/22.5。定量胰岛素敏感性检测指数(QUICKI):QUICKI =1/[log(FG)+log(FI)]。
1.3.5检测血清血脂、性激素、高敏C-反应蛋白禁食过夜后,次日空腹采尾静脉血。全自动生化分析仪检测血清总胆固醇(TC)、三酰甘油(TG)和hrCRP。放射免疫法测定促黄体生成激素(LH)、卵泡刺激素(FSH),雌二醇(E2),孕酮(P),睾酮(T)。
1.3.6检测氧化应激物黄嘌呤氧化酶法检测SOD活力,硫代巴比妥酸法测定MDA和LPO含量。
1.4 统计学分析
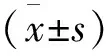
2 结果
2.1 诱导PCOS大鼠特征
阴道涂片评估发情周期发现,对照组发情周期规律,均4~5d;诱导组发情周期为第42~49、70~77、98~105d持续时间逐渐延长,发情周期不规律。与对照组比较,诱导组大鼠喂养105d后糖耐量AUC、空腹胰岛素、HOMA-IR、QUICKI、TC、E2、P、T水平均发生显著变化(P<0.05)(表1、2);卵巢重量显著增加,并观察到多个囊状扩张卵泡、小卵泡及闭锁卵泡,囊状卵泡数、卵泡直径、卵泡膜厚度增加,黄体数量下降(P<0.05)(表3)。
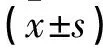
表1 两组不同检测时间各检测指标比较
*与对照组同一时间点比较P<0.05
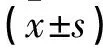
表2 两组不同检测时间血清血脂及性激素水平比较
*与对照组同一时间点比较P<0.05
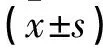
表3 两组喂养105d卵巢组织变化
*与对照组比较P<0.05
2.2 诱导PCOS大鼠卵巢组织氧化应激水平变化
采用重复测量设计的方差分析比较两组大鼠49d、77d、105d卵巢组织SOD、MDA和LPO水平:①不同时间点SOD(F=5.031,P=0.013)、MDA(F=4.639,P=0.018)和LPO(F=21.540,P=0.001)有差别;②SOD对照组(A)高于诱导组(B) (F=129.621,P=0.001),诱导组(B)MDA和LPO高于对照组(A)(F=43.331、33.522,均P=0.001);③两组SOD、MDA变化趋势有差别(F=14.061、5.191、14.980,P=0.001、0.012、0.001)。见图1,2,3。
2.3 诱导PCOS大鼠血清hsCRP水平变化
采用重复测量设计的方差分析比较两组大鼠49d、77d、105d血清hsCRP:①不同时间点hsCRP(F=1.224,P=0.056)无差别;②诱导组(B)hsCRP高于对照组(A)(F=2.342,P=0.041);③两组hsCRP变化趋势无差别(F=0.741,P=0.215),见图4。

图1 两组大鼠卵巢组织SOD水平变化

图2 两组大鼠卵巢组织MDA水平变化

图3 两组大鼠卵巢组织LPO水平变化

图4 两组大鼠卵巢组织hsCRP水平变化
2.4 诱导组大鼠氧化应激和低度炎症的相关性
诱导组大鼠氧化应激分子SOD与MDA、LPO、hrCRP、HOMA-IR、空腹胰岛素呈负相关,MDA与LPO、hrCRP、HOMA-IR呈正相关,LPO与hrCRP和T呈正相关,hrCRP与T呈正相关(均P<0.05)。见表4。

表4 诱导组大鼠氧化应激和低度炎症相关性分析
#r/P
3 讨论
研究发现PCOS患者不同程度出现血清OS标志物水平异常[8]。机体氧化还原平衡被打破时会产生OS损伤,过度损伤可导致细胞功能异常,甚至细胞凋亡。MDA是氧化应激状态下细胞膜脂质过氧化产物,间接反映氧化应激水平。LPO是氧自由基与多聚不饱和脂肪酸反应的产物,通过使受体、酶和离子通道失活影响膜流动性或损伤膜蛋白,甚至破坏膜的完整性最终导致细胞死亡。相对于氧化作用,SOD是重要的机体抗氧化标志物。研究表明PCOS患者卵泡液中MDA含量增高,SOD活力降低,提示卵泡液OS水平增高[4]。但卵巢是PCOS病理损害的直接器官,PCOS患者卵巢OS水平尚不清楚。利用PCOS动物模型研究PCOS患者卵巢OS变化,阐明OS对PCOS发生的影响。
本研究采用青春期高脂饮食诱导大鼠PCOS,其特征与临床PCOS患者症状相似。大鼠体内血清T显著增加,同时卵巢中MDA、LPO浓度在早期开始增加,而SOD活性降低,血清hsCRP也显著增加。这些结果表明雄激素、OS标记物和炎症标记物的增加在本次研究PCOS动物模型中发病相对较早。大鼠体内血清T、hsCRP增加,说明诱导的PCOS大鼠发生低度炎症。另有研究表明来曲唑诱导PCOS大鼠中也发生低度炎症[9]。说明低度炎症在动物PCOS发病过程中可能发挥了重要作用,但其机制尚不清楚。
有研究表明,雄激素过多能够激活血液中单核细胞,这可能是PCOS产生炎症的潜在机制[10]。肥胖与胰岛素抵抗的发展与体内hsCRP水平的升高相关[11-12]。而用二甲双胍治疗PCOS动物血清hsCRP显著降低[9]。在本研究PCOS动物模型中,血清hsCRP水平在高脂饮食喂养第105d显著增加,且与OS标志物SOD、MDA、LPO和T水平存在相关性,表明该模型中低度炎症的增加可能是由氧化应激的早期发展引起。
OS对卵泡发生、卵母细胞成熟、类固醇生成和黄体溶解产生不利影响[13]。 研究表明在来曲唑诱导的PCOS模型中,血清hsCRP和卵巢OS标记物(MDA、LPO和SOD)的水平均高于对照[9,14]。Pandey等研究显示,来曲唑处理大鼠hsCRP和OS标记物(LPO、过氧化氢酶和SOD)的水平显着高于对照。虽然曲唑处理第21天 hsCRP和LPO水平下降,但仍高于对照组。该研究中来曲唑处理大鼠卵巢组织SOD先减少后增加[9,14],与本研究结果不完全一致。这可能与对照、检测方法有关。尽管如此,Pandey等[9]研究也表明hsCRP与OS存在强相关性。表明在PCOS样病症发展过程中OS和炎症标志物存在密切关联。囊性卵泡的增加与卵巢中胰岛素敏感性的降低有关。高雄激素血症,OS水平升高和低度炎症可能是导致该PCOS动物模型中出现囊性卵泡、胰岛素抵抗和肥胖的主要因素[15-16]。
总之,本研究检测了青春期高脂饮食诱导的PCOS大鼠中OS标志物和低度炎症随时间的变化,这些变化与该模型中大鼠PCOS样特征的发展相关。该模型中低度炎症和OS还与雄激素过多密切相关。这个结果表明OS和低度炎症可能在动物发生PCOS过程中发挥作用,也可能是PCOS诱导的主要原因,OS和低度炎症及其相关信号通路有望作为治疗PCOS的药物开发的新靶标。
