菊芋叶绿体分离方法比较研究
2019-04-25许盼盼杨世鹏王丽慧孙雪梅高洁铭钟启文
许盼盼,杨世鹏,王丽慧,孙雪梅,3,高洁铭,李 莉,3,钟启文,3
(1.青海大学 农林科学院 青海省蔬菜遗传与生理重点实验室,西宁 810016;2.青海大学 农牧学院,西宁 810016; 3.青海大学 三江源生态和高原农牧业国家重点实验室,西宁 810016)
菊芋(HelianthustuborosusL.)又称洋姜,菊科向日葵属植物,是一种多年宿根性草本植物[1]。其块茎中富含大量果聚糖,可作为生物、医药、能源、食品加工等方面的原材料,是一种多糖类新兴能源作物[2]。近年来,国内外对菊芋的研究主要集中于抗逆性[3]、品种选育[4]、种质资源和遗传特性[5]、能源转化利用[6]和果聚糖代谢调控[7]等方面。目前,针对菊芋叶片的研究主要集中在其抗氧化、抗菌活性、绿原酸与黄酮类的提取工艺及其吸附性等方面。罗安凯[8]研究发现,菊芋茎叶对重金属离子有较好的吸附作用,孙鹏程[9]研究发现,菊芋叶片可以作为提取绿原酸的一个新植物来源;郑晓涛[10]研究发现,菊芋茎叶黄酮类化合物中的抗氧性组分主要存在于菊芋叶片中,其在食品和药品中可作为抗氧化剂等。
叶绿体(Chloroplast)是植物光合作用的主要器官,是一切生命活动的物质来源,同时其具有独立的遗传系统[11]。它普遍存在于绿色植物、藻类的色素,在绿色植物进行光合作用的过程中,相对于其他细胞器,叶绿体起着能量转化的重要作用[12]。叶绿体中同时进行着多种物质的合成,例如脂肪酸、淀粉、氨基酸等[13]。叶绿体基因组(Chloroplast DNA, cpDNA)是一种闭合环状双股结构,含有10~30个基因,编码200个蛋白质。植物细胞中,细胞核、线粒体以及叶绿体都携带着DNA等遗传物质[14]。与核基因相比,细胞器基因组虽不具备大分子量与高复杂性,却有着分子量小、结构简单及多拷贝的特点[15]。
叶绿体作为植物细胞的重要细胞器,其本身完整的基因组研究在植物基因组学的研究中越来越重要。提取高质量菊芋叶绿体基因组DNA是开展叶绿体基因组组装测序的关键一步,目前常用的植物叶绿体DNA提取方法有:无水法[16]、DNaseⅠ法[17]、改良高盐-低pH法[18]、试剂盒法、离心法[19]等。谢海坤等[20]在中国野生葡萄叶绿体分离及叶绿体DNA提取的研究中发现,柱式植物叶绿体DNA提取试剂盒和改良高盐-低pH法均分离得到中国野生葡萄的叶绿体,但改良高盐-低pH法得到的cpDNA浓度高、杂质少;刘少林等[21]利用DIECA和PVP,对高盐-低pH法进行改进,并提取分离棉花叶片的叶绿体基因组,得到的cpDNA无杂质污染,电泳条带清晰无拖尾;陆丹等[22]采用高盐-低pH法和CTAB法提取高粱叶片的cpDNA,并对缓冲液SDS浓度进行优化,比较发现高盐-低pH法提取高粱基因组DNA效果更好;梁凤萍等[23]对27种菊科植物的叶绿体进行全基因组序列分析,提供了菊科植物分类鉴定和定位的依据,而对菊芋cpDNA的提取方法未报道。本试验通过对比植物组织叶绿体DNA萃取试剂盒中物理法、化学法、Percoll密度梯度离心法、高盐-低pH法和差速离心分离法,以期筛选出适合菊芋cpDNA提取的最佳方法,为菊芋和其他菊科作物叶绿体基因组的研究奠定基础。
1 材料与方法
1.1 试验材料
选取青海农林科学院研发中心资源苗圃中的菊芋‘青芋1号’叶片。于2017-08-04采集菊芋成熟期的枝干顶端幼嫩叶片,用蒸馏水清洗干净,滤纸吸干表面水分,避光,置于4 ℃,备用。
1.2 菊芋叶绿体的提取
1.2.1 改良高盐-低pH法 在叶绿体的提取与纯化过程中加入氯仿∶异戊醇=24∶1(体积比) 1 mL,颠倒离心管5 min,12 000 r/min离心10 min,转移上清液至新离心管,对照上面的方法重复抽提5次。加入2 mL 20 ℃预冷的无水乙醇及2 mL乙酸钠溶液(2.4 g/L)和24 mmol CTAB/NaCl溶液1 mL,混匀后-20 ℃静置2 h沉淀析出DNA,4 ℃ 13 000 r/min离心10 min,回收DNA沉淀。沉淀用φ=75%乙醇漂洗2次,置于室温干燥。加入800 μL TE(Tris-EDTA buffer solution)缓冲液(购自北京索莱宝科技有限公司)和10 μL的RNaseA,37 ℃下反应4 h。小心颠翻离心管 5 min,10 000 r/min离心10 min,转移上清液。上清液加φ=1/10乙酸钠溶液(2.4 g/L),混匀后加无水乙醇(-20 ℃预冷)2 mL,4 ℃ 13 000 r/min离心10 min,弃上清,用φ=75%乙醇漂洗1次,室温干燥,加入TE缓冲液20 μL溶解并混匀沉淀,-20℃保存,备用。其他步骤均参考黎金燕等[24]的方法。
1.2.2 GENMED试剂盒物理法和GENMED试剂盒化学法 GENMED试剂盒购自上海杰美基因医药科技有限公司,将菊芋叶片去中脉并切小,称取1 g。放入暗室4 ℃过夜,液氮研磨,按使用说明书进行。
1.2.3 Percoll密度梯度离心法 将菊芋叶片去中脉并切小,称取10 g。放入暗室4 ℃过夜,液氮研磨,后续步骤参考Michaud等[25]。
1.2.4 DNaseⅠ差速离心法 将叶片去中脉并切小,称取20 g。放入暗室4 ℃过夜,后续步骤参考姜少俊等[26]。
1.3 菊芋叶绿体显微镜观察
分别从以上5种方法提取的cpDNA粗提液中吸取20 μL,制作临时载玻片,在奥林巴斯BX53显微镜下经40×物镜观察提取得到的叶绿体细胞的情况并拍照。
1.4 菊芋cpDNA质量检测与电泳检测
cpDNA浓度和纯度检测:从备用的cpDNA样品中吸取2 μL,用核酸蛋白检测仪(北京天根生化科技有限公司)测定cpDNA浓度,用ddH2O作空白对照校0点,记录OD260/OD280、OD260/OD230和cpDNA浓度,其中标准DNA OD260/OD280在1.80~2.0,OD260/OD230在0.8~1.2,根据OD260/OD280和OD260/OD230评价cpDNA质量。
凝胶图谱检测:从备用cpDNA液中吸取 2 μL,稀释10倍。吸取稀释液2 μL,加2 μL的 6×DNA loading buffer染色,以λDNA HindⅢ为marker,在10 g/L琼脂糖凝胶上用恒压80 V电泳50 min后,在Bio-Rad Gel Doc XR+凝胶成像系统上观察结果并拍照。
1.5 PCR引物扩增
随机选取RAPD引物4对[27],分别以5种方法提取的cpDNA为模板进行PCR扩增反应(PCR引物扩增的试剂均购自北京天根生化科技有限公司)。PCR反应体系:总反应体系为25 μL,其中包括2×Taq PCR MasterMix 12.5 μL、引物1 μL、ddH2O 10.5 μL、模板cpDNA 1 μL。PCR扩增条件:95 ℃预变性2 min;94 ℃变性30 s,40 ℃退火30 s,72 ℃延伸60 s,循环42次;72 ℃延伸5 min。用10 g/L的琼脂糖凝胶电泳检测PCR产物,Bio-Rad 凝胶成像系统进行拍照分析。引物名称及序列见表1。

表1 引物名称及序列Table 1 The name and sequence of primers
2 结果与分析
2.1 5种方法分离菊芋叶绿体电镜观察结果
通过显微镜对5种提取方法得到的菊芋叶绿体粗提液观察发现,在40×物镜下分别得到分离的叶绿体、叶绿体个数及形状。根据(图1)对比发现DNaseⅠ差速离心法分离出的叶绿体最少,改良高盐低-pH法得到的叶绿体数目多,含量高;相比较而言,其他4种方法分离得到的菊芋叶片叶绿体含量、数目较少。从表2可以看出,5种方法提取分离的叶绿体细胞均呈现扁圆形,且改良高盐-低pH法分离出的叶绿体个数高达610个。因此,改良高盐-低pH法能分离出更高质量的菊芋叶绿体。
2.2 菊芋cpDNA质量检测与电泳检测
2.2.1 核酸蛋白检测仪检测结果 对5种方法分离后提取的cpDNA进行核酸蛋白检测仪检测,分析菊芋cpDNA的浓度和不同波长下吸光度数值,从表2中可知,5种方法提取的cpDNA指标差异显著,除了改良高盐-低pH法提取的OD260/OD280高于1.8外,其他4种提取的OD260/OD280低于1.8,为1.353~1.750,低于纯净DNA(1.8~2.0);DNaseⅠ差速离心法和Percoll密度梯度离心法OD260/OD230高于纯净DNA,表明这2种方法提取的样品中可能有较多的未纯化完全的多糖和多酚类物质;对比5种方法提取的cpDNA浓度发现,高盐-低pH法的cpDNA质量浓度可达到295.63 μg/μL。结果表明改良后的高盐-低pH法提取菊芋叶片中的cpDNA纯度较好。由上述结果看出,高盐-低pH法提取cpDNA质量较高,糖类及酚类物质污染较轻,因此,更能满足植物叶绿体基因组建库测序的要求。
2.2.2 凝胶电泳检测结果 由10 g/L琼脂糖凝胶电泳的结果(图2)看出:高盐-低pH法、GENMED试剂盒物理法有明显的条带, GENMED试剂盒化学法、Percoll密度梯度离心法、DNaseⅠ差速离心法没有条带。GENMED试剂盒化学法条带比高盐-低pH法条带的亮度有所降低,可能由于多糖的干扰;GENMED试剂盒化学法的条带几乎看不清楚,说明cpDNA有降解;Percoll密度梯度离心法和DNaseⅠ差速离心法没有条带,表明cpDNA浓度较低且降解。相反高盐-低pH法条带清晰、整齐,亮度均匀,完整性较好。通过对比可知,高盐-低pH法提取的cpDNA产量高于其他方法,即提取cpDNA的质量好于其他方法,与核酸蛋白检测仪的定量分析结果吻合。

A.GENMED试剂盒物理法 Physical method of GENMED kit;B.GENMED试剂盒化学法 Chemical method of GENMED kit;C.DNaseⅠ 差速离心法 DNaseⅠdifferential centrifugation;D.Percoll密度梯度离心法 Percoll density gradient centrifugation method; E.改良的高盐-低pH法 Improved High salt-low pH method

图1 5种方法分离提取菊芋叶绿体显微图片Fig.1 The micrographs of chloroplast isolate by five methods

表3 5种方法提取菊芋cpDNA质量的检测结果Table 3 The quality of cpDNA extracted from Jerusalem artichoke by five methods
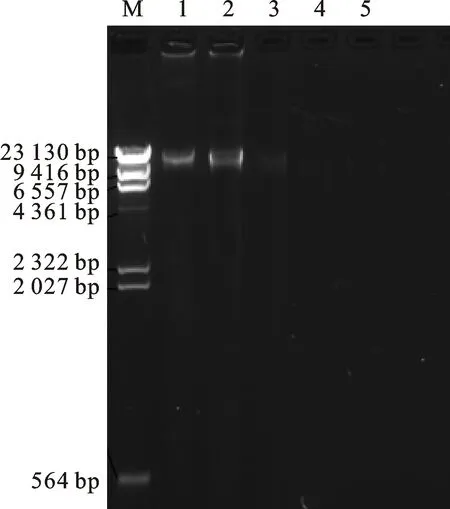
M.λDNA/Hind Ⅲ marker;1.改良高盐-低pH法 Improved high salt-low pH method;2.GENMED试剂盒物理法 Physical method of GENMED kit;3.GENMED试剂盒化学法 Chemical method of GENMED kit;4.Percoll密度梯度离心法 Percoll density gradient centrifugation method;5.DNaseⅠ差速离心法 DNaseⅠdifferential centrifugation;下同 The same below
图2菊芋cpDNA电泳检测
Fig.2ElectrophoresispatternofchloroplastDNAextractedfromJerusalemartichoke
2.3 PCR扩增
使用5种方法提取的cpDNA分别对4对RAPD的引物进行PCR扩增,经10 g/L琼脂糖凝胶电泳的扩增,结果显示(图3),在4对RAPD引物的扩增结果中,改良高盐-低pH法cpDNA在4对RAPD引物中均扩增特征标记图谱,条带清晰,带型一致;GENMED试剂盒物理法cpDNA在第4对引物中未扩增出特征标记条带;GENMED试剂盒化学法的cpDNA只在第A对和第D对引物扩增出特征标记图谱,而在A引物中的扩增条带几乎看不到,在第B对和第C对引物中未扩增出特征标记图谱;Percoll密度梯度离心法、DNaseⅠ差速离心法的cpDNA在4对RAPD引物中均未扩增出特征标记图谱。因此,进一步验证了高盐-低pH法提取的菊芋cpDNA的完整性。
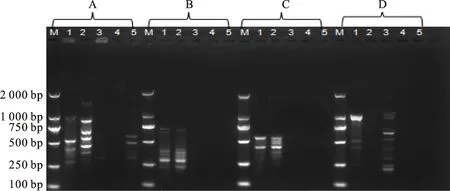
M.D2000 marker; A.OPA10;B.OPE02;C.OPS12;D.OPS15
3 讨 论
提取高质量菊芋叶绿体基因组DNA是开展叶绿体基因组组装测序的关键一步,然而在cpDNA提取过程中,叶绿体较难分离,同时存在核DNA与线粒体DNA污染情况。此外,不同植物具有不同特性,选取方法、试剂等因素均会导致植物cpDNA提取效果不同[15-19]。目前,没有专门针对提取菊芋叶片cpDNA的方法,因此,筛选出适合菊芋cpDNA 的提取方法十分重要。本试验在参考其他植物cpDNA分离提取方法的基础上,选择5种常见的cpDNA 提取方法对菊芋cpDNA的提取效果进行比较,发现5种方法均可提取到菊芋cpDNA。试剂盒法操作虽然快速、简单,但获得的cpDNA含量较少,成本较高[28];Percoll密度梯度离心法操作比其他方法繁琐,同时成本高、耗时长、产率低[29];DNaseⅠ差速离心分离法很难得到完整叶绿体膜、纯度以及含量都较低[30];而改良高盐-低pH法不仅操作简单,且可快速获得完整叶绿体以及高质量、高产率的cpDNA[31]。
菊芋中富含大量的果聚糖,其占菊芋块茎鲜质量的20%或者干物质量的90%,由于糖类物质的存在对DNA分离、纯化及cpDNA的稳定性造成一定困难,赵孟良等[32]在提取菊芋DNA过程中进行改良,避免多糖类物质对DNA质量的影响。本试验在其他植物cpDNA提取方法的基础上,加入24 mmol CTAB/NaCl溶液1 mL,以减少混入多糖对cpDNA的影响,结果较为明显,利用改良高盐-低pH法提取的cpDNA含量和质量均比较高。试验过程中使用商品化的TE(Tris-EDTA buffer solution)缓冲溶液,减少了试剂配制的步骤,且易于溶解。此方法提取及获得的cpDNA条带清晰、干净且亮度高,其中OD260/OD280为1.926,质量浓度为295.63 μg/μL,表明提取的菊芋cpDNA质量高,纯度高,是一种较合适的菊芋cpDNA提取方法,可为后续的菊芋cpDNA其他分子研究奠定基础。
