‘泡桐1201’幼苗对钠盐胁迫的生理响应
2019-04-25朱秀红王美红孙喜营杨金橘茹广欣
朱秀红,王美红,孙喜营,杨金橘,茹广欣
(河南农业大学,郑州 450002)
目前,城镇化的扩张、工业化的建设造成环境土地压力越来越大,人们越来越重视盐碱地的改造和利用,积极解决土壤盐渍化的环境问题[1]。中国有超过3 000万 hm2土地属于盐碱地[2],盐渍化土壤抑制植物的生长发育,造成植物产量锐减[3]。因此,提高植物的耐盐性显得尤其重要。盐胁迫对植物的伤害表现在4个方面,渗透胁迫、离子毒害、营养元素缺失和氧化胁迫,最终导致植物的生长发育被抑制甚至死亡[4]。Han等[5]报道,盐渍化的土壤主要通过植物组织的离子毒害和渗透胁迫来影响植物生长。盐胁迫最先伤害植物根系的细胞质膜,对细胞质膜的选择透过性、稳定性的伤害成为直接原初盐害[6]。植物组织中过多Na+的积累,打破细胞质内的离子平衡,对植物产生毒害影响[7]。
泡桐(PaulowniaSieb.et Zucc)作为一种速生木材,在中国分布广泛,具有较强的耐干旱能力和适应能力。但关于‘泡桐1201’对盐胁迫的响应机制,特别是关于根系离子平衡鲜见报道,因此,探究盐胁迫对‘泡桐1201’幼苗生长的生理响应情况与适应机制,了解‘泡桐1201’盐胁迫下离子应答机制,为选育耐盐碱性作物,大力推广该树种提供科学依据。
1 材料与方法
1.1 试验材料
供试材料采自河南农业大学毛庄‘泡桐1201’号种子。
1.2 试验设计
以‘泡桐1201’幼苗为研究对象,在盐浓度为0~200 mmol·L-1进行胁迫处理,每50 mmol·L-1设置1组,共5组,测定幼苗的生理指标以及根系离子流速。
种子用次氯酸钠浸泡30 s左右,无菌水反复冲洗4~5次后,将冲洗净的种子浸泡在无菌水中催芽5~7 d后置于光照培养箱中培养,每天定时向培养皿中补水。待种子萌发至子叶展开后,将发芽的种子接种于(对照组)盐胁迫浓度分别为 0、50 mmol·L-1、100 mmol·L-1、 150 mmol·L-1和200 mmol·L-1的MS培养基中。取30 d的幼苗测定其生长指标、抗氧化性指标和离子流速。
1.3 测定方法
生长指标为株高、主根长度以及根、茎、叶的鲜质量和干质量。叶绿素质量分数的测定采用乙醇提取比色法[8]。SOD活性的测定采用氮蓝四唑法[9]。POD活性的测定采用愈创木酚法[10]。MDA的质量摩尔浓度测定采用硫代巴比妥酸法[11]。CAT酶活性测定采用双氧水法[12]。离子流速采用非损伤微测技术测定根尖Na+、K+、H+和Ca2+流速[13]。
1.4 数据分析
盐胁迫处理设置 3 个生物学重复,每个生物学重复设置 3 个操作重复。生长指标的测定方法为每个处理测量10棵,抗氧化酶活性测定每个处理设置3个重复,离子流速测定每个处理重复5次。采用SPSS 17.0软件对数据进行处理,采用Duncan’s法进行处理间的差异显著性比较。柱状图的绘制使用Origin 8.0软件,结果以“平均数±标准差”表示。
2 结果与分析
2.1 盐胁迫对‘泡桐1201’幼苗生长情况的影响
植物的生物量可以反映出植物的生长情况,盐胁迫浓度越大,植物受到的迫害越严重,干质量和鲜质量的减少量越大[14]。由表1可知,盐胁迫下,各项生长指标均低于对照组。幼苗的株高、根长随盐胁迫浓度的增大而逐渐下降。在盐浓度为50 mmol·L-1时,幼苗株高和根长降低不明显,在盐胁迫浓度为100 mmol·L-1、150 mmol·L-1和200 mmol·L-1时,株高分别显著降低14.6%、27.2%和44.3%,主根长分别显著降低14.0%、41.4%和 62.8%。在植株生长的过程中,根系首先接触盐分,所以根系受到的抑制最明显,随着盐分的增加,主根长受到的胁迫越明显,主根长越短。

表1 盐胁迫下‘泡桐1201’幼苗生长情况Table 1 Growth of‘P.1201’ seedling under salt stress
注:同列不同小写字母表示差异显著(P<0.05)。下同。
Note:Different lowercase letters represent significant difference(P<0.05). The same below.
2.2 盐胁迫对‘泡桐1201’幼苗叶片叶绿素质量分数的影响
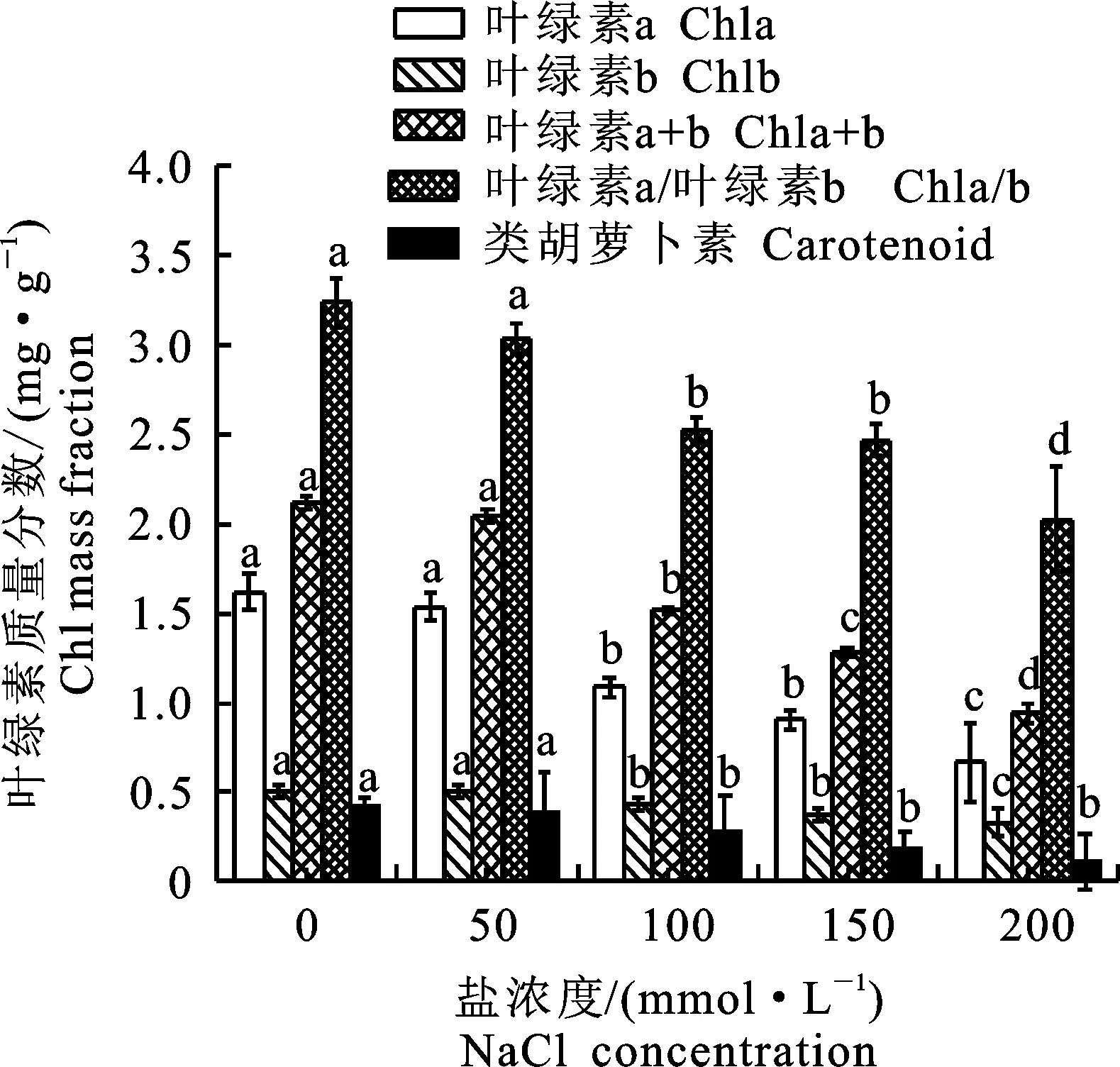
叶绿素在植物的光合作用中发挥着重要作用,叶绿素质量分数少的植物光合能力弱,同时用叶绿素质量分数来衡量植物抗逆性[15]。由图1可以看出,盐胁迫使‘泡桐1201’幼苗绿素a明显降低,随盐胁迫浓度的增加,呈下降的趋势,与对照组相比,叶绿素a在盐胁迫浓度为50 mmol·L-1变化不明显,在150 mmol·L-1和200 mmol·L-1浓度下,分别降低43.8%和58.6%。叶绿素b变化不大,与叶绿素a变化趋势一致。类胡萝卜素随着盐胁迫浓度增加,质量分数逐渐减少。叶绿素质量分数在盐胁迫浓度为100 mmol·L-1时下降趋势较显著,与对照组相比下降28.8%。在高浓度盐胁迫下,叶绿素质量分数低于对照。在盐胁迫浓度为200 mmol·L-1时,植物受到较为严重的外界胁迫,叶绿素质量分数降低,光合作用能力减弱。
2.3 盐胁迫对‘泡桐1201’幼苗SOD活性的影响
SOD活性反应植株活性氧基清除能力的大小,与作物抗盐性有密切联系[16]。植株体内自由基的清除能力可通过增大SOD和POD活性降低对细胞的损害。由图2可知,SOD活性随盐胁迫浓度变化而变化,先增强后减弱。在50 mmol·L-1盐胁迫浓度下,与对照组相比,叶片和根尖SOD活性差异不显著。在浓度为100 mmol·L-1时,SOD活性最高,叶片的SOD活性相比对照组显著增加26.6%,‘泡桐1201’植株的SOD活性增幅较大,此时植株表现较强的抗性。SOD活性都随着盐胁迫浓度的增大呈先增加后降低的趋势。根尖的SOD活性变化趋势与叶片中的基本一致。
不同小写字母表示差异显著(P<0.05)。下同 Different lowercase letters represent significant difference(P<0.05).The same below
图1盐胁迫下‘泡桐1201’叶绿素质量分数
Fig.1Chlorophyllmassfractionof
‘P.1201’undersaltstress
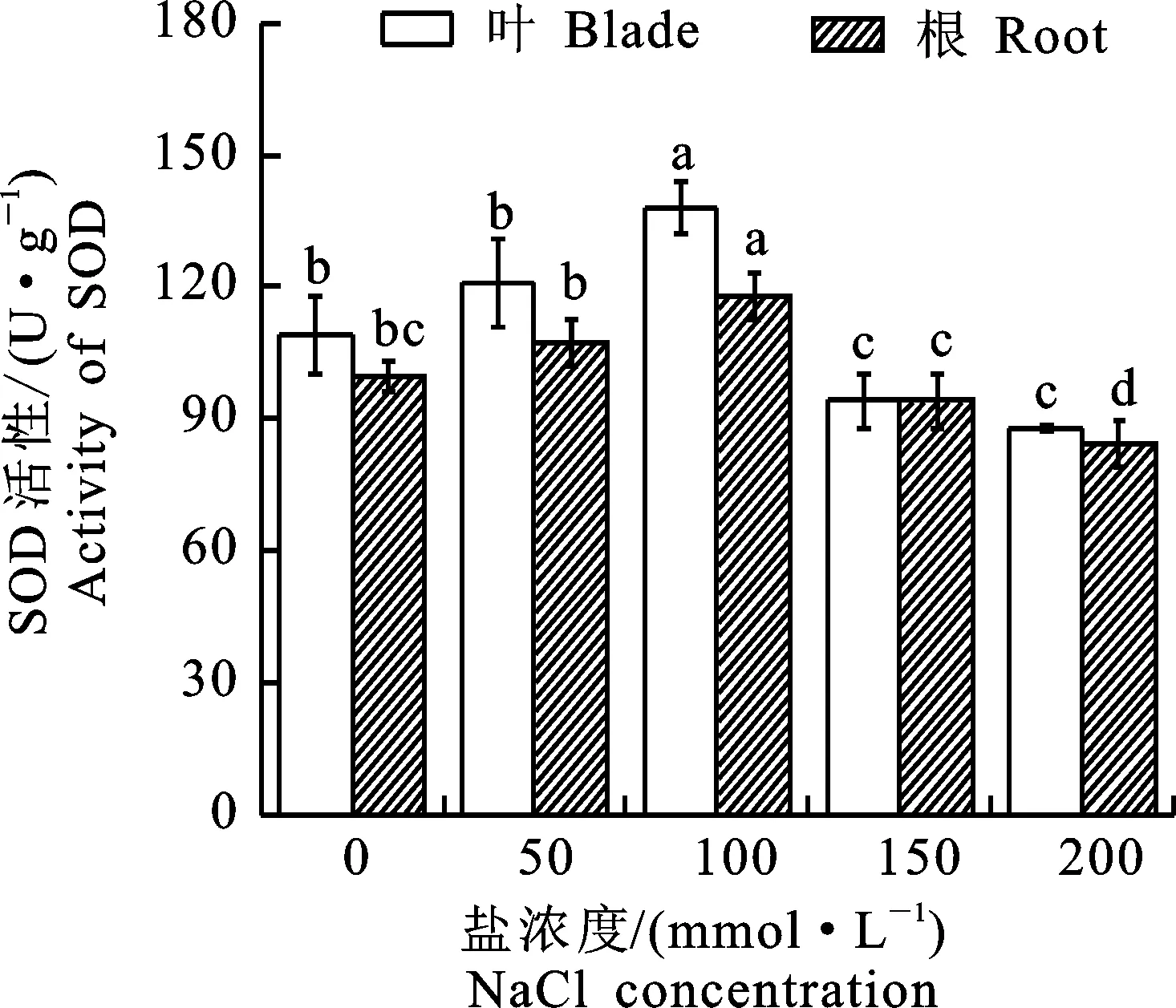
图2 盐胁迫下‘泡桐1201’SOD活性Fig.2 SOD activity of‘P.1201’ under salt stress
2.4 盐胁迫对‘泡桐1201’幼苗POD活性的影响
POD是植物体内保护酶的一种,在植物体中活性很高,通过将植物体内自由基生成的过多的过氧化物分解为水和氧,以降低过氧化物对细胞和组织的毒害性[17]。由图3可知,在盐浓度为50 mmol·L-1时‘泡桐1201’幼苗中POD活性显著升高。当盐胁迫浓度为100 mmol·L-1时,与对照组相比,POD活性升高66.8%。在150 mmol·L-1时较100 mmol·L-1POD活性下降 28.6%。在200 mmol·L-1时叶片中POD活性下降至最低,达244 U·g-1。根尖和叶片在50 mmol·L-1时与对照组差异较大,此时POD活性达到最大值。在盐胁迫浓度超过50 mmol·L-1时,随着盐胁迫浓度的增加POD活性显著下降,表明此时盐胁迫已经超过植物的自我保护范围,影响植物的生长。
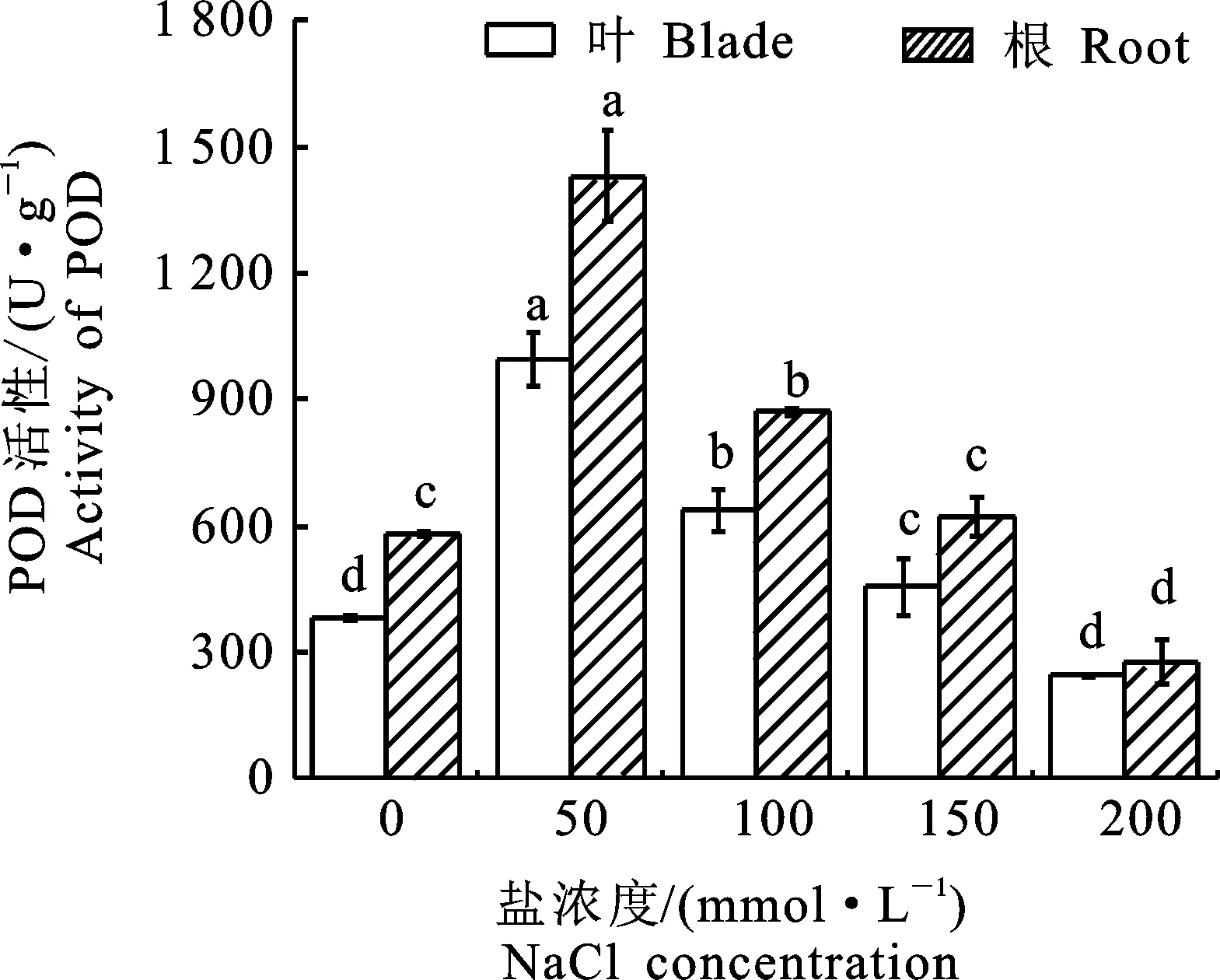
图3 盐胁迫下‘泡桐1201’POD活性Fig.3 POD activity of‘P.1201’ under salt stress
2.5 盐胁迫对‘泡桐1201’幼苗MDA质量摩尔浓度的影响
MDA是植物体组织发生膜脂过氧化后的最终产物,与植物的抗性呈负相关,MDA质量摩尔浓度的多少可以判断在盐胁迫下膜结构受伤害的程度,MDA质量摩尔浓度越多膜结构损害程度越大,进而判断植物的抗逆性差[18]。由图4可以看出,在盐胁迫浓度为0~200 mmol·L-1时,叶片和根部MDA质量摩尔浓度呈现升高趋势。在200 mmol·L-1浓度下,MDA质量摩尔浓度最大达到3.36 μmol·g-1。在盐胁迫浓度为50~100 mmol·L-1时,MDA根部质量摩尔浓度无明显变化,当盐胁迫浓度高于100 mmol·L-1一定范围后,随着盐浓度的增加,MAD质量摩尔浓度也显著增加,MDA质量摩尔浓度较低的植株具有较强的抗性。在盐胁迫浓度为200 mmol·L-1时,MAD质量摩尔浓度最高,说明此时‘泡桐1201’幼苗的膜脂过氧化伤害最严重,受到的迫害最严重。
2.6 盐胁迫对‘泡桐1201’幼苗CAT活性的影响
在植物的生长过程中,CAT发挥着重要作用,该酶是植物体内一种重要的氧化还原酶。主要清除植物通过呼吸作用和光合作用等途径产生的过氧化物,同时CAT主要负责植物叶绿体细胞外的过氧化物,维持活性氧代谢的平衡,保护细胞膜的完整性[19-20]。由图5可知,在50 mmol·L-1盐胁迫浓度下CAT活性变化不明显,但是当盐胁迫浓度达到100 mmol·L-1时,CAT活性升高。在浓度较低的50 mmol·L-1盐胁迫时,植物的抗性能力较强,在植物自身的防御机制内,CAT活性显著升高。但是达到100 mmol·L-1时,盐胁迫对植物造成迫害,产生较多的过氧化物,植物自身的防御机制启动,因此CAT活性升高抵抗盐胁迫对植物产生的有害物质。随着盐浓度的不断升高,超过植物自身的调节机能,过氧化物产生过多,破坏植物细胞体内抗氧化性酶的合成,导致CAT酶活性随之降低。

图4 盐胁迫下‘泡桐1201’MDA质量摩尔浓度Fig.4 MDA mass molality of‘P.1201’ under salt stress

图5 盐胁迫下‘泡桐1201’CAT活性Fig.5 CAT activity of‘P.1201’ under salt stress
2.7 盐胁迫对‘泡桐1201’幼苗根尖离子流速的影响
土壤中高浓度的盐分不利于根系吸收水分,植物组织中的高浓度盐分会导致离子毒。盐胁迫条件下,由于植物吸收了较多的Na+和Cl-,从而降低了对K+、Ca2+和Mg2+的吸收,打破了植物体内动态的离子平衡[21]。进而影响其细胞的生长和光合作用的传递,抑制多种细胞质酶的合成,造成一定程度的单盐毒害。本研究利用非损伤微测技术(NMT),对‘泡桐1201’根系分生区0~600 μm处扫点,正值表示离子外流,负值表示离子内流,测得流速为离子进出植物细胞的净流速值。在距离根尖200 μm和600 μm处离子相对较活跃,所以测定该位点的离子流速。
由图6可知,‘泡桐1201’幼苗Na+均为外排。在盐胁迫浓度为50 mmol·L-1时,与对照组相比,距根尖200 μm和600 μm处Na+的外排速率显著增加,泡桐幼苗根系Na+的排出主要是由质膜逆向转运调控的,Na+/H+逆向转运蛋白活性增加提高Na+的排出。在600 μm处测得离子外排速率普遍高于200 μm处,并且在150 mmol·L-1和200 mmol·L-1处Na+外排速率逐渐减少。
K+流速如图6显示,均为外排,随着盐胁迫浓度的增加,流速显著增大。200 μm和600 μm处K+流速差异不大,试验组流速均大于对照组,并且差异显著。盐胁迫浓度达到200 mmol·L-1时,200 μm和600 μm处K+流速都达到最大,分别为2 277 pmol·cm-2·s-1和2 641 pmol·cm-2·s-1。
H+的流速图显示(图6),对照组在200 μm和600 μm处H+表现为内流,流速为4 pmol·cm-2·s-1和5 pmol·cm-2·s-1。在其他试验组,H+随着盐胁迫的浓度增大内流速率先增加后降低,在100 mmol·L-1盐胁迫处理下最高,200 μm和600 μm处H+内流速率分别为33 pmol·cm-2·s-1和34 pmol·cm-2·s-1。
在200 μm和600 μm处,Ca2+均为内流(图6)。盐胁迫浓度为50 mmol·L-1的试验组与对照组相比,在200 μm和600 μm处Ca2+流速增加差异不显著,当盐胁迫浓度超过50 mmol·L-1时,随着盐胁迫浓度的增加,流速显著增加。在距离根尖200 μm和600 μm处,流速最大值是盐胁迫浓度为200 mmol·L-1,分别达到163 pmol·cm-2·s-1和136 pmol·cm-2·s-1。

图6 盐胁迫下‘泡桐1201’根尖Na+、K+、H+、Ca2+流速Fig.6 Na+,K+,H+ and Ca2+ flux rate in root tip of ‘P.1201’ under salt stress
3 讨 论
本研究结果表明,用0~200 mmol·L-1浓度盐胁迫30 d可以明显抑制‘泡桐1201’幼苗的生长,株高、根长、干质量和鲜质量随盐胁迫浓度的增大而逐渐下降。在50 mmol·L-1盐处理时,‘泡桐1201’幼苗生长指标降低不明显,植物能够正常生长,说明‘泡桐1201’幼苗对低盐胁迫有一定的耐受性。但在盐浓度高于100 mmol·L-1时,株高、主根长、干质量和鲜质量显著降低,表明‘泡桐1201’耐盐能力一般,并且盐胁迫强度越大,干物质量降低幅度越大,与 Qadir等[22]研究结论一致。
植物在盐胁迫的影响下,会通过各种代谢途径和表型的变化去维持生命活动。特别是高盐胁迫使植物细胞内的水势高于细胞外,导致细胞失水,植物细胞内的离子含量升高,引起植物细胞内的叶绿素和光合作用相关的酶解离,导致光合作用下降,影响植物生长发育,影响程度由植物耐盐性决定[23-26]。植物体内在正常生长过程中会通过产生活性氧来维持自由基的产生与消除,防御系统的能力,取决于SOD、POD和CAT等保护酶的相互协调作用达到一个动态平衡[27]。本研究结果表明,‘泡桐1201’幼苗叶绿素质量分数随着盐胁迫浓度的增加而减小;MDA质量摩尔浓度随着盐胁迫浓度增加而增大,并且与前人[28-29]对麻疯树和红树的研究结果一致。SOD、POD 和 CAT 活性都随着盐胁迫浓度的增大呈先增加后降低的趋势,与郭瑞等[30]研究结果一致。并且‘泡桐1201’幼苗 SOD 和 CAT 活性在 100 mmol·L-1时都达到最大值。原因可能是低盐可以诱导SOD和CAT活性增强,抗性氧化酶活性升高,清除过量的氧自由基等活性物质[31-32]。当 盐 胁迫达到 150 mmol·L-1时,SOD、POD 和 CAT 酶活性都显著降低,MDA质量摩尔浓度升高,植物膜脂过氧化作用增强,细胞膜结构被破坏,各种保护酶的活性均下降,植物生长受到抑制[33]。本研究中,POD 活性在盐浓度为50 mmol·L-1时达到最大值,说明POD在‘泡桐1201’幼苗内对盐胁迫浓度较为敏感,耐受阈值低。由此推测,‘泡桐1201’幼苗抗盐胁迫的酶促机制可能是SOD和CAT起主要作用,也可能是由于SOD、POD、CAT三者不能协调一致完成活性氧的清除,导致‘泡桐1201’幼苗抗氧化能力减弱,从而引发一系列活性氧伤害。‘泡桐1201’幼苗在低浓度盐胁迫下能够正常生长,但是随着盐胁迫浓度的增加,生长受到抑制,这与刘雅辉等[34]在蒲公英上的研究结果一致。
Na+能够维持植物的离子平衡,调节细胞的渗透压;H+在生理调节过程中有重要的意义,是生理调节的重要表现,调节pH和电化学梯度。‘泡桐1201’幼苗受到盐胁迫,Na+主要为外排,H+主要表现为内流,Ca2+随着盐胁迫浓度的增加,内流速率显著增大,但是随着盐胁迫的浓度增大K+外排速率增大。Ashraf等[35]研究表明,高等植物质膜上的H+-ATPase水解ATP 产生能量,将H+从细胞质中泵出,从而产生跨质膜的H+电化学势梯度,H+顺着电化学势梯度进入细胞的同时,Na+逆着电化学势梯度被排出细胞,从而保持细胞内较低的Na+含量,以此来维持植物细胞的离子平衡,降低盐胁迫对植物的危害。植物细胞质中的K+/Na+平衡对细胞代谢和抵御盐胁迫都起着重要作用[36]。但是随着盐胁迫浓度的增加,‘泡桐1201’根部细胞的自我调节机制被破坏,更多的Na+被留在根部细胞,过多的Na+导致‘泡桐1201’细胞中Ca2+进入减少,K+/ Na+平衡遭到破坏,离子平衡紊乱,进而对植物产生不可逆的伤害。植物根系积累过多的Na+会产生离子毒害,通过调节细胞内的离子平衡,降低毒害作用,从而增加其抗逆能力[37]。
4 结 论
本研究结果表明,轻度盐胁迫(50 mmol·L-1)下,‘泡桐1201’幼苗各生长指标和绿素质量分数降低不显著,叶片和根部内 SOD、CAT 清除活性氧活力增强,有效抵御盐胁迫伤害,维持植株的正常生长,可作为低盐土壤环境改良树种引种栽培;但随着盐胁迫强度的增加,虽然叶片内渗透调节物质合成被激发,质膜损害严重,稳定性下降,抗氧化酶活性受到抑制,离子稳态干扰加剧,‘泡桐1201’幼苗生长受到抑制,甚至在高盐(200 mmol·L-1)胁迫下出现植株枯萎死亡。综上,‘泡桐1201’幼苗对盐胁迫浓度较敏感,但对低浓度的盐胁迫具有一定的耐受性。
Ding等[38]研究表明,植物SOS1编码质膜 Na+/H+逆向转运体,主要负责盐胁迫下 Na+的主动外排,NHX1编码液泡膜定位的 Na+/H+逆向转运体,可将 Na+运入液泡,形成区隔化,降低胞质中 Na+的浓度,从而达到自我调节防御机制来抵制盐胁迫的危害。关于离子流动力以及所涉及的基因在不同时刻的表达对植物的抗逆性密切相关,在以后的试验里可以开展研究。
