SlSP5G3基因对‘Micro-Tom’番茄开花和产量的影响
2019-04-25许达为邹佳宁王昊天邹志荣
许达为,曹 凯,2,邹佳宁,王昊天,邹志荣
(1.西北农林科技大学 园艺学院,农业部西北设施园艺工程重点实验室,陕西杨凌 712100;2.江苏省农业科学院,农业部长江中下游设施农业工程重点实验室,南京 210014)
开花是植物从营养生长到生殖生长过渡的重要阶段。在被子植物和裸子植物中均发现磷脂酰乙醇胺结合蛋白(phosphatidylethanolamine binding protein,PEBP),它们是一类既能促进开花又能抑制开花的因子,可以分为3个亚家族,分别为FT-like亚家族、TFL1-like亚家族和MFT-like亚家族[1-2]。
FT-like亚家族作为PEBP家族中的重要成员,在控制开花时间、花序发育和产量方面产生重要影响。FT-like蛋白促进植物开花已经在多个物种中得到证实,如杨树(Populusspp)[3]、苹果(Malusdomestica)[4]、甜菜(Betavulgaris)[5]、马铃薯(Solanumtuberosum)[6]、烟草(Nicotianatabacum)[7]和水稻(Oryzasativa)[8]。虽然几乎所有FT-like蛋白都作为开花促进因子起作用,但在甜菜和烟草中,有的促进开花,有的抑制开花。甜菜中BvFT1蛋白在开花中起抑制作用,BvFT2蛋白起促进作用[5]。在烟草的4个FT-like蛋白中,NtFT1、NtFT2和 NtFT3蛋白抑制开花,NtFT4蛋白促进开花[7]。FT-like蛋白还会影响花的发育,番茄SFT基因是拟南芥FT的同源基因,番茄sft突变体只有1~2朵花,且花萼叶片化。番茄中过表达SFT基因,番茄合轴分枝的叶片数从3片降低到2片[9-10]。FT-like蛋白通过参与源库调控改变果实性状和产量指标,在大豆(GlycinemaxL.)中,开花促进因子GmFT和开花抑制因子GmTFL1的相对含量协调了营养生长与生殖生长的关系,从而调控了开花时间和开花后荚果的发育[11-13]。番茄成熟叶片中SFT基因合成的成花素物质,可以通过筛管细胞转运到库器官尤其幼叶中,影响库器官的形成[14]。
目前,在番茄中已鉴定出4个表达的FT-like蛋白分别为SFT、SlSP5G、SlSP5G2和SlSP5G3[15]。其中SlSP5G3蛋白在番茄中与开花和果实产量相关的功能未知,为明确其生物学功能,本试验分析了SlSP5G3在番茄‘Micro-Tom’中的表达规律,并通过转基因分析初步发现SlSP5G3在调控番茄开花和产量方面发挥了重要作用,为揭示FT-like蛋白在调节植物生长发育过程中的作用机制提供了理论依据。
1 材料与方法
1.1 试材样品的获得
试验材料为矮生番茄(SolanumlycopersicumL.)‘Micro-Tom’和SlSP5G3基因过表达株系。试验材料在西北农林科技大学农业部设施工程重点实验室人工气候箱(RDN-1000D-4,宁波东南仪器有限公司)中培养,栽培环境设定为:光照时长12 h,光照强度100 μmol·m-2·s-1,昼夜温度25 ℃/18 ℃,相对湿度60%~70%。取野生型幼苗的根、茎、茎尖、花、子叶和真叶,用液氮速冻保存,用于RNA的提取。
1.2 植株总RNA 的提取及 SlSP5G3基因的表达水平分析
采用RNA试剂盒(Omega公司,中国广州)提取番茄组织总RNA,采用Prime ScriptTMRT reagent Kit with gDNA Eraser(Takara公司,中国大连)完成反转录cDNA的合成。
qRT-PCR采用SYBR○RPremix Ex TaqTMⅡ(Tli RNaseH Plus)(Takara公司,中国大连),qRT-PCR的反应程序为:预变性95 ℃ 30 s;变性95 ℃ 5 s,退火60 ℃ 34 s,共40个循环;融解曲线95 ℃ 5 s,60 ℃ 1 min,冷却40 ℃ 1 s,可以适当地增加循环数,获得融解曲线数据,以番茄Actin基因作为内参[16],重复3次,然后采用公式计算基因的相对表达量。引物(表1)的合成及目的基因测序均由奥科鼎盛生物科技公司(中国杨凌)完成。
1.3 质粒的构建和遗传转化
在番茄基因组数据库(https://solgenomics.net)里找到SlSP5G3(Solyc11g008650)的CDS序列,利用Vector NTI设计引物SlSP5G3-F1、SlSP5G3-R1通过PCR扩增,两端分别加入同源重组序列(图1),以番茄嫩叶的cDNA为模板进行PCR扩增。PCR的反应程序为:95 ℃预变性5 min,95 ℃变性30 s,55 ℃退火30 s,35个循环;72 ℃延伸10 min,4 ℃保存。PCR产物用12 g/L的琼脂糖凝胶电泳并切胶回收目的条带。利用同源重组的方法连接到过表达载体pHellsgate8(泽叶生物科技有限公司,中国上海)中进行测序,测序正确的质粒用于转化农杆菌。
将野生型番茄‘Micro-Tom’种子置于超净工作台上,清水浸泡10 min,用体积分数为75%酒精清洗种子30 s,体积分数为2%次氯酸钠溶液震荡15 min,灭菌水清洗种子2~3次。清洗过的种子接种到培养基中,移入西北农林科技大学园艺学院组织培养室,培养条件为光照时间12 h,昼夜温度为25 ℃/18 ℃,培养7~9 d至2片子叶完全展平后进行目的基因的转化。参照叶志彪等[17]建立的番茄转化体系并略有改动,经过侵染、筛选培养和继代培养、生根培养等过程获得卡那霉素抗性植株。结合抗生素筛选、PCR和实时荧光定量PCR检测阳性苗目的基因表达水平,鉴定过表达植株。
1.4 转基因植株开花时间和上游基因的测定
选取野生型番茄‘Micro-Tom’(WT)和过表达株系(L8、L12)移入光照培养箱培养(培养条件同上),开花后随机选取3株作为一组记录开花所需的叶片数,取平均值。在番茄基因组数据库(https://solgenomics.net)里找到编码FT-like基因上游转录因子基因SlSPCDF1(Solyc03g115940)、SlSPCDF2(Solyc05g007880)、SlSPCDF3(Solyc06g 069760)、SlSPCDF4(Solyc06g069760)、SlSPCDF5(Solyc02g088070)、TCOL1(Solyc02g089540)、TCOL2(Solyc02g895000)和TCOL3(Solyc02g089520)[18-19]的CDS序列,利用Vector NTI设计实时荧光定量PCR引物(表1),操作方法同上。
1.5 转基因植株地上部干鲜质量及产量的测定
在野生型番茄‘Micro-Tom’(WT)和T2代过表达株系(L8、L12)中随机选取5株植株挂牌标记,每株留3穗果打顶。试验结束后将植株地上部分按茎叶分开,采用万分之一天平称量其鲜质量。然后将称量后的茎叶放在烘箱中80 ℃下72 h烘至恒量,采用万分之一天平称量茎叶干质量。果实成熟后,统计每株番茄的果实数量及单果质量,计算单株产量。
1.6 数据处理与分析
用SPSS 20.0数据处理软件对试验数据进行方差分析及显著性检验,用Excel 2010进行数据分析及图表制作。

表1 构建过表达载体、实时荧光定量PCR和阳性苗检验引物序列Table 1 Sequences of primers used in this study for plasmid construction,real-time fluorescent quantitative PCR and positive seedling check

图1 植物超表达载体Phellsgate8示意图Fig.1 Schematic representation of Phellsgate8 regions of 35S∷ SlSP5G3
2 结果与分析
2.1 ‘Micro-Tom’过表达株系中 SlSP5G3的表达量检测
通过根癌农杆菌介导法,将含SlSP5G3基因的过表达载体导入番茄中。CTAB法提取获得的8株再生植株的基因组DNA,通过阳性苗检验引物SlSP5G3-F3、SlSP5G3-R3进行PCR扩增,以不含目的基因的空质粒(pHellsgate8)作为阳性对照,野生型番茄‘Micro-Tom’植株基因组DNA(WT)为阴性对照,结果显示共有4株扩增出长度为222 bp的条带,与目的条带大小一致,即获得4株转基因阳性苗,分别为L3、L8、L12、L14(图2-A)。
进一步确定目的基因的表达水平,通过实时荧光定量PCR分析野生型番茄‘Micro-Tom’和过表达株系L3、L8、L12、L14中SlSP5G3的表达量情况,发现L8和L12的表达量明显高于野生型植株,分别增加了4.625倍和4倍,进而选取L8和L12移入人工气候箱(栽培环境同上)培育T2代转基因植株进行后续的开花产量指标测定。
2.2 SlSP5G3基因的表达规律
在野生型‘Micro-Tom’番茄提取cDNA中利用引物SlSP5G3-F和SlSP5G3-R,进行目的基因SlSP5G3的实时荧光定量PCR检测。在日中性条件下,SlSP5G3的表达量随光照时间变化,在开始光照时上升,在4 h时达到最大,在进入黑暗后4 h达到最低(图3-A),推测SlSP5G3可以感受外界光信号。不同叶龄中SlSP5G3的表达量无明显变化趋势,说明其不受生长发育周期的影响(图3-B)。在番茄植株中,真叶和子叶SlSP5G3表达量最高,茎、茎尖、花和根中基本不表达,说明SlSP5G3的表达具有组织特异性(图3-C)。

A.普通PCR检测转基因植株阳性苗 Detection of positive seedling in stransgenic plant by ordinary PCR;B.实时荧光定量PCR检测SlSP5G3转基因株系表达量 Detection of the expression level ofSlSP5G3in transgenic line by qRT-PCR
图2转基因幼苗的PCR检测
Fig.2PCRfordetectionoftransgenicseedlings

A.SlSP5G3的表达量日变化 The variation of the expression level ofSlSP5G3throughout the day;B.植株由上至下8片叶SlSP5G3的表达量变化 The variation of expression ofSlSP5G3from the top 8 leaves of plants;C.不同器官SlSP5G3的表达量变化 The variation of expression ofSlSP5G3in different tissues
图3SlSP5G3表达量变化规律
Fig.3ThevariationofexpressionofSlSP5G3
2.3 SlSP5G3对开花时间的影响
番茄生长发育中每增长一片叶的时间受环境因素影响较小约为4~6 d,故番茄的开花时间可以由开花前所需叶片数来衡量[20]。将T2代转基因株系(L8、L12)和野生型番茄‘Micro-Tom’(WT)催芽后定植于人工气候箱,栽培环境同上,记录开花所需的叶片数。发现L8和L12开花时间明显晚于WT(图4-A,图4-B)。数据分析L8、L12和WT开花所需叶片数显示,与野生型番茄WT相比,L8和L12开花所需叶片数明显增加,分别为2.34和2.67片。
2.4 SlSP5G3对上游开花相关基因TCOLs和SlCDFs的影响
通过实时荧光定量PCR检测T1代过表达株系(L8、L12)和野生型番茄‘Micro-Tom’(WT)上游TCOLs和SlCDFs的表达情况。L8、L12和WT中,SlCDF2的表达量最高,SlCDF3的表达量最低。相比于WT,过表达L8、L12明显上调了SlCDF3的表达量,分别增加了4.50倍和9.61倍(图5-A);在L8、L12和WT中,TCOL1的表达量最高,TCOL3的表达量最低,但与WT相比,L8和L12并无明显的变化趋势。
2.5 SlSP5G3对番茄地上部生长和产量的影响
SlSP5G3基因过表达对番茄植株地上部形态及产量性状产生了不同程度的影响(表2)。与野生型植株(WT)相比,转基因株系L8和L12叶片鲜质量分别增加98.43%和76.89%;叶片干质量分别增加62.79%和41.86%;果实单果质量分别增加49.65%和36.13%;单株产量分别增加34.50%和26.74%,而茎的干鲜质量和单株果数无明显差异。

图C中a和b表示各处理间差异显著(P<0.05) a and b mean significant difference(P<0.05) in Duncan’s in figure C
A.SlSP5G3过表达植株L8和野生型植株的开花对比图 Flowering comparison ofSlSP5G3over-expressing strain L8 and wild type plants;B.SlSP5G3过表达植株L12和野生型植株的开花对比图 Flowering comparison ofSlSP5G3over-expressing strain L12 and wild type plants;C.SlSP5G3过表达植株和野生型植株的开花所需叶片数 Number of leaves to flowering ofSlSP5G3over-expressing plants and wild type plants
图4SlSP5G3过表达植株和野生型株的开花时间
Fig.4FloweringtimeofSlSP5G3over-expressingplantsandwildtypeplants
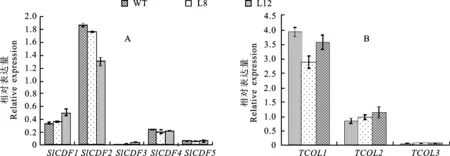
A.SlSP5G3过表达植株和野生型植株对SlCDFs表达量的影响 Effects ofSlSP5G3over-expressing plants and wild type plants on the expression ofSlCDFs;B.SlSP5G3过表达植株和野生型植株对TCOLs表达量的影响 Effects ofSlSP5G3over-expressing plants and wild type plants on the expression ofTCOLs
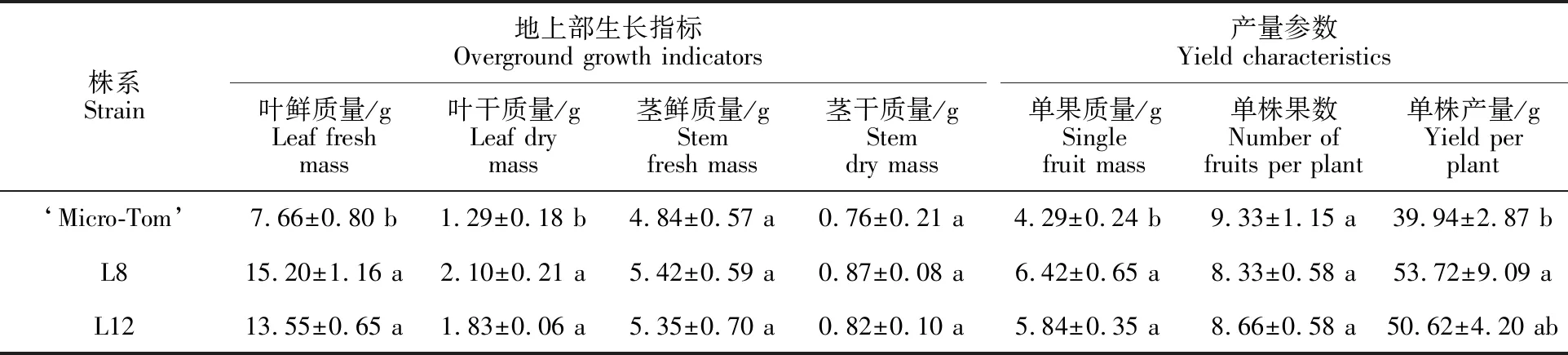
图5 SlSP5G3过表达植株和野生型植株中SlCDFs和TCOLs的表达量Fig.5 The expression of SlCDFs and TCOLs in SlSP5G3 over-expressing plants and wild type plants
注:数据均以“平均值±标准差”表示,同列不同小写字母表示差异显著(P<0.05)。
Note:Data in the table are presented as “mean±standard deviation”,the different lowercase letters in the same column indicates significant difference(P<0.05).
3 讨 论
叶片是植物感受光周期的主要部位,光敏色素作为叶片中感受光信号的最初受体与拟南芥FT基因表达的相互作用已经被证明[21-22]。本研究发现SlSP5G3能够感受光信号,在光照开始后4 h上升至最高,在进入黑暗后4 h下降至最低,可能是由于光敏色素传递了光信号,但其与SlSP5G3的作用关系还需要进一步的验证。SlSP5G3在叶片和子叶中的表达量最高,其他组织基本不表达,且不受发育时期的影响,这与烟草FT-like基因表达一致[7]。
FT-like蛋白的功能很大程度是由其氨基酸序列决定的,曹凯[23]通过蛋白质序列比对发现,在番茄SlSP3D蛋白的3个关键位置的氨基酸残基分别为酪氨酸(133)、甘氨酸(136)和色氨酸(137)与其他的开花活化因子相匹配,如拟南芥中的FT蛋白、甜菜的BvFT2蛋白和烟草的NtFT4蛋白。而番茄SlSP5G的氨基酸序列的这3个保守位点与大多数开花抑制因子是一样的,如烟草中FT蛋白NtFT1、NtFT2、NtFT3。番茄SlSP5G2蛋白和SlSP5G3蛋白在相应位点与其他番茄FT-like蛋白相比都发生了一定改变。本试验通过培育转基因‘Micro-Tom’发现过表达SlSP5G3可以延迟开花,与对照相比平均晚开花 2~3 片叶,可能是由于保守位点的基因突变将其功能转变为抑制开花。拟南芥CDF和COL蛋白是调控FT基因表达的转录因子,番茄存在与拟南芥CDF和COL高度同源的蛋白分别是SlCDF1、SlCDF2、SlCDF3、SlCDF4、SlCDF5、TCOL1、TCOL2和TCOL3。本试验发现在SlSP5G3过表达植株中,3个TCOLs基因和4个SlCDFs基因表达量并无明显变化,但对SlCDF3有显著的促进作用,相比于野生型植株表达量上升5~10倍。笔者推测SlSP5G3基因编码的FT-like蛋白通过筛管细胞到达顶端分生组织与下游转录因子FD结合之后,反馈调节上游SlCDF3基因的表达,具体的作用关系还需进一步验证。
开花时间的早晚受外界因素调控并直接影响植株的产量。如在大豆中,花期的早晚与结荚率之间呈显著的相关性,且大豆产量取决于接荚的花数[24]。低纬度地区种植的大豆明显表现出植株矮小,开花成熟期提前,产量降低。赵薇等[25]研究发现不同春化处理对蚕豆开花和产量产生重要影响,首花时间、鲜荚始收时间最早的蚕豆单株产量最高。赤霉素处理的西红花开花时间提前,导致开花数量和花丝产量明显增加[26]。FT-like基因编码的成花素是控制植物开花时间的重要因子,可以通过改变其表达量进一步调控产量。在番茄sft突变体中,没有形成完整的多花序结构,导致sft突变体植株变大且伴随着极少的花序、花和果实[27]。番茄SP基因调节营养生长向生殖生长的转换。sp突变体植株形成较短的合轴分枝,直到出现2个连续的花序后停止生长[28],与sp突变体植株相比,sp5gsp突变体开花期提前,收获指数上升[29]。本试验发现SlSP5G3基因过表达植株通过延迟开花时间提升了叶片干鲜质量,单果质量和单株产量,与同源基因SlSP5G在控制产量方面存在类似的功能。延迟开花使植物积累更多的营养物质,推迟从营养生长向生殖生长的转变。叶片中积累了更多的营养物质,提升了地上部生物量。同时建立新的源库关系模式,提升总产量,为转基因育种提供新思路。
4 结 论
SlSP5G3受光环境调控,在真叶和子叶中主要表达,且表达量不受生长发育时期的影响;SlSP5G3作为开花抑制因子增加‘Micro-Tom’的开花所需叶片数,延迟开花时间;SlSP5G3促进上游SlCDF3基因的过量表达,提升‘Micro-Tom’番茄的地上部生物量积累、单果质量和单株产量。
