牦犊牛源乳酸菌的筛选鉴定与体外益生特性评价
2019-04-25张学燕聂召龙刘书杰崔占鸿
张学燕,聂召龙,王 通,潘 浩,孙 璐,王 磊,刘书杰,崔占鸿
(青海大学 畜牧兽医科学院,青海省牦牛工程技术研究中心,青海省高原放牧家畜动物营养与饲料科学重点实验室,西宁 810016)
犊牛腹泻病是青藏高原牦牛养殖中的常见疾病,严重影响犊牛的早期培育质量,主要是肠道病原菌和(或)病毒混合感染引起肠道正常菌群结构失衡所致。牦犊牛腹泻最早发生在刚出生时期,发病期主要在2~5月龄,腹泻率为17.57%,致死率为44.91%[1]。高睿等[2]研究表明,引起犊牛腹泻的细菌性病原主要是致病性大肠杆菌、沙门氏菌、金黄色葡萄球菌等;同时,病原菌沙门氏菌和大肠杆菌的耐药性表现也比较严重[3-4]。益生菌是一种能够调节动物胃肠道微生物区系平衡,有利于动物健康发育和提高生产性能的微生物制剂,主要表现为提高动物对营养物质的消化吸收及利用,增强机体免疫功能和抵抗力,促进动物胃肠道生长发育[5-6]。乳酸菌作为一种重要的益生菌,在动物肠道定植生长良好,能产生大量有机酸类物质,可在肠道中形成一层菌膜,有效抵抗病毒和病原微生物的侵袭,增强对疾病的抵抗力[7]。乳酸菌及其代谢产物对沙门氏菌有较强的抑制作用[8],且能有效抑制大肠杆菌[9]和金黄色葡萄球菌的生长[10]。但由于动物种类和生长环境的差异,益生乳酸菌定植于动物胃肠道的细菌种类和数量会有较大差异,且来自同源动物的菌种更有利于在动物体内定植。因此,因地制宜地分离筛选出牦犊牛源益生乳酸菌,对其腹泻病预防和抗生素治疗药物替代研究非常重要,也具有很好的生产应用前景。
1 材料与方法
1.1 菌源样品及培养基
菌源样品来自青海省大通种牛场健康的3月龄牦犊牛6头,屠宰后取胃肠道内容物洋浦冷藏保存,迅速带回实验室进行菌株分离试验;指示菌株选用大肠杆菌、金黄色葡萄球菌和沙门氏菌,由青海省高原放牧家畜动物营养与饲料科学重点实验室提供。MRS液体培养基和MRS固体培养基参照文献[11]配制;MH肉汤培养基配制:2 g牛肉粉,1.5 g可溶性淀粉,17.5 g酸水解酪蛋白,用去离子水定容至1 000 mL,pH 7.2,121 ℃灭菌20 min。
1.2 抑病原菌乳酸菌的分离及纯化
菌株分离纯化:参照文献[11]的方法进行;菌株保存:用灭菌的白色枪头蘸取纯菌株菌落,接种于液体MRS培养基中,37 ℃培养24 h,加甘油在-80 ℃下保存。
1.3 抗病原菌乳酸菌的筛选
①配制含琼脂的液体MH肉汤培养基;② 1×105Pa灭菌20 min;③冷却至50 ℃左右;④每20 mL MH肉汤培养基中加入新培养的指示菌20 μL(108CFU/mL),混匀后倒入培养皿中冷却;⑤用灭菌镊子将牛津杯放入冷却的固体MH肉汤培养皿中;⑥分别吸取200 μL纯菌株培养液和MRS液体培养基加入到牛津杯,每个样品3个重复;⑦4 ℃冰箱放置固定30 min;⑧37 ℃培养箱中培养24 h,筛选出能够同时抑制3种指示病原菌的乳酸菌菌株,编号为XC3、DC8、DC1和A5。
1.4 乳酸菌的分子生物学鉴定
①取对数生长后期的纯菌株2 mL;②常温下,4 000 r/min离心10 min,获得菌体;③用细菌基因组DNA提取试剂盒[Bacterial DNA Kit(50)D3350-01]提取细菌总DNA;④以1 μL纯化的细菌总DNA为模板,用16S rRNA基因通用引物对菌株16S rRNA基因进行PCR扩增,扩增产物送上海生工生物工程股份有限公司测序。
1.5 乳酸菌的 16S rRNA基因序列分析
根据16S rRNA基因的测序结果,登录NCBI网站,使用BLAST对比进行菌种的初步确定。结合GenBank中乳酸菌属中其他菌种的16S rRNA基因序列,应用MEGA 7.0软件,采用Neighbor-joining法构建系统发育树。
1.6 乳酸菌的生长曲线及pH变化
将筛选的乳酸菌菌株培养液按φ=1%接种于液体MRS培养基中,37 ℃培养箱培养48 h,从0 h开始每间隔2 h取出3个离心管(3个平行),24 h后分别于30 h、36 h、48 h各取3个离心管,测定每管OD600nm的吸光光度值和pH。
1.7 乳酸菌的耐酸及耐胆盐特性测定
用1 mol/L盐酸对液体MRS培养基进行调整,使pH分别为2.0、3.0、4.0、4.5、5.0、5.5、6.0和6.4。在不同 pH的液体MRS培养基中按φ= 1%接入乳酸菌XC3、DC8、DC1和A5的培养液,37 ℃培养24 h,测OD600nm值。
在液体 MRS培养基中加入牛胆盐,制成胆盐质量浓度分别为0(对照)、1.5、3和6 g/L的MRS液体培养基。在不同胆盐质量浓度的液体MRS培养基中按10 μL/mL接入乳酸菌XC3、DC8、DC1和A5的培养液,37 ℃培养24 h后,取100 μL进行平板菌落计数。
菌株存活率=a1/a0×100%;a1:处理组24 h 后每毫升活菌数(CFU/ mL),a0:对照组24 h 后每毫升活菌数(CFU/ mL)。
1.8 乳酸菌人工胃肠液耐受性测定
配制A液:16.4 mLφ=9.5%~10.5%的HCl用蒸馏水稀释至pH为3.0;配制B液:500 mL蒸馏水中加入6.8 g KH2PO4,溶解后用4 g/L 的NaOH溶液调pH至6.8,加水稀释至1 000 mL。配制人工胃液:100 mL A溶液中加入1.0 g胃蛋白酶,充分溶解并混匀后用0.2 μm无菌滤膜过滤。配制人工肠液:用100 mL B液体中加入1.0 g胰蛋白酶,充分溶解并混匀后用0.2 μm无菌滤膜过滤。在人工胃液和肠液中按10 μL/mL接入乳酸菌XC3、DC8、DC1和A5的培养液,37 ℃ 140 r/min摇床培养,分别在0、0.5和3 h取样进行平板菌落计数。
1.9 数据处理与分析
所有试验数据先采用Excel 2016进行初步分析,再用SPSS 20.0软件进行方差分析,采用Duncan’s法进行多重比较。
2 结果与分析
2.1 抑病原菌乳酸菌的分离筛选
在相同浓度指示菌条件下,从牦犊牛胃肠道内容物中共筛选出XC3、DC8、DC1和A5 4株同时对大肠杆菌、金黄色葡萄球菌和沙门氏菌具有良好抑制作用的菌株(图1)。
2.2 乳酸菌的 16S rRNA基因序列分析
通过对菌株XC3、DC8、DC1和A5的16S rRNA基因测序,对测得的序列进行Blast比对,结果发现菌株XC3与乳酸片球菌(Pediococcusacidilacticistrain L169(登录号:GU904688.1))相似性为100%;菌株DC8与罗伊氏乳杆菌(Lactobacillusreuteristrain VB4(登录号:JQ073738.1))相似性为99%;菌株DC1与戊糖片球菌(P.pentosaceusstrain F1S2(登录号:KF245540.1))相似性为100%;菌株A5与植物乳杆菌(L.plantarumstrain KC28(登录号:CP026743.1))相似性为100%。将菌株XC3、DC8、DC1和A5的16S rRNA基因序列与GenBank数据库中部分乳酸菌的16S rRNA基因序列进行同源性比较,应用MEGA 7.0软件,采用Neighbor-joining法构建系统发育树(图2)。结果显示,菌株XC3与乳酸片球菌(P.acidilactici)亲缘关系最近,其次是棒状皮炎球菌(P.lolii);菌株DC8与罗伊氏乳杆菌(L.reuteri)亲缘关系最近;菌株DC1与戊糖片球菌(P.pentosaceus)亲缘关系最近;菌株A5与乳杆菌(L.plantarumL. brevis)亲缘关系最近。初步确定菌株XC3为乳酸片球菌,DC8为罗伊氏乳杆菌,DC1为戊糖片球菌,A5为植物乳杆菌。

图1 乳酸菌的抑菌圈直径Fig.1 Determination of bacteriostasis circle diameter of lactic acid bacteria
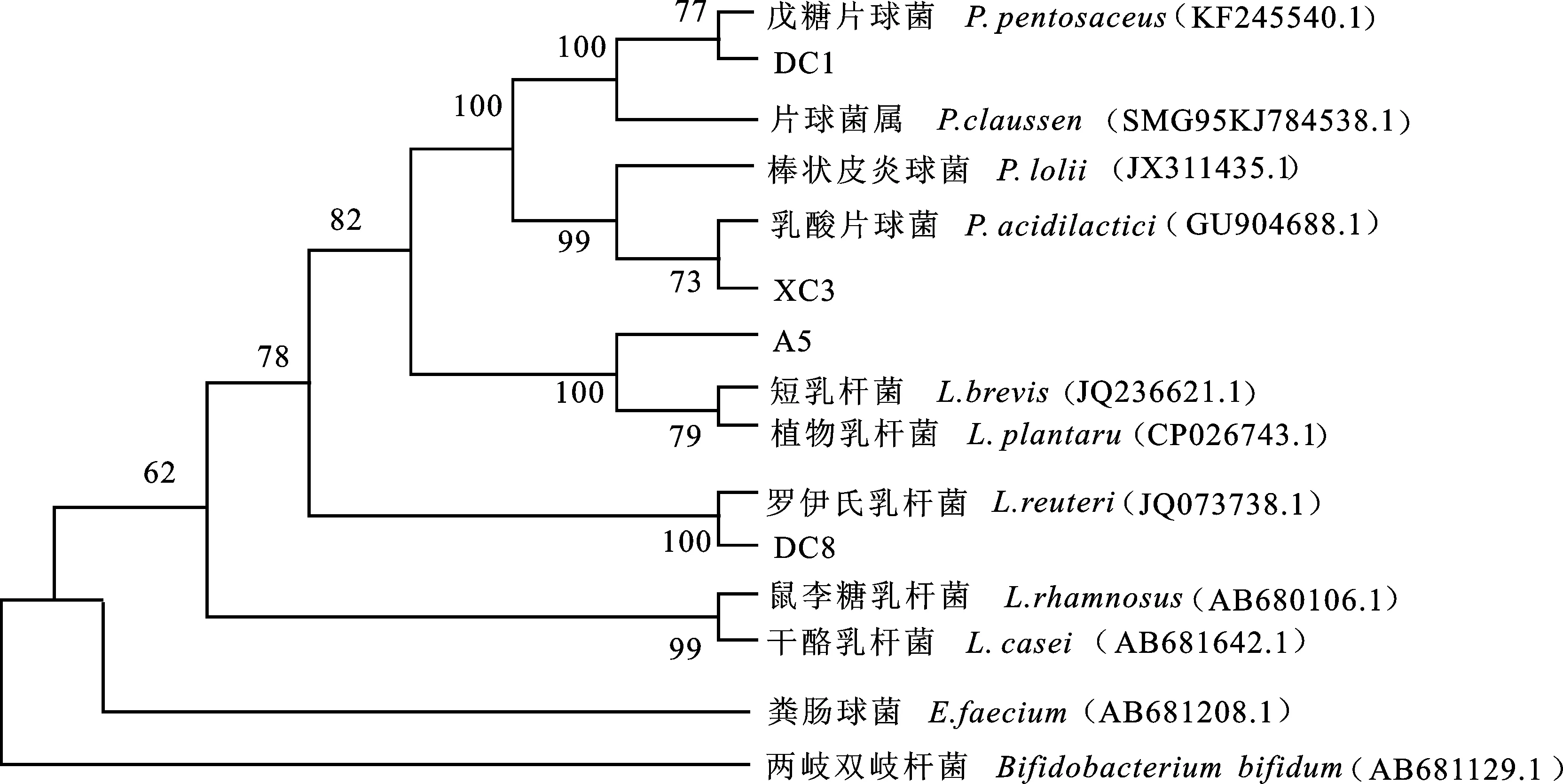
图2 依据 16S rRNA 基因序列构建的系统发育树Fig.2 Phylogenetic trees based on 16S rRNA gene sequences
2.3 乳酸菌的生长曲线及pH变化
在一定范围内,菌株悬浮液中细胞浓度与吸光度呈正相关,因此,一定波长下菌株悬浮液的浓度可用光密度反应。从菌种生长曲线图可以看出(图3),4株乳酸菌的延迟期比较短,在培养2 h后进入对数生长期,乳酸菌DC1、DC8和A5培养6 h后,生长速率下降,乳酸菌XC3培养8 h后,生长速率下降,但是菌株依旧生长缓慢,培养12 h后菌株进入稳定期,培养48 h后菌株未进入衰退期。菌株生长速率与菌株培养液的pH变化规律相一致(图4),即乳酸菌XC3、DC8、DC1和A5在2~12 h快速生长,培养液的pH迅速下降,12 h后pH基本稳定。
2.4 4株乳酸菌的耐酸和耐胆盐特性
从图5可以看出,随着pH的下降,乳酸菌XC3、DC8、DC1和A5的活菌数均不同程度降低,pH=3时,4株乳酸菌的活菌数较高;pH=2时,4株乳酸菌的生长受到严重影响,活菌数明显下降,说明4株乳酸菌对pH=2的酸性环境表现出高度敏感。
由表1可以看出,牛胆盐对乳酸菌XC3、DC8、DC1和A5的生长有抑制作用。随着胆盐质量浓度的增加,对4株乳酸菌的抑制作用也逐渐增强。牛胆盐质量浓度对不同乳酸菌菌株的生长具有不同的抑制作用。乳酸菌菌株在1.5 g/L的牛胆盐培养液中培养24 h后,菌株XC3的耐受性最强,存活率达到98.46%,菌株DC8、A5和DC1的存活率分别为87.30%、86.72%和51.88%;乳酸菌菌株在3 g/L的牛胆盐培养液中培养24 h后,菌株XC3的存活率为93.85%,菌株DC8和A5的存活率降为51.59%和51.18%,菌株DC1受到较强抑制作用,存活率仅为6.77%;培养液中胆盐质量浓度为6 g/L时,4株乳酸菌菌株的生长均受到极强抑制,存活率均低于10%。

图3 4株乳酸菌的生长曲线图Fig.3 The growth curve of four lactic acid bacteria

图4 4株筛选乳酸菌培养液的pH变化Fig.4 Changes of pH in culture medium of four lactic acid bacteria
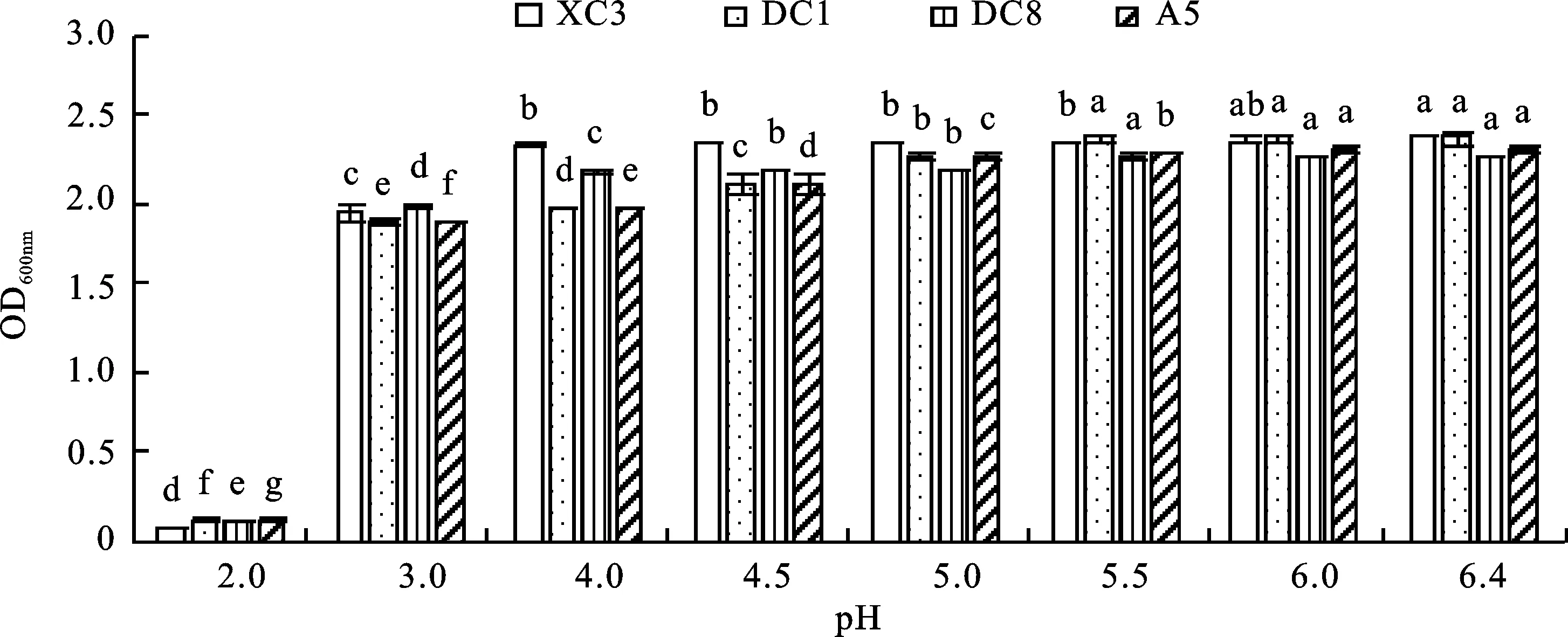
不同小写字母表示差异显著(P<0.05) Different lowercase letters represent significant difference(P<0.05)

表1 4株乳酸菌在不同胆盐质量浓度培养液中培养24 h后的活菌数及存活率Table 1 The viable counts of four lactic acid bacteria in bile salt with different mass concentration after 24 h
2.5 乳酸菌对人工胃液和肠液的耐受性
由表2和表3可以看出,与0 h(对照组)相比较,4种乳酸菌生长均受胃蛋白酶和胰蛋白酶的抑制,处理0.5 和3 h后活菌数均有所下降。但是4种乳酸菌菌株对人工胃液、肠液有一定的耐受性,人工胃液处理0.5 和3 h后,4株乳酸菌的存活率均高于80%,经人工肠液处理0.5 和3 h,存活率均高于70%。
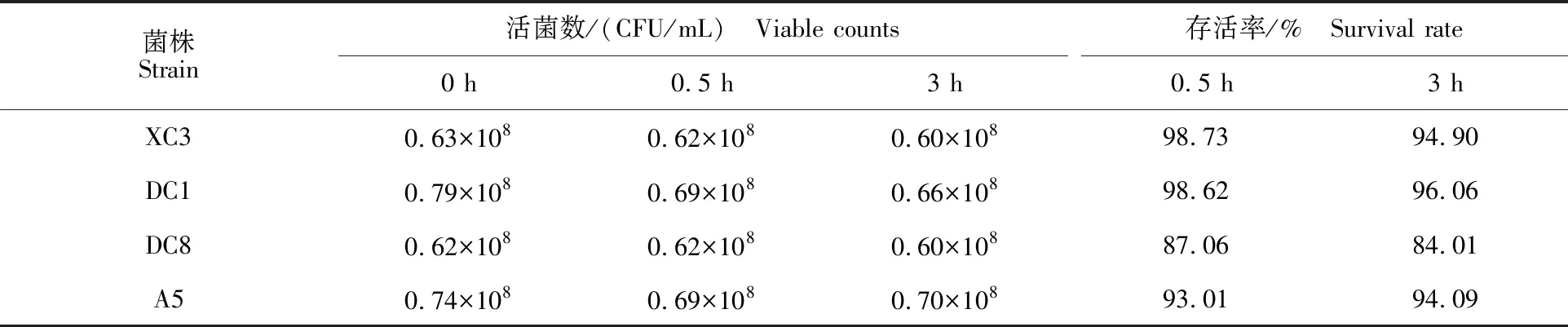
表2 人工胃液处理下4株乳酸菌的活菌数及存活率Table 2 Effect of artificial gastric juice on survivability and survival rate of four lactic acid bacteria

表3 人工肠液处理下4株乳酸菌的活菌数及存活率Table 3 Effect of artificial intestinal juice on survivability and survival rate of Lactic acid bacteria
3 讨 论
细菌性腹泻是新生犊牛的一种常发性疾病,犊牛一旦感染,生长发育受到一定程度的影响,生产性能降低,造成不可忽视的经济损失。大肠杆菌、沙门氏菌、金黄色葡萄球菌等致病菌是引起动物细菌性腹泻的主要病原菌[12]。乳酸菌及其代谢产物产生的酸性内环境,对大肠杆菌和沙门氏菌的生长与繁殖表现出不同程度的抑制作用[13-14]。本研究将筛选菌源定位于同种动物(牦犊牛的胃肠道内容物),通过抗病原菌特性筛选出能够同时抑制大肠杆菌、金黄色葡萄球菌和沙门氏菌的乳酸菌,从而得到适合应用于牦犊牛生产的微生物添加剂菌种。通过16S rRNA基因序列分析与鉴定表明菌株XC3为乳酸片球菌,菌株DC8为罗伊氏乳杆菌,菌株DC1为戊糖片球菌,菌株A5为植物乳杆菌。
微生物在生长过程中,总共经历4个时间段,分别为适应期、对数期、稳定期和衰亡期。测定菌株的生长曲线对于确定合适的培养时间具有重要作用,常将微生物对数中后期和稳定期的菌液作为微生物制剂研究对象。本研究中观察乳酸菌XC3、DC8、DC1和A5的生长曲线发现,4株乳酸菌在液体MRS培养基中培养12 h后进入稳定时期,细菌数较高,稳定性较好,是生产上用于接种的最适合菌龄。发酵液 pH可直观地反映菌株的产酸能力,随着培养时间的增加,乳酸菌XC3、DC8、DC1和A5培养液的pH均不同程度下降,培养12 h后菌液的pH下降速度减慢,基本趋于稳定状态,适合应用于微生物制剂的制备。
目前已有关于体外法筛选益生菌的相关报道[15]。益生菌对瘤胃和肠道内环境的较高耐受性是筛选优良益生菌的重要指标之一[16-17]。乳酸菌pH和胆盐质量浓度的耐受性提高了乳酸菌进入动物肠道的定植能力[18]。酸耐受性是检测乳酸菌益生作用的重要指标,乳酸菌只有耐受胃液的低pH环境,才可能在胃肠道环境中定植,发挥其益生功能[19]。本研究结果表明,乳酸菌XC3、DC8、DC1和A5在pH=2的环境中受到严重影响,活菌数迅速降低,在pH=3的环境,菌株的活菌数较高,说明乳酸菌对低酸的胃内环境有抵御力。胆盐耐受性是检测乳酸菌能否在胃肠道定植,并在肠道发挥益生作用的关键指标[20]。胆盐会使膜蛋白解离,细胞内容物渗漏,导致细胞死亡[21]。乳酸菌需要耐受3 g/L胆盐的肠道内环境才能在肠道中定植[22]。本研究中,胆盐质量浓度为3 g/L时,乳酸菌XC3生长状况良好,乳酸菌DC8和A5的生长受到一定影响,但存活率在50% 以上,说明乳酸菌 XC3、DC8和A5能够耐受肠道内胆盐形成的高渗透压环境。乳酸菌DC1在胆盐质量浓度为3 g/L的环境中生长受到严重影响,存活率仅有6.77%,说明乳酸菌DC1对肠道内的胆盐环境抵御力弱。
胃液中的胃蛋白酶等抗菌物质是抵御乳酸菌进入肠道的第一道天然屏障。本研究利用人工胃液检测各菌株的生长情况,乳酸菌XC3、DC8、DC1和A5在人工胃液中生长3 h 存活率均大于80%,由此推测乳酸菌XC3、DC8、DC1和A5作为益生菌对胃内酸性环境具有较强抵抗力,大部分都可以在胃内存活。同时,益生乳酸菌若要在动物肠道存活及增殖,需要能够耐受胆盐和胰液对菌体的破坏作用[23]。模拟人工肠液试验结果表明,乳酸菌XC3、DC8、DC1和A5在人工肠液中生长3 h存活率均大于70%,说明乳酸菌XC3、DC8、DC1和A5作为益生菌对肠道内环境有较强抵抗力,能够在肠道中成功定植并生长。
4 结 论
以牦犊牛的胃肠道内容物为菌源,分离筛选出对沙门氏菌、金黄色葡萄球菌和大肠杆菌3种致病菌具有较强抑制作用的乳酸菌XC3、DC8、DC1和A5,经16S rRNA基因序列分析鉴定,确定XC3为乳酸片球菌,DC8为罗伊乳杆菌,DC1为戊糖片球菌,A5为植物乳杆菌;通过对筛选乳酸菌的耐酸、耐胆盐,人工胃液和肠液耐受性等体外益生特性研究,确定XC3、DC1和A5具有潜在的益生作用,能作为牦犊牛益生菌制剂的添加对象。
