不对称还原苯丙酮酸的L-乳酸脱氢酶L-LcLDH2的表达及生物信息学分析
2019-04-24李雪晴袁风娇李剑芳邬敏辰
李雪晴, 袁风娇, 刘 艳, 李剑芳, 邬敏辰
(1.江南大学 食品学院,江苏 无锡 214122;2.江南大学 无锡医学院,江苏 无锡 214122)
手性α-羟基酸是合成许多药物、化学材料的重要前体物质[1-2]。例如,苯乳酸(Phenyllacticacid,PLA)又名2-羟基-3苯基丙酸,存在两种对映异构体,D-PLA和L-PLA。D/L-PLA均具有广谱且高效的抑菌活性,是一种新型天然生物防腐剂[3],可作为饲料添加剂替代畜禽饲料的抗菌剂[4-5]。
L-乳酸脱氢酶(L-lactate dehydrogenase,L-LDH,EC 1.1.1.27),是脱氢酶中十分重要且研究较多的一种酶,也是生物体内糖酵解途径中一种关键的氧化还原酶。已有研究发现多种L-LDH可不对称还原苯丙酮酸(phenylpyruvic acid,PPA)生成 PLA,如嗜热脂肪地 芽孢杆菌 (Geobacillus stearothermophilus)的bsLDH[6],副干酪乳杆菌(lactobacillus paracasei)的L-LDH[7]和凝结芽孢杆菌(Bacillus coagulans)NL01的L-nLDH[8]等。但是不同的L-LDH不对称还原PPA的能力存在明显差异,如贾江花等[9]克隆了来源于植物乳杆菌(Lactobacillus plantarum)中的L1-LDH和L2-LDH基因,并在大肠杆菌(Escherichia coli)中实现了表达,重组L1-LDH对PPA的比活性为71.06 U/mg,而重组L2-LDH对PPA的比活性为0.06 U/mg。来源不同的L-LDH对PPA的活性差异更加明显,如王颖[10]等将来源于巨大芽孢杆菌(Bacillus megaterium Z2013513)L-LDH酶基因在E.coli中实现了表达,重组L-LDH粗酶液的酶活性仅为3.4 U/mg。因此,利用分子生物学手段不断挖掘出性状优良的L-LDH,仍然是目前研究发展的趋势。
本研究以干酪乳杆菌 (Lactobacillus casei CICIMB1192)基因组为模板,通过PCR扩增出一种编码 L-乳酸脱氢酶(L-LcLDH2)的基因 Lcldh2,并借助 pET-28a(+)将 Lcldh2 在 E.coli BL21(DE3)中实施异源表达。采用表达L-LcLDH2的E.coli/Lcldh2全细胞催化PPA,测定PLA的产量与对映体纯度。以PPA为底物,测定重组L-LcLDH2粗酶液的酶活性。最后,借助生物信息学软件分析L-LcLDH2的理化性质和功能特性。
1 材料与方法
1.1 材料
1.1.1 质粒、菌株和培养基 克隆质粒pUCm-T购自 Sangon上海公司;表达质粒 pET28a(+)、L.casei CICIMB1192、E.coli JM109 和 E.coli BL21(DE3)由作者所在实验室保藏;MRS培养基:酵母提取物5 g/L、蛋白胨10 g/L、葡萄糖20 g/L、硫酸锰 0.25 g/L、乙酸钠 5 g/L、硫酸镁 0.58 g/L、磷酸氢二钾 2 g/L、柠檬酸二铵2 g/L、吐温80 1 mL,调pH至6.2。LB液(固)体培养基:酵母提取物5 g/L、蛋白胨10 g/L、NaCl 10 g/L、20 g/L 琼脂粉。
1.1.2 主要试剂和仪器 rTaq DNA聚合酶、限制性内切酶、T4 DNA连接酶均购自TaKaRa大连公司;SanPrep柱式DNA胶回收试剂盒、250 bp ladder marker和低相对分子质量protein marker购自Sangon上海公司;PPA购自Sigma-Aldrich美国公司;D/L-PLA和L-PLA购自安耐吉化学上海公司;NADH购自百灵威上海公司;其它试剂均为国产或进口分析纯。液相色谱仪Waters-2695和紫外检测器Waters-2489购自Waters美国公司;液相色谱柱ProntoSIL C18(150 mm×4.6 mm × 0.25 μm)购自德国Bischoff公司,手性液相色谱柱OD-H(250 mm×4.6 mm ×5 μm)购自大赛璐药物手性技术(上海)有限公司。
1.2 方法
1.2.1 引物设计 搜索出NCBI公布的L.casei基因组中的L-LcLDH2氨基酸序列(KTE98134),根据其对应的核苷酸序列,设计一对扩增Lcldh2的特异性PCR引物,委托上海Sangon公司合成。
Ldh-F:5′-CATATGATGGCAAGAACAATTGG T-3′下划线部分为NdeⅠ酶切位点
Ldh-R:5′-CTCGAGCTTCATTTTTTCAAAGGT ATC-3′下划线部分为XhoⅠ酶切位点
1.2.2 L-LcLDH2基因的克隆 挑取L.casei CICIMB1192单菌落于5 mL MRS培养基中,37℃、220 r/min培养过夜,取1.4 mL菌液用于总DNA提取[11]。以此总DNA为模板,Ldh-F和Ldh-R为引物,进行PCR:94℃预变性4 min,30个循环 (94℃ 30 s、53 ℃ 30 s和 72 ℃ 60 s),72℃充分延伸 10 min。将纯化的目的PCR产物与pUCm-T连接获重组质粒pUCm-T-Lcldh2,转化E.coli JM109,蓝白斑筛选和DNA测序。将测序正确的重组质粒经NdeⅠ和XhoⅠ双酶切,割胶回收Lcldh2,与经同样双酶切的pET-28a(+)连接,获重组表达质粒 pET-28a(+)-Lcldh2,转化 E.coli BL21(DE3),DNA 测序验证。
1.2.3 L-LcLDH2的诱导表达 测序正确的转化子命名为 E.coli/Lcldh2,而仅含 pET-28a(+)转化子命名为E.coli/pET-28a。分别挑取E.coli/Lcldh2和E.coli/pET-28a单菌落接种于2 mL含100 μg/mL卡那霉素的LB培养基中,37℃、220 r/min过夜培养。以2 g/dL的接种量转接于新鲜的100mL LB培养基中,37℃培养至OD600nm约为0.6~0.8时,加入终浓度为0.4 mmol/L的IPTG溶液,16℃诱导10 h。8 000 r/min、5 min离心收集菌体,经磷酸钠盐缓冲液(Na2HPO4/NaH2PO4、100 mmol/L、pH 7.0)洗涤 2 次后制备含100 mg/mL湿细胞的菌悬液,用于SDS-PAGE电泳分析及后续研究。另取一定量含50 mg/mL湿细胞的菌悬液,超声破碎后,4℃,12 000 r/min,离心10 min后取上清液即为粗酶液。采用Bradford法[12]测定蛋白质含量。
1.2.4 L-LcLDH2酶活性的测定 L-LcLDH2的酶活性测定方法:总反应体系包括50 mmol/L乙酸钠缓冲液(pH 5.5),0.2 mmol/L NADH,5 mmol/L PPA,对照组中不含NADH,其他成分相同。混匀后于30℃保温5min,加入适量的酶液。检测NADH在340nm处吸收值的变化。酶活力单位(U)定义为:在上述条件下,每分钟催化氧化1 μmol NADH所需要的酶量。比活性定义为每毫克酶蛋白所含的酶活单位数(U/mg)。
1.2.5 全细胞转化PPA生成PLA 于1 mL离心管中加入300 μL菌悬液和250 μL磷酸钠缓冲液(pH 7.0),37 ℃保温 5 min,再依次加入 50 μL 葡萄糖(终浓度 50 mmol/L)和 400 μL PPA(终浓度 10 mmol/L),反应1 h后,取200 μL反应液加入800 μL甲醇终止反应,过0.22 μm有机滤膜。按照方法1.2.6进行HPLC分析;另取200 μL反应液,用1 mL乙酸乙酯进行萃取,上层有机相经无水硫酸钠干燥后过0.22 μm有机滤膜,按照方法1.2.6进行对映选择性分析。
1.2.6 HPLC分析PPA和PLA 采用反相HPLC分析PPA及PLA,色谱柱为ProntoSILC18(150 mm×4.6 mm×0.25 μm),分析条件:流动相为体积分数0.05%三氟乙酸/水 (A)和体积分数0.05% 三氟乙酸/甲醇(B)混合液,梯度洗脱程序为(体积分数):0~15 min 20%~65%B;15~16 min 65%~100%B;16~19 min保持 100%B,紫外检测器,柱温 30℃,流速1 mL/min。检测波长为210 nm,PPA和PLA的保留时间依次为11.372 min,12.858 min。
采用正相HPLC进行手性分析[13],色谱柱为Daicel OD-H(250 mm×4.6 mm×5 μm),分析条件:流动相为正己烷/异丙醇/三氟乙酸(98∶2∶0.05,体积比),紫外检测器,柱温30℃,流速1mL/min,检测波长为210 nm,D-PLA和L-PLA的保留时间依次为33.896 min,35.806 min。依据峰面积计算L-PLA的eep=[LPLA-D-PLA/(L-PLA+D-PLA)]× 100%。
1.2.7 L-LcLDH2的生物信息学分析 运用表1列出的软件和程序分析L-LcLDH2的理化性质和功能特性。

表1 序列分析工具Table 1 Tools applied for sequence analysis
2 结果与分析
2.1 L-LcLDH2编码基因Lcldh2的克隆
以L.casei基因组为模板,按1.2.2方法进行PCR扩增及琼脂糖凝胶电泳分析。结果在1 000 bp下方出现一特异性条带,大小与预期基本相符(见图1)。将其克隆至pUCm-T获重组质粒pUCm-TLcldh2。DNA测序结果显示,Lcldh2开放阅读框长906 bp,编码301个氨基酸。Lcldh2与模板的同源性为99.45%,Lcldh2的核苷酸序列中第181位由模板对应的G变为A,其氨基酸序列中第61位点的氨基酸残基由模板对应的Val变为Ile。
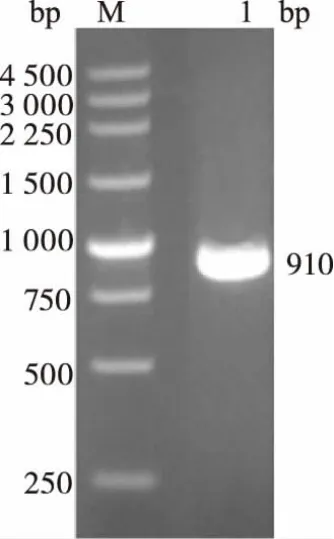
图1 Lcldh2的PCR扩增Fig.1 PCR amplification of Lcldh2
2.2 L-LcLDH2的诱导表达
按1.2.4方法将E.coli/pET-28a和E.coli/Lcldh2进行了诱导表达。SDS-PAGE结果显示,诱导的E.coli/Lcldh2全细胞约在相对分子质量33.5×103(表观相对分子量)处有一明显的特异性蛋白质条带(图2,泳道2),而E.coli/pET-28a在此处无特异性蛋白质条带(图2,泳道1),表明Lcldh2在E.coli BL21(DE3)中成功实现了异源表达。表达产物L-LcLDH2的粗酶液催化PPA的酶活性为47 U/mg,显著高于来源于Bacillus megaterium Z2013513的重组 L-LDH 的酶活性(3.4 U/mg)[10]。
2.3 全细胞催化PPA生成L-PLA
按照1.2.6方法,测定了E.coli/Lcldh2和E.coli/pET-28a全细胞在1 h催化10 mmol/L PPA后生成PLA的浓度。在37℃、220 r/min条件下,10 mmol/L PPA经30 mg/mL E.coli/Lcldh2全细胞转化1 h后,生成3.5 mmol/L的PLA,底物摩尔转化率为35%,而不含Lcldh2的E.coli/pET-28a催化PPA生成PLA的浓度仅为0.07 mmol/L,即含Lcldh2的重组菌转化PPA生成PLA的量比宿主菌提高了49倍。产物的手性分析结果显示,L-PLA的eep>99%,表明L-LcLDH2具有很高的对映选择性。

图2 重组E.coli全细胞的SDS-PAGE分析Fig.2 SDS-PAGE analysis ofthe whole cellof recombinant E.coli
另外,反相液相检测结果分析表明,全细胞催化PPA生成L-PLA的同时产生了一定量的副产物,经质谱检测确定该副产物为苯丙氨酸(Phenylalanine,Phe)。 微生物代谢途径中 Phe可在转氨酶的作用下转化为PPA,该反应为可逆反应。因此在E.coli/Lcldh2全细胞催化PPA生成PLA的反应中,E.coli自身携有的转氨酶可转化少量的PPA生成Phe。
2.4 L-LcLDH2的生物信息学分析
2.4.1 L-LcLDH2的一级结构分析 按照1.2.7方法预测了L-LcLDH2的理化特性和功能特性,结果显示,L-LcLDH2的分子式为C1451H2296N388O447S8,理论相对分子质量为32 585,理论等电点为5.5,平均亲水系数为-0.117,表现出强亲水性,不稳定指数为11.87,是一种稳定蛋白质,位于细胞质,无信号肽和跨膜区域,由此推测L-LcLDH2是一种非分泌型、非跨膜蛋白,保留在细胞质中,直接参与物质代谢。
运用ClustalW2和ESPript 3.0对L-LcLDH2与4种不同的L-LDH进行了多序列比对及保守序列和催化活性位点的分析(图3)。L-LcLDH2与L.rhamnosus L-LDH,L.perolens L-HicLDH,L.composti L-HicLDH,L.confuses L-HicLDH的同源性分别为92%、64%、53%、43%。如图3所示,L-LcLDH2存在典型的NAD+结合位点序列(GXGXXG,X-任意氨基酸)。L-LcLDH2的底物识别位点为Thr223,催化活性位点为 Arg89、Asp148、Arg151和 His176。 另外,Asp34是NAD+结构域中决定L-LDH的辅酶为NADH而不是NADPH的关键氨基酸,因此,L-LcLDH2是一种 NADH依赖型L-LDH。

图3 L-LcLDH2与其他来源的L-LDHs的多序列比对和保守区域分析Fig.3 Alignment of multiple sequences and analysis of conserved motifs of L-LcLDH2 with other L-LDHs
2.4.2 L-LcLDH2的二级结构预测和三维结构的同源建模 运用SOPMA预测L-LcLDH2的二级结构显示,L-LcLDH2含有 40.2%的 α-螺旋,19.93%的延伸链,7.97%的β-转角和31.89%的无规则卷曲。运用SWISS-MODEL和PyMOL对L-LcLDH2的三维结构进行了同源建模和分析(图3)。在蛋白质数据库中搜索出了与L-LcLDH2同源性为43%的来源于融合乳杆菌(L.confuses)的L-2-羟异己酸脱氢酶(L-2-Hydroxyisocaproate Dehydrogenase,L-HicDH,PDB:1HYH)晶体结构。基于L-HicDH结构与功能的研究[14],推测L-LcLDH2由α螺旋和β折叠形成的NAD结合结构域和催化结构域所构成。NAD结合结构域主要由6个β折叠和5个α螺旋组成,而催化结构域主要由6个β折叠和4个α螺旋组成。已有研究表明[15],L-LcLDH2的催化活性位点高度保守,活性中心由 Arg89、Asp148、Arg151和 His176组成。当α-羰基酸与酶结合时,Arg151的胍基结合到底物的羧基形成一个稳定的盐桥[16],Arg89的胍基和His176的咪唑基共同与底物的α-羰基结合,其中His176提供质子,而Asp148稳定去质子化的His176,这些位点共同催化α-羰基酸上的α-羰基还原成羟基生成α-羟基酸[6]。
3 结 语
L-LDH在生物催化过程中具有重要的应用价值,通过基因工程实现L-LDH异源高效表达是降低其工业应用成本、适应工业应用的有效手段[17]。本研究从L.casei CICIMB1192基因组中成功克隆了一种编码L-LcLDH2的基因Lcldh2并实现了该基因在 E.coli BL21(DE3)中的异源表达,L-LcLDH2 的催化活性位点为 Arg89、Asp148、Arg151和 His176,具有典型NAD+结合位点序列,是一种NAD依赖型LLDH。采用E.coli/Lcldh2全细胞不对称还原PPA,可生成高光学纯度L-PLA。本研究为生物催化法制备手性L-PLA提供了新的工具酶,也为进一步利用该酶生产L-PLA提供了理论支持。
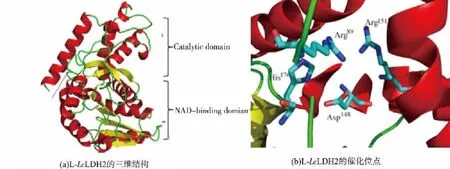
图4 L-LcLDH2的三维结构和催化活性位点Fig.4 Three-dimensional structure and catalytic sitesof L-LcLDH2
