menA过表达菌株构建及两阶段pH控制促进VK2合成
2019-04-24杨自名薛正莲杨超英胡刘秀程良成丁秀敏
刘 艳, 杨自名, 薛正莲, 杨超英, 胡刘秀, 程良成,王 洲, 丁秀敏
(1.安徽工程大学 生物与化学工程学院,安徽 芜湖241000;2.芜湖张恒春药业有限公司,安徽 芜湖241009)
维生素K2(MK,VK2)是一类重要的甲萘醌系列脂溶性维生素,在医药和食品领域都有重要应用。健康人群适量补充富含维生素K2食品,可有效减少骨折发病率[1]。研究发现,日本儿童没有其它国家儿童普遍存在的生长痛,是因为从小吃纳豆,而纳豆中富含维生素K2,导致儿童的骨密度高、骨骼强壮。另外,对于不足6个月大的婴儿来说,维生素K缺乏引起的婴儿出血疾病是一个非常严重的世界性问题[2]。并且,近几年国内外学者在Science和Nature等顶级国际期刊发表的研究报道都表明,同辅酶Q相似,维生素K2作为一种膜结合电子载体,具有修复损伤细胞线粒体的功能[3-5],这对于人类免受帕金森症折磨起着重要的作用。基于这3方面的应用,国际市场对功能性食品维生素K2的需求量近年来不断增长。
由于化学法合成维生素K2存在安全问题,在欧盟和部分亚洲国家被限制不能直接将其用于食品中;此外,微生物发酵合成维生素K2,因具有反应条件温和、发酵原料价格低廉、环境污染小,同时因为原料来源于生物,合成的产品具有高生物活性和高生物相容性等优点,成为维生素K2合成的首选方法。国内外用于合成维生素K2的菌株主要有黄杆菌和纳豆芽孢杆菌,分别生产在C3位侧链上带有4个和7个异戊二烯单位的维生素K2同系物 (MK-4和MK-7)[6-18]。MK-7在人体血液中具有较长的半衰期[19],并且纳豆芽孢杆菌来源于食品,因此利用纳豆芽孢杆菌发酵获得的维生素K2更有市场前景。
随着分子生物学技术的快速发展和基因组测序技术的进步,菌体内维生素K2的基础代谢研究也在不断被推进和深入。维生素K2的化学结构式为2-甲基-3-烯基-1,4-萘醌,分别由主链 1,4-二羟基-2-萘甲酸(DHNA)和侧链聚异戊二烯组成(图 1(a))。1982年Bentley和Meganathan详细综述了维生素K2在细菌体内生物合成途径中的代谢中间物、关键酶以及催化反应机理,提出维生素K2中主链底物萘醌骨架主要通过莽草酸途径(图1(b)),由men系列基因编码的酶系催化合成[20];乙酰CoA进入甲羟戊酸途径形成侧链底物聚异戊二烯焦磷酸(OPP)。作为桥连主链和侧链底物合成维生素K2的酶,过量表达1,4-二羟基-2-萘甲酸-聚异戊二烯转移酶(MenA)对于促进维生素K2在菌体内的代谢合成具有十分显著的效果[21-22]。然而,目前的研究还只限于大肠杆菌和解淀粉芽孢杆菌,并且也尚未见有对menA基因过表达菌株进行深入地发酵过程调控方面的研究。

图1 维生素K2化学结构式及代谢合成途径Fig.1 Structure formula of vitamin K2and its metabolic pathway
作者考察了纳豆芽孢杆菌menA基因过表达对维生素K2合成能力的影响,检测并分析恒定pH对分批发酵培养过程中维生素K2合成动力学参数,并在此基础上提出两阶段pH控制策略,为维生素K2的大规模生产提供了理论参考。
1 材料与方法
1.1 材料
1.1.1 实验菌株与质粒 纳豆芽孢杆菌为本实验室诱变获得。大肠杆菌BH5α,质粒pHY-P43保藏于本实验室。
1.1.2 培养基 斜面培养基(g/L):牛肉膏3,蛋白胨 10,NaCl 5,琼脂粉 20;pH 7.0~7.2。
种子培养基(g/L):甘油 10,蛋白胨 10,NaCl 5;pH 7.2~7.4。
发酵培养基(g/L):甘油 10.5,K2HPO4 0.4,蛋白胨 20,酵母提取物 25;pH7.0。
1.2 实验方法
1.2.1 培养条件 种子培养:按照108个/mL的接种量吸取菌体溶液于100 mL种子培养基中,37℃,200 r/min摇床培养36 h。
摇瓶发酵培养:将5 mL种子液接入含100 mL发酵培养基的500 mL三角瓶中,37°C,200 r/min摇床培养80 h。
5 L发酵罐小试发酵:种子液培养24 h后以10%体积分数的接种量倒入发酵罐中,装液量为2 L,控制通气量为1.0~2.0 vvm,200 r/min 37°C下发酵80 h。每间隔8 h测定发酵过程中各项生化指标,包括培养基中残余甘油量、菌体生物量、pH变化和维生素K2含量等。
1.2.2 menA过表达菌株的构建 以纳豆芽孢杆菌全基因组为模板,PCR扩增得到menA基因片段,设计引物序列如下:

扩增得到的PCR产物与质粒pHY-P43连接,得到重组质粒pHY-P43/menA。酶切连接后获得含有menA基因的重组表达质粒。参照经典的芽孢杆菌转化法(即spizizen转化法)[23],上述构建好的重组质粒经酶切验证正确后,转化到B.subtilis natto菌株中,挑取阳性克隆。
1.3 分析方法
1.3.1 生物量测定 取一定量发酵液于8 000 r/min下离心10 min,下层沉淀用水洗涤2~3次,105°C烘至恒重后称重。
1.3.2 甘油含量的测定[24]不同比色管中分别放置不同浓度的甘油标准品溶液各1 mL,然后分别加入1 mL 0.015 mol/L高碘酸钠溶液,混匀后室温放置10 min,然后加入2 mL 0.1 g/dL L-鼠李糖溶液,再分别加入4 mL Nash试剂,53°C水浴中加热15 min后于412 nm处测其吸光度。以甘油不同浓度为横坐标,吸光值OD为纵坐标,作甘油浓度对OD的标准曲线。8 000 r/min离心发酵后的培养基5 min,上清液稀释至适当的浓度,按照甘油标品检测方法,利用标准曲线计算发酵液中甘油的含量。
1.3.3 维生素K2提取及检测 吸取10 mL纳豆芽孢杆菌发酵液,并加入异丙醇和正己烷的混合液(1∶2∶4,体积比),摇床220 r/min震荡30 min后静置分层,取上清液旋蒸,记录产物的质量并用异丙醇将其洗出,定容到10 mL的棕色容量瓶中。高效液相色谱进行维生素K2的定量检测。液相色谱工作条件[14]:色谱柱:Brava-BDS C18(250 mm×4.6 mm,5 μm)柱;流动相:甲醇∶二氯甲烷=9∶1;流速:1.0 mL/min;进样量:20 μL;检测波长:248 nm。
1.3.4 动力学参数计算 利用Origin软件对菌体生长、产物合成数据进行插值计算(时间步长为0.1 h),拟合得到不同pH下比生长速率μ、维生素K2比合成速率q、菌体得率系数Yx/s、以菌体细胞为基准的产物得率系数YP/x、生物量生成速率Qx、产物比生成速率QP。计算公式分别为:

其中,x为菌体质量浓度 (g/L);p为维生素K2质量浓度(mg/L);s为发酵液中残留甘油质量浓度(g/L);t为时间(h)。
2 结果与分析
2.1 menA过表达菌株的构建及验证
以提取得到的纳豆芽孢杆菌全基因组 (图2(a))为模板,通过PCR扩增获得menA片段(图2(b)),与pHY-P43质粒连接,得到重组质粒pHY-P43/menA。重组质粒转入纳豆芽孢杆菌后,挑取阳性克隆并提取其中的重组质粒,KpnI和EcoRI双酶切,酶切后电泳图如图2(c)。重组质粒的单酶切产物约6 000 bp,双酶切产物中大片段与pHY-P43质粒的双酶切产物碱基对数相近,在5 100 bp左右;小片段约885 bp,与menA基因碱基对数相仿。由此我们认为pHYP43-menA重组质粒构建成功。重组质粒pHYP43-menA经上海生工测序,测序报告中menA序列与NCBI数据库中menA基因序列比对结果100%相同,再次验证了menA基因在构建过程中没有发生突变。Western blot验证带有空载体纳豆芽孢杆菌、原始菌以及含pHY-P43-menA重组质粒菌株中MenA蛋白表达情况,从图2(d)中可以清晰看出含pHY-P43-menA重组质粒菌株中MenA表达量明显高于原始菌和只转入空载体的纳豆芽孢杆菌。含氨苄青霉素抗性的LB培养基平板上筛选含pHY-P43-menA重组质粒的阳性菌株,划线转接3次阳性单菌落,均能提取得到重组质粒pHY-P43-menA,说明该菌株可用于下一步发酵。

图2 基因组DNA、PCR产物、双酶切产物电泳图以及western blot检测结果Fig.2 The electrophoresis results of genomic DNA,PCR product,restriction enzyme digestion and result of western blot.
2.2 纳豆芽孢杆菌产维生素K2分批发酵过程
通过5 L发酵罐小试,原始菌和menA基因过表达菌株均于8 h进入对数生长期迅速生长,40 h时进行稳定生长期(图3)。2株菌均在40 h开始在体内大量累积维生素K2,72 h左右其质量浓度趋于稳定。说明该次级代谢物与其结构类似物辅酶Q10相似,不属于生长耦联型[25]。menA过表达菌株在合成维生素K2的过程中,菌体生成、底物(甘油)消耗、产物(维生素K2)合成均与原始菌呈现相似的趋势,说明menA基因的过量表达并没有对菌体生理特性造成影响。虽然menA基因过表达菌株的生物量与较原始菌相比略有下降((6.84±0.28) g/L vs(7.86±0.31) g/L),但维生素K2合成量却是原始菌的1.51倍((38.07±1.81) mg/L vs (25.21±0.81) mg/L),说明 menA 的过量表达对提高纳豆芽孢杆菌体内侧链底物DPP与主链底物1,4-二羟基-2-萘甲酸(DHNA)结合能力,促进维生素K2的代谢合成具有非常重要的意义。Kong等同样发现menA过表达能将大肠杆菌合成维生素K2的能力提高2倍,远远高于单独过表达men家族的其它基因[22]。并且,作者前期的研究发现在黄杆菌中4-羟苯甲酸-聚异戊二烯转移酶(UbiA)某些氨基酸位点的突变会导致MenA蛋白表达量的增加,而MenA蛋白表达量的增加最终能提高维生素K2的合成量[26]。因此,接下来我们针对menA过表达菌株,对其发酵过程进行研究,以期进一步提高维生素K2的产量。
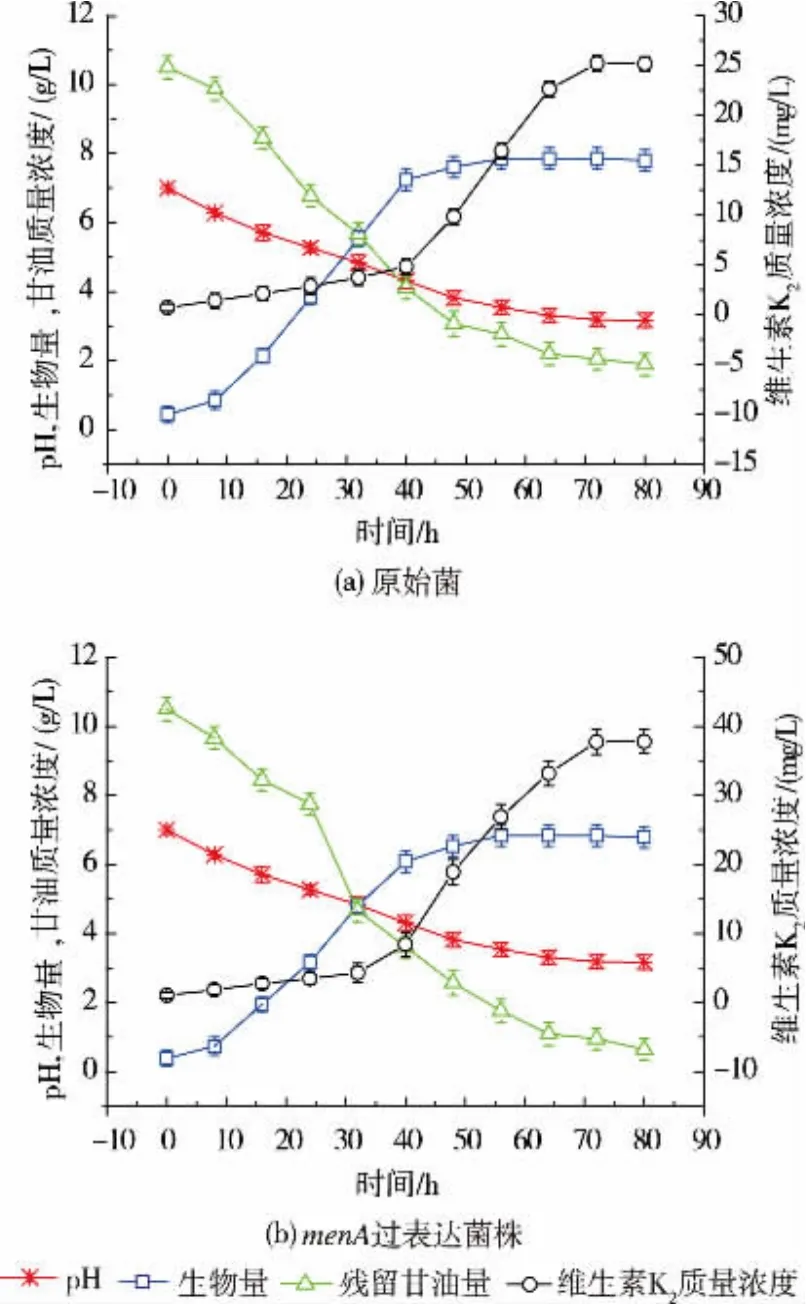
图3 原始菌和menA过表达菌株产维生素K2分批发酵过程曲线Fig.3 Batch fermentation time course of vitamin K2 production by original and menA over-expression strain of Bacillus subtilis natto
2.3 不同pH下过表达菌产维生素K2发酵过程曲线及动力学参数比较
整个发酵过程中培养基pH值在持续下降,而菌体生长和次级代谢产物生成的最适pH值往往不同,见图 3(a)和 3(b)。 因此,作者考察了在分批发酵过程中恒定发酵液的pH,分别恒定为3.0、4.0、5.0、6.0、7.0,得到的发酵过程曲线见图4。可以看出,不同pH下menA基因过表达菌株与原始菌在菌体生长与维生素K2合成曲线上的趋势基本对应相同。在pH为7.0时生物量相对较高,为(8.91±0.31)g/L。pH为6.0时次之,并且生物量随着pH值的下降,也在不断降低。说明培养基的酸性越大越不利于菌体生长。然而,与生物量的变化趋势不同,维生素K2合成量随着pH值的不断下降,呈现出先上升后下降的趋势。维生素K2合成量最高值(30.23±0.44)mg/L出现在pH值为4.0时。也就是说,虽然pH 4.0不能保证最大的菌体生成量,但最有利于维生素K2合成。由于是胞内产物,而相对较少的生物量也限制了维生素K2的大量合成。这说明单一pH不能同时保证最大菌体生长和次级代谢产物得率。


图4 不同恒定pH条件下维生素K2发酵过程曲线Fig.4 Time courses of vitamin K2production by Bacillus subtilis natto at various pH value

图5 不同恒定pH值下纳豆芽孢杆菌产维生素K2的动力学参数比较Fig.5 Comparison of kinetic parameters in vitamin K2 production by Bacillus subtilis natto at various constant pH value
图5和表1列出了pH为3.0~7.0时的发酵过程动力学参数。通过比较可以发现,比生长速率μ和维生素K2比合成速率q在不同pH下的变化趋势相似。不同pH下μ都在发酵前期(24 h)达到最大值,而q的最大值出现在发酵后期(48 h)。原因可能是发酵前期主要用于合成菌体和初级代谢产物,当二者达到一定值后,菌体以前期积累的初级代谢产物为前体,启动合成次级代谢物。与其它pH值相比,当 pH 为 7.0 时,μmax(0.129 h-1)最高。生物量生成速率Qx同样在pH为7.0时数值最高,为0.11 g/L·h。菌体进入稳定期的时间为40 h,说明在发酵前期(40 h)控制pH在7.0有利于菌体充分生长。相较于pH7.0,pH为4.0时菌体的比生长速率μmax和生物量生成速率Qx均较低,分别为0.079 h-1和0.05 g/L·h,但是q在整个发酵过程中都较高,且增加幅度随着时间的延长,也在逐渐增大,增幅明显高于其它pH下的对应值,在48 h达到最大值0.222 mg/g·h。这说明pH为4.0虽然不利于菌体生长,但却促进了维生素K2的生成。以上结果表明,发酵过程中设定单一pH,不能使菌体生长和产物合成都能达到最理想状态。
2.4 两阶段pH控制策略强化纳豆芽孢杆菌发酵产维生素K2
为保证菌体在充分生长的同时提高维生素K2合成量,从上述分析中提出一种两阶段pH控制策略:在发酵前期0~40 h控制pH 7.0,在发酵后期40~80 h控制pH恒定为4.0进行分批发酵。由图6和表2可知,在发酵前期菌体生长速率较pH自然状态下明显提高,最大生物量达到了(11.46±0.67)g/L,比menA过表达菌pH自然状态下的最大生物量提高了67.54%,比原始菌提高了45.80%。值得一提的是,当经过过表达menA基因,并采用了两阶段pH控制后,维生素K2的产量有了大幅度提高,分别是原始菌和过表达菌自然状态下的2.6和1.7倍。说明在此策控制策略下,不仅提高了菌体生物量,还提高了维生素K2产量,为大规模生产维生素K2提供了基础条件。李珊等[27]发现两阶段pH控制对于哈茨木霉合成β-1,3-葡聚糖内切酶同样具有非常明显的促进作用,说明该策略在提高特定发酵产品总体产量方面具有一定的适用性。

表1 不同pH下维生素K2分批发酵过程动力学参数比较Table 1 Comparison of fermentation kinetic parameters at various pH value
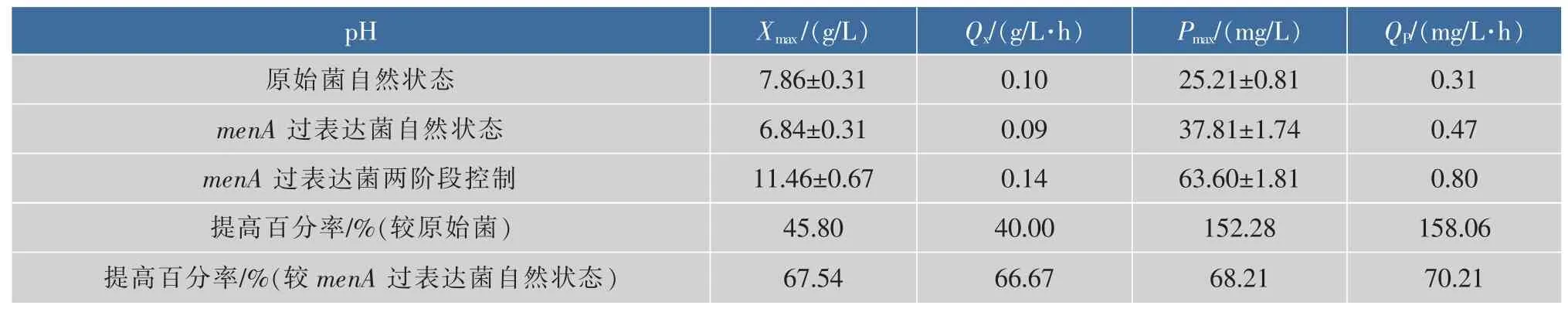
表2 不同发酵过程下维生素K2发酵动力学参数比较Table 2 Comparison of fermentation kinetic parameters at various fermentation process

图6 两阶段pH控制Bacillus subtilis natto产维生素K2 Fig.6 Time course of vitamin K2production by Bacillussubtilis natto using two-stage pH control strategy
3 结 语
过量表达menA基因能使Bacillus subtilis natto维生素K2合成量提高51%。发酵过程中最适菌体生长和维生素K2合成pH分别为7.0和4.0。作者采用两阶段pH控制策略,将发酵前期0~40 h的pH控制为7.0,确保得到能充分合成维生素K2的菌体量。在发酵后期40~80 h控制pH为4.0,确保在得到最大菌体生物量的同时最大程度合成维生素K2。采用menA过表达和两阶段pH控制,菌体生物量和维生素K2的产量分别达到了(11.46±0.67)g/L和(63.60±1.81)mg/L,分别是原始菌分批发酵pH自然状态下的1.5倍和2.6倍。
