阿伏加德罗常数的命题特点与解答
2019-04-24黑龙江栾厚福
黑龙江 栾厚福
阿伏加德罗常数(NA)类试题,是历年高考常考题型之一。前几年命题热度有所降低,但从近3年全国各地高考试题来看,这类试题考查得更加频繁,再次成为高考的新焦点和热点,因而掌握这类试题的命题特点和解答方法显得尤为重要。
阿伏加德罗常数类试题主要以选择题形式考查不同条件下分子、原子、离子等多种微观粒子数目的计算,试题具有一定难度。通过对近几年试题的分析研究不难看出这类试题考查的知识面比较广,涉及基本概念与理论、元素化合物、化学反应原理等无机和有机化学知识。这类试题大体从以下五个角度命题。
1.围绕物质的状态和体积命题
选项往往给出一定体积的某物质,计算分子或原子数目。若只给出物质的体积,而不指明所处的状态(或非标准状况下),无法计算NA;若给出在标准状况下(25℃、1.01×105Pa)的体积,但该物质为非气态(如CCl4、H2O、SO3、HF、己烷、苯、氯仿、乙醇等物质在标准状况下均不是气态),也无法计算NA。
【例1】NA为阿伏加德罗常数的值,下列说法中正确的是
( )
A.(2016·全国卷Ⅰ·8)标准状况下,2.24 L CCl4含有的共价数为0.4NA
B.(2018·全国卷Ⅱ·11)标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
C.常温常压下,5.6 L N2中含有的分子数为0.25NA
D.(2017·全国卷Ⅲ·10)2.24 L(标准状况)苯在O2中完全燃烧,得到0.6NA个CO2分子
【分析与解答】CCl4在标准状况下呈液态,只根据体积无法计算四氯化碳中共价键数目,A项错误;标准状况下,11.2 L甲烷和乙烯的混合气体为0.5 mol,每个甲烷分子和乙烯分子中均含4个氢原子,即0.5 mol混合气体中含氢原子数为2NA,B项正确;常温常压下,Vm>22.4 L/mol,即 5.6 L N2分子数小于0.25NA,C项错误;苯在标准状况下呈液态,只根据体积无法确定苯燃烧产生CO2分子数,D项错误。故答案为B。

2.考查特殊物质的组成和结构特点
关于NA的试题中一般都包含一个考查特殊物质组成和结构的选项,这类选项往往结合物质质量或体积等形式给出。解答这类选项需做到:①牢记特殊物质中所含有的粒子数目,如Ne、OH-、D2O均含10个质子,能熟记或分析—OH、18O2、H37Cl等物质中电子、质子、中子数等。②熟记最简式相同的物质,如NO2和N2O4、乙烯(C2H4)和丁烯(C4H8)、苯和苯乙烯等最简式均相同。③了解摩尔质量相同的物质,如M=28 g·mol-1的物质有N2、CO和C2H4,M=44 g·mol-1的物质有CO2、N2O、C3H8和C2H4O,M=78 g·mol-1的物质有Na2S和Na2O2等。④理解特殊物质中所含化学键数目。如1 mol CnH2n+2中化学键为(3n+1) mol,1 mol硅中含2 mol Si—Si键,1 mol SiO2中含4 mol Si—O键,1 mol白磷(P4)中含6 mol P—P键等。
【例2】NA表示阿伏加德罗常数的值,下列说法中正确的是
( )
A.(2018·全国卷Ⅱ·11)常温常压下,124 g P4中所含P—P键数目为4NA
B.(2015·全国卷Ⅰ·8)18 g D2O和18 g H2O中含有的质子数均为10NA
C.(2018·全国卷Ⅰ·10)92.0 g甘油(丙三醇)中含有羟基数为1.0NA
D.(2016·全国卷Ⅰ·8)14 g乙烯和丙烯混合气体中的氢原子数为2NA
【分析与解答】124 g P4的物质的量为1 mol,P4为正四面体结构,每个分子中含6个P—P键,即1 mol P4中P—P键数目为6NA,A项错误;每个D2O和H2O分子中均含 10个质子,而18 g D2O和18 g H2O的物质的量分别为 0.9 mol 和1 mol,所含质子数分别为9NA和10NA,B项错误;92.0 g甘油的物质的量为1 mol,由甘油的结构简式可确定其中含羟基数为3.0NA,C项错误;乙烯和丙烯的最简式均为CH2,14 g二者的混合气体中含1 mol CH2,即含氢原子数为2NA,D项正确。故答案为D。

3.计算电解质溶液中粒子数目

【例3】NA表示阿伏加德罗常数的值,下列说法中正确的是
( )
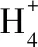
B.(2018·全国卷Ⅰ·10)16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA

D.(2017·全国卷Ⅲ·10)pH=1的H3PO4溶液中,含有0.1NA个H+
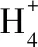
解答这类问题,要看是否给出指定溶液的体积,体积和浓度都给出后,要考虑溶液中离子的电离和水解情况,以及和溶质的组成是否有关等多种因素;若存在电离和水解等平衡,可结合物料守恒等确定微粒数目。
4.氧化还原反应中转移电子数目的计算
氧化还原反应中转移电子数目的计算是NA类选择题中典型的陷阱。解答这类问题要明确:①反应前后元素的化合价变化,能根据化合价变化分析具体物质在反应中所起的作用,即使是同一种物质在不同的反应中所起的作用不一定相同,如Cl2与金属的反应中,Cl2只作氧化剂,而Cl2与H2O、碱溶液的反应中,Cl2既作氧化剂又作还原剂;再如Na2O2与H2O(或CO2)的反应中,Na2O2既作氧化剂又作还原剂。②同一物质和不同物质反应,或反应物的用量不同,生成物的价态也不一定相同。如Fe分别和Cl2、S反应时生成物中铁的价态不同;Fe与HNO3反应,Fe不足时生成Fe3+,Fe过量时生成Fe2+。③注意氧化还原反应的先后顺序,如向FeI2溶液中通入Cl2时,I-先被氧化,然后氧化Fe2+。
【例4】用NA表示阿伏加德罗常数的值,下列说法中正确的是
( )
A.(2016·全国卷Ⅰ·8)1 mol Fe溶于过量硝酸,电子转移数为2NA
B.(2015·全国卷Ⅰ·8)过氧化钠与水反应时,生成0.1 mol 氧气转移的电子数为0.2NA
C.(2017·全国卷Ⅱ·8)2.4 g Mg与H2SO4完全反应,转移的电子数为0.1NA
D.KClO3与足量浓盐酸反应生成标准状况下33.6 L Cl2时,转移电子数为3NA

突破氧化还原反应计算类问题时,必要时先写出反应的化学方程式,分析反应中元素化合价变化,再结合氧化还原反应中的守恒规律、价态规律、先后规律等进行综合分析。如分析D项的歧化反应时,根据“只靠近不交叉”可知生成物中Cl2既是氧化产物又是还原产物,据此可计算反应中转移电子数目。
5.结合特殊反应和隐含反应命题
关于NA的试题中还经常结合某些特殊反应、特殊的反应条件和可逆反应等进行命题。突破这类问题时需做到:①熟悉特殊的反应,如Cu与浓硫酸的反应中,随着反应不断进行浓硫酸变成稀硫酸后,反应停止;常温下,Al、Fe遇浓HNO3、浓H2SO4钝化,无法计算反应中转移电子数目。②常见的可逆反应:工业合成NH3的反应、SO2的催化氧化反应、Cl2和H2O的反应、NO2与N2O4间的转化等。
【例5】用NA表示阿伏加德罗常数的值,下列说法中正确的是
( )
A.(2017·全国卷Ⅱ·8)0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA
B.(2016·全国卷Ⅰ·8)1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.100 mL 12 mol·L-1的浓盐酸与足量MnO2反应时,转移电子数目为0.6NA
D.(2018·全国卷Ⅱ·11)密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA

解答这类问题时先判断涉及的反应是否为可逆反应,需明确可逆反应不能进行到底,不能准确计算生成物的物质的量或计算反应中转移电子数目。Cu与浓H2SO4、MnO2与浓盐酸等反应中,酸的浓度减小后,反应停止;但一定质量的Cu加入浓HNO3中,Cu先与浓HNO3反应,然后继续与稀HNO3反应,但反应的产物不同,可根据Cu的质量求算转移电子数目。
通过对以上命题特点和解答方法的分析,不难归纳解答阿伏加德罗常数类试题的一般思路方法。
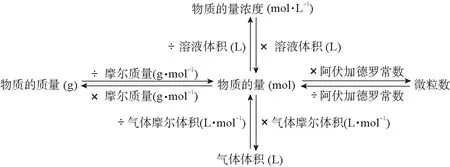
第一步:审题——明确研究对象与转化关系。物质的量的研究对象是分子、原子、离子、质子、中子、电子等微观粒子,考题中往往结合物质的质量、体积(气体)、物质的量浓度等形式,解答这类试题需明确这些物理量间的相互转化关系,如图,即做到“见量化摩”,并结合N=n·NA进行相关计算。
第二步:析题——巧避陷阱。①查看物质状态及所处状况,如当物质是气体时,应查看所给条件是否为标准状况;当条件是标准状况时,应查看所给物质在标准状况下是否为气体,并能正确运用气体摩尔体积进行相关计算。②分析特殊物质组成结构与特殊反应,要明确计算的是哪种微粒数目以及所给反应是否为可逆反应等。如给出一定质量的Na2O2应明确计算的是阴离子数目还是离子总数,给出标准状况下2.24 L乙烷,要表示的是极性键数目还是共价键数目。③电解质溶液中是否该考虑水解和电离,给出溶液的pH和体积,是否需要考虑溶液组成等,都要做到心中有数。④陌生的氧化还原反应,需写出化学方程式并结合价态规律等进行综合分析判断转移电子数目。
第三步:解题——做出判断。结合上面两步,抓住题目关键信息和特定条件,采用正向判断或间接排除的方法作答,明确是选择关于NA的表述中正确的还是不正确(或错误)的选项,从而选出符合题意的答案。

