猪苓菌核表皮黑色素的鉴定
2019-04-23边小禹梁宗锁常朝阳马存德孙建华
边小禹 梁宗锁,2 常朝阳* 马存德 孙建华
(1西北农林科技大学生命科学学院,陕西咸阳712100;2浙江理工大学生命科学学院,浙江杭州310000;3陕西步长制药有限公司,陕西咸阳712000;4陕西汉王略阳中药科技有限公司,陕西略阳724300)
猪苓(Polyporus umbellatus)为非褶菌目多孔菌科树花属药用真菌,其地下部分——菌核,即中药猪苓,是我国传统的名贵药材,具有利水渗湿之功效[1]。真菌菌核是在特殊环境下由营养菌丝交织聚集而成的具有抵御恶劣环境能力的休眠结构[2]。猪苓菌核按其表皮颜色可分为三个时期,依次为“白苓”“灰苓”和“黑苓”。每年春天来临,地温升高至10℃时,菌核开始萌发,至五月左右长成白苓。入秋后温度降低,白苓表皮颜色逐渐加深,越冬后形成灰苓,再经过一个冬天灰苓转化成黑苓[3]。从“白苓”到“灰苓”,猪苓的共生真菌——蜜环菌的侵染由无到有;从“灰苓”到“黑苓”阶段,侵染程度逐渐增强,“黑苓”菌丝木质化并产生中空的隔离腔[4]。并且,猪苓有效成分——多糖和麦角甾醇的积累随着猪苓发育的成熟不断增加[5]。据相关文献报道,黑色素合成与真菌的微菌核形成[6]、抗逆性和致病性[7-8]均有紧密的联系。而对于地下生长的猪苓菌核,黑色素的积累与菌丝的固化对于水分过多渗入、蜜环菌侵染和虫害的防御是否起到关键作用,还需进一步研究。目前已报道了许多病原真菌菌核的黑色素研究,而大型药用真菌的黑色素研究较少,猪苓菌核表皮黑色素的研究未见报道。笔者通过对成熟阶段猪苓菌核(黑苓)表皮色素的鉴定,以期能进一步了解猪苓生长发育过程中的代谢规律,为分子水平研究猪苓菌核发育过程中黑色素的关键作用提供基础。
1 材料与方法
1.1 供试材料
猪苓成熟菌核(黑苓)表皮:猪苓菌核切取表皮并烘干。猪苓菌核由陕西省汉中市略阳县陕西汉王药业猪苓GAP种植基地提供。
仪器为DHG-9240A型电热恒温鼓风干燥箱,上海精宏实验设备有限公司;DC-100型高速多功能粉碎机,浙江武义鼎藏日用金属制品厂;AUW120型电子天平,SHIMADZU;XMTD-8222型恒温水浴锅,上海精宏实验设备有限公司;SHB-Ⅲ型循环水式多用真空泵,郑州长城科工贸有限公司;KQ-250B型超声清洗机,昆山市超声仪器有限公司;3900H型紫外-可见分光光度计,日立公司;Nicolet iS10型傅里叶变换红外光谱仪,美国赛默飞世尔科技有限公司;RE-52AA旋转蒸发器,上海亚荣生化仪器厂。
黑色素标准品(melanin synthetic cell culture tested)属于多巴黑色素,购自上海麦克林生化科技有限公司,试验用水为纯水,其余试剂均为国产分析纯。
1.2 试验方法
1.2.1 猪苓菌核表皮黑色素的提取与纯化
参照姚增玉(2007)文献中的方法并略有改动[9]。称取50 g猪苓菌核表皮,加水煮沸15 min以除去水溶性杂质及材料中的气体;经NaOH溶液提取HCl溶液沉淀得到黑色素的粗提物;经酸水解、有机溶剂抽提、反复沉淀、去除Cl-并干燥的纯化工艺得到黑色素的颗粒状固体,真空干燥至恒重,得率为(0.147±0.103)%,置于-20℃冰箱保存。
1.2.2 黑色素溶液的配制
干燥的黑色素样品按2∶1(mg/mL)加入质量分数为0.2%的氨水超声辅助溶解,旋转蒸发仪减压浓缩至pH 7.5,用蒸馏水稀释至所需浓度[9]。
1.2.3 黑色素的溶解性与化学定性分析
在水、氢氧化钠溶液、盐酸溶液、乙醇、丙酮、乙酸乙酯和氨水溶液中分别加入猪苓菌核表皮黑色素的精提物,观察黑色素的溶解情况;在高锰酸钾溶液、重铬酸钾溶液、次氯酸钠、过氧化氢(双氧水)、氯化铁溶液、铁氰化钾和氯化铁混合液、氯化钠-明胶溶液中各加入黑色素的水溶液,观察溶液颜色;在滤纸上滴加黑色素的乙醇溶液,待挥发干后,滴加三氯化铝乙醇溶液,烘干后在紫外灯下观察是否有荧光[9-10]。
1.2.4 黑色素紫外-可见光谱特征的测定
以蒸馏水为空白对照,黑色素的水溶液于200~800 nm进行紫外-可见光光谱扫描。
1.2.5 黑色素红外光谱特征的测定
采用溴化钾压片法。将溴化钾结晶块在玻璃研钵中研成细粉,作为背景扣除,样品与溴化钾按1∶100混合研磨成细粉,进行压片并检测。
1.2.6 黑色素的稳定性测定
黑色素浓度均以25µg/mL作为其稳定性的试验浓度。
1.2.6.1 温度对黑色素稳定性的影响
设25℃、75℃和100℃三个梯度,分别在0.5 h、1.0 h、0.5 h、2.0 h和4.5 h对样品进行紫外光谱扫描。
1.2.6.2 pH对黑色素稳定性的影响
以磷酸和磷酸二氢钠溶液配制pH2的缓冲液,以柠檬酸和磷酸氢二钠溶液配制pH3、pH4和pH5的缓冲液,以磷酸氢二钠和磷酸二氢钠溶液配制pH6、pH7和pH8的缓冲溶液,以碳酸钠和碳酸氢钠溶液配制pH9.16和pH10.83的缓冲液,将高浓度黑色素水溶液以上述缓冲液稀释至25µg/mL,13 000 g离心30 min,于紫外分光光度计下进行扫描。
1.2.6.3 冷冻对黑色素稳定性的影响
将pH4、pH5、pH6、pH7、pH8 和pH9.16的黑色素水溶液,分为两组,分别于4℃和-20℃下放置2 h,13 000 g离心30 min,于紫外分光光度计下进行扫描。
1.2.6.4 光照对黑色素稳定性的影响
设光照箱中和紫外灯下照射两组,以避光处理为对照,分别于3 h、2 d和5 d时进行紫外光谱的扫描。
1.2.7 黑色素抗氧化活性的测定
抗氧化活性的测定均以与黑色素水溶液相同浓度梯度的抗坏血酸(VC)和2,6-二叔丁基对甲酚(BHT)作为阳性对照。
1.2.7.1 清除羟自由基(·OH)活性的测定
配制50µg/mL、75µg/mL、100µg/mL、125µg/mL和150µg/mL的黑色素水溶液。羟自由基清除活性的测定参照(凌关庭,2004)的方法并略有改动[11]。先后于试管中加入1 mL样品、1 mL 1,10-菲咯啉、1.5 mL磷酸缓冲液、1 mL FeSO4和1 mL H2O2溶液,混合物于37℃下反应30 min,于536 nm处检测吸光值,记作As;以水代替样品记作Ab;以水替代样品和H2O2记作A0;以水调零。
Inhibition(%)=[(As-Ab)/(A0-Ab)]×100
1.2.7.2 清除超氧阴离子自由基(O2·-)活性的测定
配 制 100µg/mL、200µg/mL、300µg/mL、400µg/mL和500µg/mL的黑色素水溶液,具体方法参照(Duan,2007)的方法并略有改动[12]。先后于两份试管中加入2 mL L-蛋氨酸、2 mL氯化硝基四氮唑蓝、1 mL乙二胺四乙酸二钠、0.5 mL样品、1 mL核黄素溶液,一份置于暗处,于560 nm处检测吸光值,记作Aj;一份置于光照箱中,室温反应15 min后,立即遮光,记作A;以水代替样品,一份置于暗处,用于调零,一份置于光照箱中,记作A′。
Inhibition(%)=[1-(A-Aj)/A']×100
1.2.7.3 还原力的测定
配 制 100µg/mL、200µg/mL、300µg/mL、400µg/mL和500µg/mL的黑色素水溶液。参照(Oyaizu,1986)的方法测定并略有改动[13]。先后于试管中加入样品、磷酸缓冲液、铁氰化钾溶液各2.5 mL,混合物于50℃水浴中反应20 min;取出后加入2.5 mL三氯乙酸,于650 g的离心力下离心10 min;取上清液5 mL,加入蒸馏水4 mL,三氯化铁1 mL,于700 nm处检测吸光值。
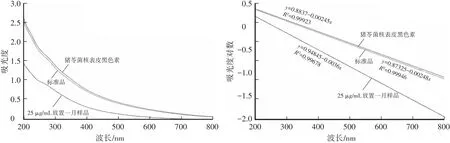
图1 紫外-可见光谱图(左)和吸光度对数的线性拟合(右)
1.2.7.4 总多酚含量的测定
配 制 100µg/mL、200µg/mL、300µg/mL、400µg/mL和500µg/mL的黑色素水溶液。采用Folin-Ciocalteu法测定并略有改动[14]。先后于试管中加入1 mL样品、5 mL Folin-Ciocalteu试剂,摇匀后于室温下静置8 min,加入4 mL碳酸钠溶液,摇匀后室温静置2 h,3000 g离心10 min,于760 nm处检测吸光值。
1.2.8 数据统计分析
均设置3个生物学重复,并使用IBM SPSS Statistics 23、Origin Pro 2015和 GraphPad Prism 5对数据进行分析与作图。
2 结果与分析
2.1 溶解性与化学定性
猪苓菌核表皮黑色素具有典型的黑色素溶解特性,不溶于水,乙酸乙酯、丙酮等多数有机溶剂,微溶于乙醇,在pH3时完全沉淀,溶于碱性溶液。化学定性试验结果:多酚反应呈阳性,表明该色素含有酚羟基;与氯化钠-明胶溶液反应未有白色沉淀形成,表明该色素不能凝固蛋白,不是鞣质;三氯化铝反应未有荧光现象,表明该色素不具有黄酮类色素结构;可以被氧化剂漂白,尤其对次氯酸钠敏感,见表1。

表1 猪苓菌核表皮黑色素的溶解性与化学定性
2.2 紫外-可见光谱
如图1,成熟猪苓菌核(黑苓)表皮黑色素在200~800 nm扫描紫外-可见光光谱,随着波长的增加,吸光度呈指数型逐渐下降[15-16]。与标准品一致,在270~280 nm有小的肩峰,是由于蛋白质中的芳香族氨基酸的光吸收[17]。将吸光度对数对波长作图,得到斜率为-0.00245的直线,标准品黑色素的斜率为-0.00248,该斜率为不同来源黑色素的特征性参数,但放置一月的样品所得斜率为-0.0036,这可能是黑色素氧化的缘故[16,18-19]。
2.3 红外光谱
红外光谱可以表征黑色素的主要功能性基团,由于黑色素结构复杂,所以其红外光谱是一系列宽而强的吸收峰,每个宽峰都是由多种官能团振动产生的。如图2,猪苓菌核表皮黑色素吸收峰主要分布在3500~3300 cm-1、2970~2900 cm-1、1650~1600 cm-1、1400~1380 cm-1、1260~1200 cm-1几组峰,分别是由于聚合体中—OH的伸缩振动,脂肪族—CH的伸缩振动,芳香环中C=C、C=N骨架弯曲和羧酸外C=O伸缩振动,COO—的反对称伸缩振动,酚羟基和羧基中羟基的伸缩和弯曲振动形成的,900~600 cm-1吸收峰较弱,是由于芳环被取代,形成共轭关系。以上具有典型的黑色素结构特征。黑色素标准品具有NH的伸缩振动,COOH中C=O的伸缩振动,芳香环中C=C、C=N的弯曲和羧酸外C=O伸缩振动,NH弯曲、CN伸缩振动(酰胺II带)和芳香环C=C拉伸,COO—的反对称伸缩振动,酚羟基和羧基中羟基的伸缩和弯曲振动,羟基振动。猪苓菌核表皮黑色素和标准品黑色素的官能团组成大体一致,但特征峰位置和波形却差异较大,缺少1590~1610 cm-1多巴黑色素的特征吸收峰,所以猪苓菌核表皮黑色素在结构上异于多巴黑色素[20-21]。
2.4 稳定性
(1)温度对稳定性的影响
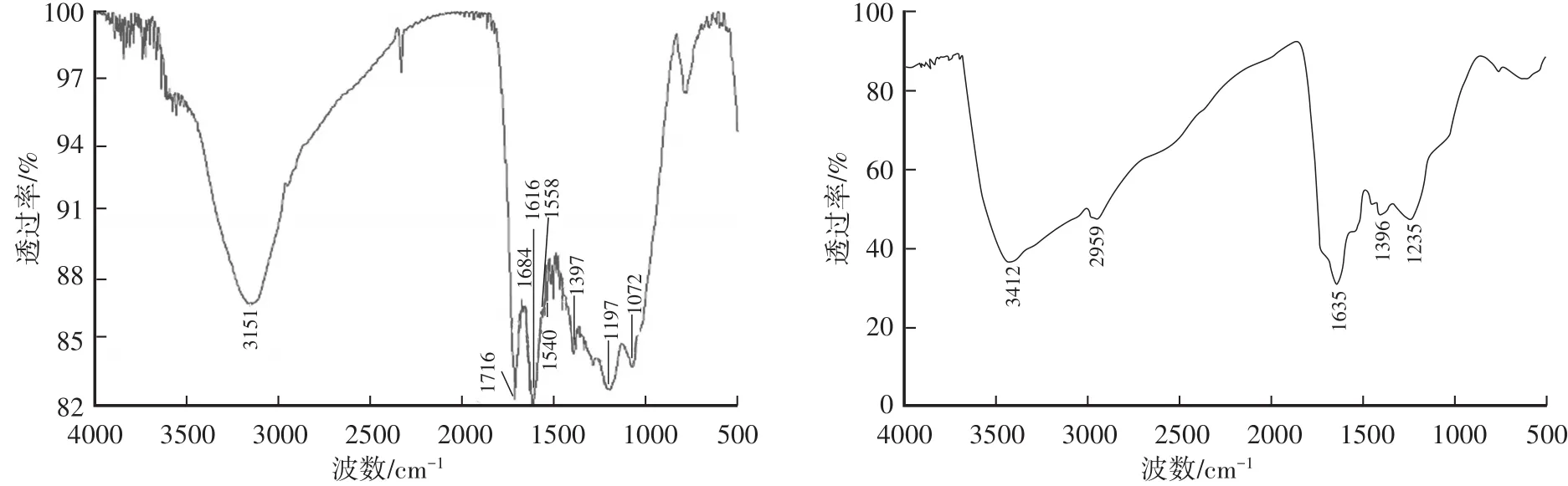
图2 猪苓菌核表皮黑色素和标准品黑色素的红外光谱图

图3 温度对猪苓菌核表皮黑色素的影响

图5 冷冻对猪苓菌核表皮黑色素的影响
如图3所示,高温对黑色素具有增色效应,1.5 h之后,增色效应差异更为显著,在1.5 h之前,黑色素的耐热性良好。在1.0 h以后,75℃下黑色素的增色效应开始变化显著;在1.5 h后,25℃下黑色素的增色效应开始变化显著(P<0.05);在0.5~4.5 h,100℃下黑色素的吸光度积分始终显著增高。
(2)pH对稳定性的影响
如图4所示,当pH≤3时,黑色素完全沉淀,随着pH的升高,黑色素溶解于溶液中,并且增色效应显著增强,当溶液成中性或弱碱性时,即pH7和pH8之间,增色效应不显著。
(3)冷冻对稳定性的影响

图4 pH对猪苓菌核表皮黑色素的影响
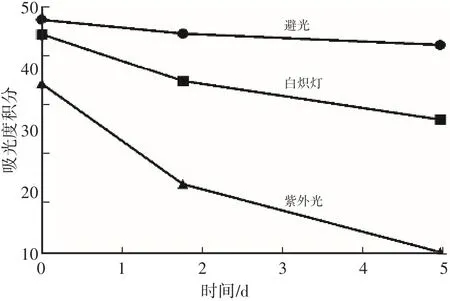
图6 光照对猪苓菌核表皮黑色素的影响
如图5所示,冷冻对黑色素的影响取决于pH,当pH小于7时,即在酸性溶液中,冷冻对黑色素有减色效应,当pH≥7时,即黑色素处于中性和碱性溶液中时,冷冻对于黑色素的稳定性无显著影响。
(4)光照对稳定性的影响
如图6所示,光照对于黑色素有显著的减色效应,尤其随着时间的延长,黑色素的稳定性越差,当用紫外灯照射5 d时,黑色素在350~550 nm间的吸光度积分降到8.5左右。紫外光照对黑色素结构的破坏程度最强,白炽灯其次,黑暗处理最弱,即黑色素稳定性最高。
2.5 黑色素抗氧化活性
(1)清除羟自由基活性

图7 猪苓菌核表皮黑色素对羟自由基的清除效果
如图7所示,黑色素对羟自由基的清除率与质量浓度具有量效关系,在50~100µg/mL,其羟自由基清除率显著高于VC与BHT,在100~150µg/mL,BHT的清除率与浓度的正相关关系趋于稳定,显著高于黑色素和VC,而黑色素始终高于VC(P<0.05),且增势较高。
(2)清除超氧阴离子自由基活性
如图8所示,在100~400µg/mL,猪苓菌核表皮黑色素与VC对超氧阴离子自由基的清除活性无显著差异(P<0.05),但显著高于BHT。在400~500µg/mL,黑色素清除自由基活性增长趋势变缓,而BHT在100~200µg/mL与400~500µg/mL,清除率增势均不显著。
(3)还原力活性
如图9所示,VC的还原力显著优于黑色素与BHT,BHT较黑色素还原力稍强,在300~500µg/mL,黑色素的还原力增势变缓。

图8 猪苓菌核表皮黑色素对超氧阴离子自由基的清除效果
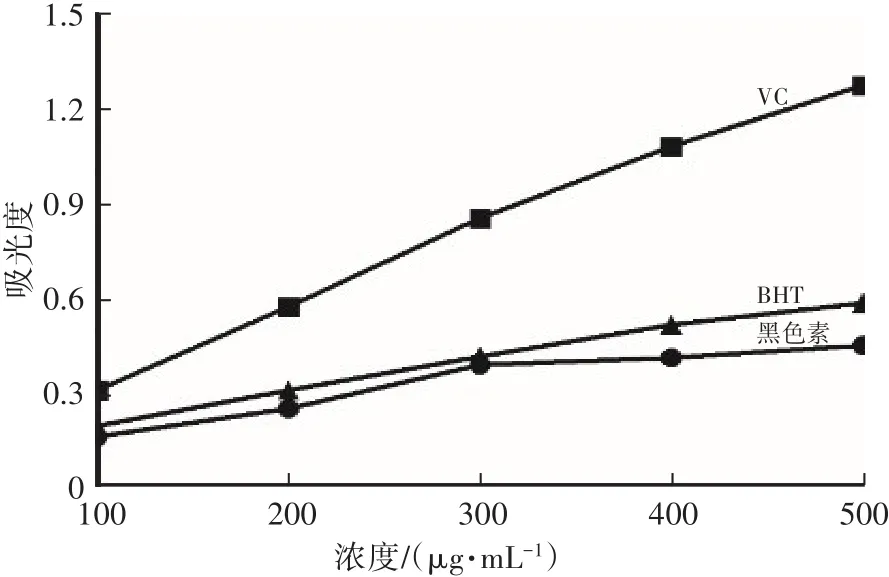
图9 猪苓菌核表皮黑色素的还原力
(4)总多酚含量

图10 猪苓菌核表皮黑色素的总多酚含量
如图10所示,三种物质的总多酚含量与浓度成正相关,依次为VC>BHT>黑色素,1 g黑色素、VC和BHT的总多酚含量分别相当于(224.48±11.46)mg、(504.05±79.67)mg和(309.20±73.63)mg没食子酸。
3 小结与讨论
研究首次从猪苓菌核表皮中提取纯化出了黑色素,并从溶解性与化学定性,紫外光谱与红外光谱,黑色素稳定性及抗氧化活性等方面对其进行了鉴定。
(1)猪苓菌核表皮黑色素具有典型的黑色素溶解特性:不溶于水和常见的有机溶剂;在pH3时完全沉淀,溶于碱性溶液。化学定性表明该色素含有酚羟基,不具有鞣质和黄酮类色素的特性,易被次氯酸钠漂白。
(2)猪苓菌核表皮黑色素在紫外光区有很强的吸收,随着波长的增大,吸光度呈指数型降低,在可见光区内吸光度极弱。吸光度的对数对波长作图,得到斜率为负的直线,不同来源的黑色素也具有斜率为负的对数吸光图。猪苓菌核表皮的斜率为-0.00245,与其他来源的黑色素类似,例如:齐整小核菌(Sclerotium rolfsii)黑色素[22]和黑木耳(Auricularia auricula)黑色素[23]为-0.0028,山杏种皮(Testae of wild apricot)黑色素[9]和弗兰克氏菌(Frankia sp.)黑色素[24]为-0.0039,放置一月后的样品斜率为-0.0036,可能是氧化的缘故。红外光谱分析表明,猪苓菌核表皮黑色素含有大量的—OH和—CH,较多的C=C、C=N、C=O、COO—等基团,并且大量芳香环被取代,形成共轭体系。
(3)黑色素是由酚类或吲哚类聚合而成的生物大分子,而酚羟基易被氧化成醌基。高温处理对黑色素略有增色效应,耐热性良好;当pH≤3时,黑色素完全沉淀,当pH处于4~10.83时,颜色随着pH的提高逐渐加深;冷冻对于黑色素稳定性的影响取决于溶液的pH,当pH≤6时,即黑色素处于酸性溶液中,冷冻破坏了黑色素胶体或溶液的平衡状态,使黑色素沉淀出来[9],随着pH的降低,-20℃处理比4℃处理的黑色素沉淀更多;猪苓菌核表皮黑色素对光照极为敏感,依次为紫外灯>白炽灯>避光处理,紫外灯照射5 d可使黑色素发生肉眼可见的褪色。有文献表明,紫外线可诱导黑色素溶液中羟自由基的形成,从而促进其氧化褪色[25]。
(4)黑色素能清除活性氧和自由基,是比SOD/POD更古老的抗氧化自由基保护系统。研究选择四个指标来评判猪苓菌核表皮黑色素的抗氧化活性:猪苓菌核表皮黑色素清除羟自由基的活性显著高于VC,在50~100µg/mL,显著高于BHT;清除超氧阴离子自由基活性与VC差异不显著,但显著高于BHT;还原力与BHT无显著差异,显著低于VC;总多酚含量显著低于VC和BHT,可能是由于提取过程中酚羟基过度氧化成醌基的原因。
黑色素在菌核等真菌结构中起到提高抗张强度[26]和抑制真菌细胞壁溶解[27-28]的作用。在真菌病原体中,黑色素有助于穿透宿主[29]。研究首次鉴定了猪苓菌核表皮黑色素,为从分子水平上研究猪苓的药理药效及发育过程提供了新的思路和基础。对于黑色素在猪苓菌核的生长发育过程中的机制,我们将进行进一步的研究。
