一种可促进重组蛋白表达量和稳定性的多功能纯化标签的开发与利用
2019-04-23赵伟欣刘松刘立明陈坚堵国成
赵伟欣,刘松,刘立明,陈坚,堵国成
一种可促进重组蛋白表达量和稳定性的多功能纯化标签的开发与利用
赵伟欣,刘松,刘立明,陈坚,堵国成
江南大学 生物工程学院,江苏 无锡 214122

赵伟欣, 刘松, 刘立明, 等. 一种可促进重组蛋白表达量和稳定性的多功能纯化标签的开发与利用. 生物工程学报, 2019, 35(4): 626–635.Zhao WX, Liu S, Liu LM, et al. Development of a purification tag to produce thermostable fused protein. Chin J Biotech, 2019, 35(4): 626–635.
自组装双亲短肽(Self-assembling amphipathic peptides,SAPs) 是一类亲疏水氨基酸按一定规律分布、具有自聚合效应的短肽,融合在酶蛋白N端时,具有促进表达和稳定化的功能。根据前期研究结论,设计一条全新的基于SAPs (S1w,HNANARARHNANARARHNANARARHNARARAR) 的可促进融合蛋白表达和稳定性,并可用于镍柱亲和层析的多功能短肽标签,在大肠杆菌表达系统中,将S1w以PT-linker (PTPPTTPTPPTTPTP)融合在碱性果胶酶(Alkaline polygalacturonate lyase,PGL)、脂肪氧合酶 (Lipoxygenase,LOX) 及绿色荧光蛋白(Green fluorescent protein,GFP) 的N末端时,与对应的野生型相比,PGL及LOX的粗酶活分别提高了3.1倍和1.89倍,GFP的荧光强度提高了16.22倍。S1w的3种融合酶均可用镍柱进行亲和纯化,并具有较高的回收率。PGL及LOX在对应的热处理条件下,与野生型相比,半衰期分别提高了2.16倍和3.2倍。将GFP-S1w在枯草芽孢杆菌及毕赤酵母表达系统中表达,发现在枯草芽孢杆菌中融合蛋白表达量提高明显,但在毕赤酵母中表达量几乎没有改变。说明在原核表达体系中,S1w可作为一种新型的促表达、稳定化及可纯化的多功能标签。
自组装双亲短肽,融合蛋白,表达量,热稳定性,纯化,表达宿主
微生物发酵已逐渐应用于多种酶蛋白的工业化生产过程中。目前,如何获得高产量、高稳定性及高催化效率的多功能酶蛋白是酶催化工业应用的主要瓶颈问题[1]。虽然通过基因工程和蛋白质工程等手段可以对酶蛋白本身进行改造,利用合适的表达宿主或优化培养条件可使得微生物对酶进行高效异源表达,但实际生产中还是经常面临着蛋白低可溶表达、稳定性差、催化效率低和难分离纯化等诸多问题[2]。利用分子生物学技术可以将不同酶分子融合表达成为符合工业需求的多功能酶,可应用于多功能催化体系的研究中并显示出重要的理论和应用研究价值[3]。此外,末端融合功能肽的方法对酶蛋白的表达量及催化性质的改造已取得广泛显著成果[4-6]。在无需酶蛋白的晶体结构信息的条件下进行末端融合,可有效促进其异源表达产量及相关酶学性质[7]。
由亲疏水氨基酸按照一定规律分布组成的自组装双亲短肽(Self-assembling amphipathic peptides,SAPs) 被Lu等首次应用于脂肪氧合酶(Lipoxygenase,LOX,EC 1.13.11.12) 的热稳定性及催化效率改造[5]。其中,来源于酵母Zution蛋白中的SAP (S1,AEAEAKAKAEAEAKAK) 对环糊精转移酶[8]、腈水合酶[9]、碱性淀粉酶[10]及碱性果胶酶[11]的蛋白表达量、热稳定性及催化效率均有一定促进作用。基于此,具有与S1类似氨基酸组成和排布方式的SAP (S11,AEAEAHAHAE AEAHAH)被开发并应用在多个酶蛋白的异源表达过程中,其融合蛋白在大肠杆菌中的表达量、稳定性及催化效率均有所提高,且S11内的组氨酸可用于融合酶的镍柱亲和层析,其纯化效率较His-tag纯化效率明显提高[12]。S1与S11之间的4个氨基酸残基的差异,说明氨基酸组成对SAPs融合酶表达量有着重要影响。此外,氨基酸的突变会引入相应密码子的改变,诸多研究证明密码子对异源基因转录和翻译过程有重要影响[13-14]。故根据前期研究结论,对SAPs合理的改造和修饰可以进一步提高其多功能应用效果。
本研究提出一条全新的多功能SAP(S1w,HNANARARHNANARARHNANARARHNARARAR),其可促进重组融合蛋白表达和稳定性,同时可作为一种用于镍柱亲和层析的多功能蛋白标签。并将其应用到碱性果胶酶(Alkaline polygalacturonate lyase,PGL)、脂肪氧合酶(Lipoxygenase,LOX) 及绿色荧光蛋白(Green fluorescent protein,GFP) 中验证其作用效果。此外以GFP为模式蛋白,研究S1w在不同表达体系(大肠杆菌、枯草芽孢杆菌及毕赤酵母) 中的促表达功效。
1 材料与方法
1.1 材料
1.1.1 菌株及质粒
大肠杆菌JM109作为质粒的克隆宿主。酶/蛋白表达宿主.BL21(DE3)、枯草芽孢杆菌W600及毕赤酵母GS115由本实验室保存。
含有PGL表达基因的质粒pET-22b(+)/、含有LOX表达基因的pET-22b(+)/质粒及含有GFP表达基因的pET-22b(+)/质粒由本实验室前期构建并保存(图1A)[12]。S1的PGL融合酶(PGL-S1)表达质粒pET-22b(+)/-及S11的PGL融合酶(PGL-S11) 表达质粒pET-22b (+)/-由本实验室保存。pPIC9K质粒及pP43NMK质粒购于TaKaRa (大连) 公司。
1.1.2 试剂
Prime STAR (HS) DNA高保真聚合酶、DNA片段回收试剂盒、质粒提取试剂盒、限制性内切酶及大肠杆菌感受态制备试剂盒均购于TaKaRa (大连) 公司。异丙基-β-D硫代半乳糖苷(IPTG)、氨苄青霉素、卡那霉素及遗传霉素G418均购于生工生物工程(上海) 股份有限公司。NuPAGE®Novex®Bis-Tris预制凝胶及所用标准蛋白marker购自Life Technologies公司。一步克隆反应ClonExpressTMⅡ试剂盒购于南京诺唯赞公司。DNA片段合成、引物合成及测序由生工生物工程(上海) 股份有限公司完成。所用相关底物等均购于Sigma公司,其他常规试剂均为国产或进口分析纯。
1.2 方法
1.2.1 S1w融合酶突变体的构建
自组装双亲短肽S1w (HNANARARHNANA RARHNANARARHNARARAR)连同PT-linker (PTPPTTPTPPTTPTP)的编码基因由生工生物工程(上海) 股份有限公司合成并插入至pET-22b(+)/、pET-22b(+)/、pET-22b(+)/的Ⅰ和Ⅰ酶切位点之间,分别获得PGL-S1w、LOX-S1w和GFP-S1w融合酶的表达质粒pET-22b(+)/、pET-22b(+)/和pET-22b(+)/(图1B)。并将pET-22b(+)/质粒作为模板,以表1中所列对应引物进行聚合酶链式反应(PCR)获得融合酶的表达基因片段,并用一步克隆酶融合至线性化的质粒pP43NMK及pPIC9K中,获得在枯草芽孢杆菌及毕赤酵母中的pP43NMK/和pPIC9K/表达质粒(图1B)。并用引物对DS-pP43-F/ DS-pP43-R和DS-9K-F/DS-9K-R分别将S1w和PT-linker表达基因从pP43NMK/和pPIC9K/中缺失,获得在枯草芽孢杆菌及毕赤酵母中表达的野生型GFP (图1A)。

表1 本文所用引物序列表
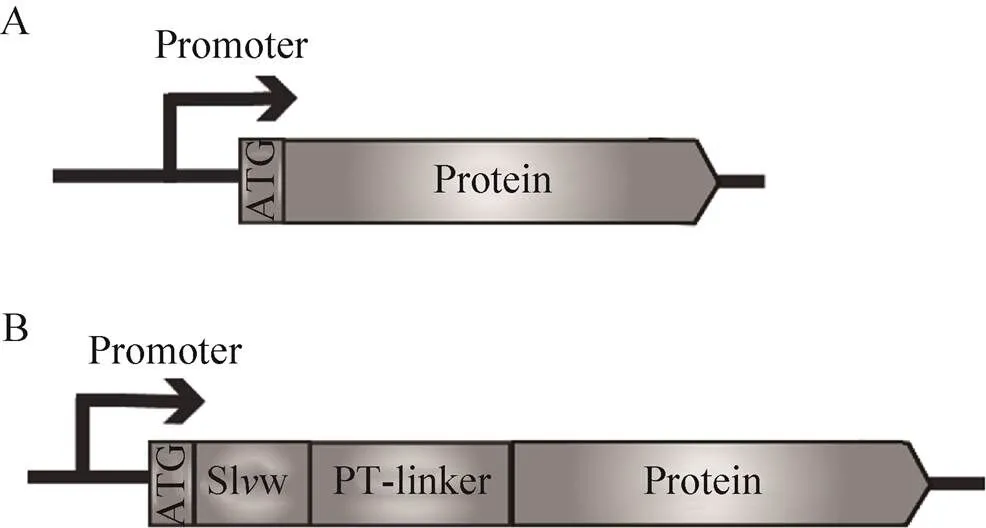
图1 重组质粒构建
1.2.2 大肠杆菌发酵培养条件
种子培养:挑取单菌落接入种子培养基[7]装液量为25 mL的三角瓶(250 mL) 中,培养温度37 ℃,摇床转速200 r/min,培养12 h。
发酵培养:按3% (/) 的接种量接入装液量为25 mL的三角瓶(250 mL) 的发酵培养基中,培养温度37 ℃,当600达到0.6时加入IPTG诱导,并同时调整温度到该酶最适宜的诱导温度下培养。
培养条件:PGL:IPTG 0.04 mmol/L,30 ℃下培养48 h;LOX:IPTG 1 mmol/L,20 ℃下培养48 h;GFP:IPTG 0.05 mmol/L,25 ℃下培养24 h。
1.2.3 S1w的GFP融合酶在不同表达宿主中的培养条件
大肠杆菌培养参照文献[7]完成。枯草芽孢杆菌培养参照文献[15]完成。毕赤酵母菌培养参照文献[16]完成。
1.2.4 酶活及荧光检测方法
碱性果胶酶(PGL)[17]的酶活测定方法参照前期研究。
由于脂肪氧合酶(LOX) 为胞内表达,故取一定的菌体,用20 mmol/L磷酸盐缓冲液(pH 7.5)清洗2次,用相同体积的缓冲液悬浮(使得600=5),破壁后,离心取上清液,按照前期研究方法测定LOX酶活[18]。
绿色荧光蛋白(GFP) 检测方法:在避光条件下将荧光样品进行一定的稀释,采用多功能酶标仪(BioTek,Winooski,VT,USA) 进行荧光强度检测,缓冲液A (20 mmol/L磷酸盐缓冲液,pH 7.5) 作为空白对照。
1.2.5 酶/蛋白的分离纯化
A液:20 mmol/L磷酸盐缓冲液,500 mmol/L NaCl,20 mmol/L咪唑。
B液:20 mmol/L磷酸盐缓冲液,500 mmol/L NaCl,500 mmol/L咪唑。
20 mmol/L的pH 7.5的磷酸盐缓冲液配 制方法:190 mL 20 mmol/L NaH2PO4与810 mL 20 mmol/L Na2HPO4均匀混合。
野生型PGL和PGL-S1[17]、野生型LOX[18]的纯化分别参照前期研究方法进行操作。野生型GFP采用盐析方法进行初步富集和阴离子亲和层析进行纯化,操作过程参照前期报道[19]。
PGL-S1w、PGL-S11、LOX-S1w及GFP-S1w融合酶采用镍柱亲和层析。含有目的蛋白的胞外发酵液或胞内上清液经过0.22 μm滤膜过滤后作为待纯化样品。用缓冲液A以1 mL/min的流速平衡HisTrap 5 mL FF纯化柱。将含有重组融合酶样品以1 mL/min流速上样,并用缓冲液A洗脱未结合蛋白,平衡纯化柱。将结合在镍柱上的蛋白分别用8%的缓冲液B、60%的缓冲液B及100%的缓冲液B进行梯度洗脱并收集含有目的蛋白的组分。
所获得的目的蛋白溶液使用5 mL HiTrap Desalting纯化柱用缓冲液A以5 mL/min的流速进行脱盐处理,所得蛋白样品于4 ℃保存。
1.2.6 蛋白电泳分析及蛋白浓度测定
SDS-PAGE分析,使用Life Technologies公司预制胶NuPAGE®Novex®Bis-Tris,操作步骤详见说明书。以0.1% (/) 考马斯亮蓝R-250进行染色。
采用Bradford方法测定蛋白质浓度,以牛血清蛋白作为标准蛋白测定蛋白浓度标准曲线。具体操作参照试剂盒说明书。
1.2.7 酶的热稳定性测定方法
重组PGL及其突变体的热稳定性以60 ℃下的半衰期(1/2,min) 来表示。将纯化并除盐后的PGL用缓冲液A稀释至一定浓度,在60 ℃下保温,每隔3 min测定残余酶活。
脂肪氧合酶热稳定性测定方法:将纯化后的酶用缓冲液A稀释到蛋白浓度为100 μg/mL并在50 ℃保温,间隔测定残余酶活,计算1/2。1/2按照文献所述方式进行拟合计算[20]。
2 结果与分析
2.1 多功能肽S1vw序列的设计
S1类SAPs融合在酶蛋白N端时具有促进融合酶表达和稳定化的功能[12]。前期研究结果表明[21],蛋白质翻译过程中,新生肽链N端的正电荷氨基酸残基能与带负电的核糖体相结合,从而减缓蛋白质翻译速率,促进蛋白质表达产量。为强化S1类SAPs的促表达功能,提出S1w短肽,在其中引入不带电的天冬酰胺残基(N) 和带正电荷的精氨酸残基(R),使其整体呈现净电荷为正。常用的组氨酸标签His-tag (HHHHHH) 含有6个组氨酸,关于S11的研究结果显示[12],4个组氨酸残基即可实现良好的纯化效果,且组氨酸残基在蛋白质分子中均匀分布,可防止其被包埋[22]。故在S1w内部均匀插入4个组氨酸(H),最终确定S1w的氨基酸序列为HNANARARHNANARA RHNANARARHNARARAR,以期融合在酶蛋白N端时,既可促进融合酶的表达量和稳定性,又可作为镍柱纯化的多功能蛋白标签。
2.2 S1vw融合酶表达质粒的构建
S1w (HNANARARHNANARARHNANARA RHNARARAR) 是根据S1及S11序列优化而来。为研究其对不同酶蛋白的表达量、稳定性等的影响,本研究构建PGL、LOX及GFP的S1w融合酶突变体(图1),在大肠杆菌中进行异源表达。并将GFP-S1w在大肠杆菌、枯草芽孢杆菌及毕赤酵母中进行表达,比较其表达量差异。研究S1w针对不同酶/蛋白和S1w在不同表达系统的普适性应用效果。
2.3 S1vw对不同酶/蛋白表达量的影响
在大肠杆菌表达系统中,PGL胞外表达,而LOX和GFP胞内表达。分别测定PGL的胞外酶活、LOX的胞内酶活和GFP表达菌的全细胞荧光强度。结果如图2所示,分别在3种酶/蛋白的N端融合S1w后,融合酶/蛋白的表达量明显提高。PGL的融合酶(PGL-S1w) 的胞外酶活提高至原野生型PGL的3.1倍,与PGL-S1和PGL-S11相比,分别提高了1.2倍和0.95倍,说明相较于S1和S11,S1w促表达效果更佳。LOX的融合酶(LOX-S1w) 的胞内酶活较野生型提高了1.89倍。在相同处理条件下,GFP-S1w的荧光强度(荧光强度/菌浓600) 是GFP的16.22倍。SDS-PAGE分析也表明融合SAPs后条带变粗,且蛋白分子量也发生一定变化,说明N端融合S1w后,酶/蛋白表达量显著提高。
2.4 S1vw对不同酶蛋白纯化效率的影响
野生型PGL、LOX及GFP不能直接用镍柱亲和层析进行纯化,由于野生型表达过程中蛋白含量较低,往往需要进行一步硫酸铵或乙醇富集的工序,导致整个过程中蛋白质回收率较低。表2详细比较了野生型PGL、LOX及GFP与所对应的S1w融合酶在不同纯化条件下的回收率。结果显示,在不经过任何预处理的条件下,S1w的3种融合酶的回收率分别达到55.43%、34.22%和64.35%。而所对应的野生型PGL、LOX及GFP,在相同条件下几乎不能被有效纯化,经过硫酸铵和乙醇沉淀富集后用对应的方法进行纯化[17-19],回收率分别为20.45%、26.22%和36.54%。
此外,前期研究表明S11短肽也具有纯化功能[12],如表2所示,相同条件下PGL-S11与PGL-S1w的回收率相近,说明S1w保持了S11的纯化功能。纯化后蛋白电泳分析如图3所示。且需要说明的是,前期研究已经证明PGL和LOX的His-tag融合酶在相同条件下不能用镍柱纯化,GFP的His-tag融合酶在与GFP-S1w相同的纯化条件下回收率仅有8%[12]。
2.5 S1vw对不同酶蛋白稳定性的影响
为比较S1w对不同酶的稳定性及催化活性的影响,测定纯化后的野生型PGL、LOX及融合酶的比酶活及半衰期。结果显示(图4和图5),PGL-S1w在60 ℃下的半衰期由5.2 min提高至16.43 min,比酶活279.14 U/mg提高至758.9 U/mg。LOX-S1w在50 ℃下半衰期由9.4 min提高至29.78 min,比酶活由32.5 U/mg提高至82.3 U/mg。此外,与PGL-S1和PGL-S11相比[12],S1w进一步促进了PGL的热稳定性和催化活性 (图4)。
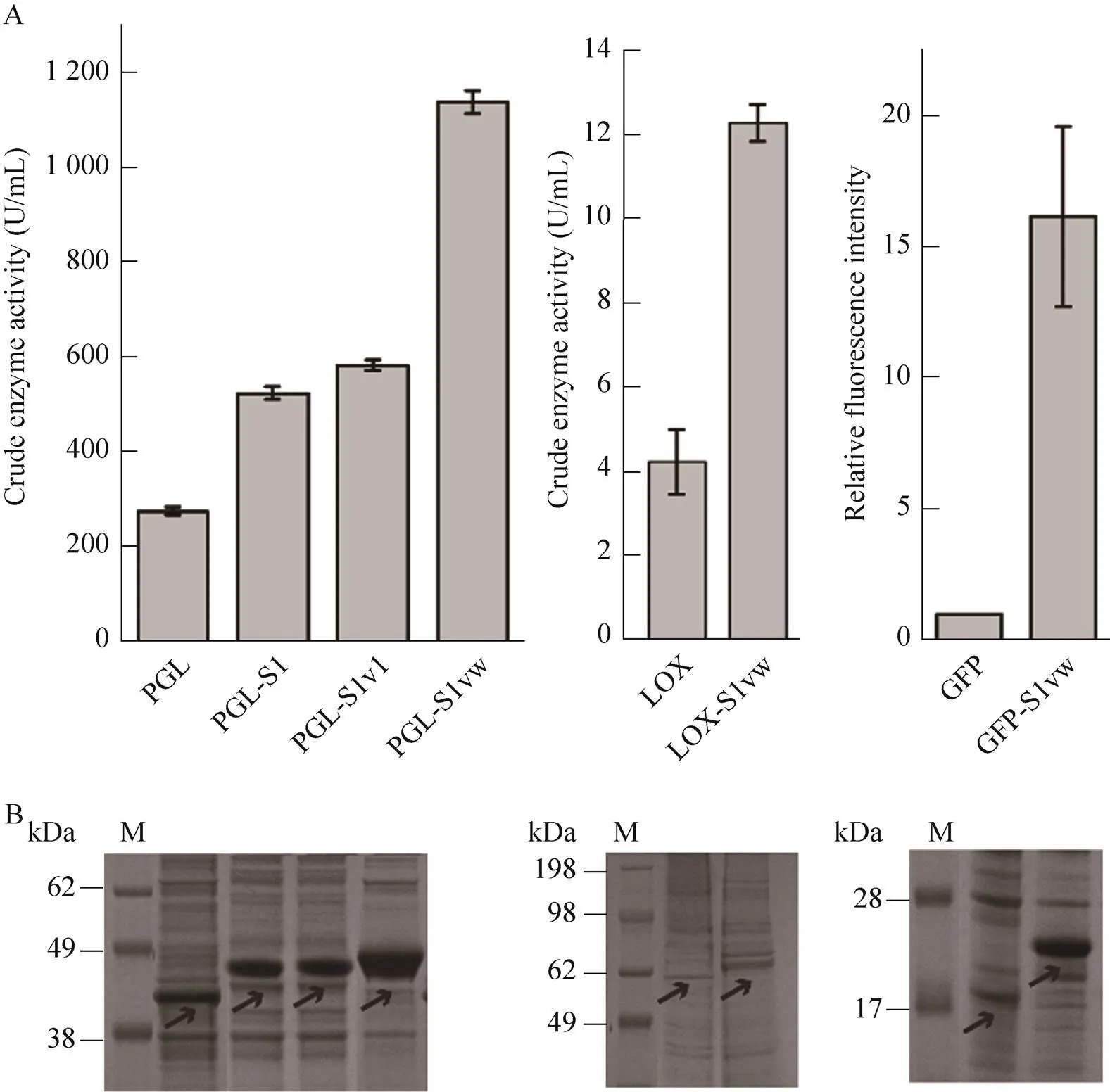
图2 酶/蛋白及其对应的SAPs融合酶表达量分析

表2 酶/蛋白纯化收率表

图3 酶/蛋白纯化后的SDS-PAGE图谱
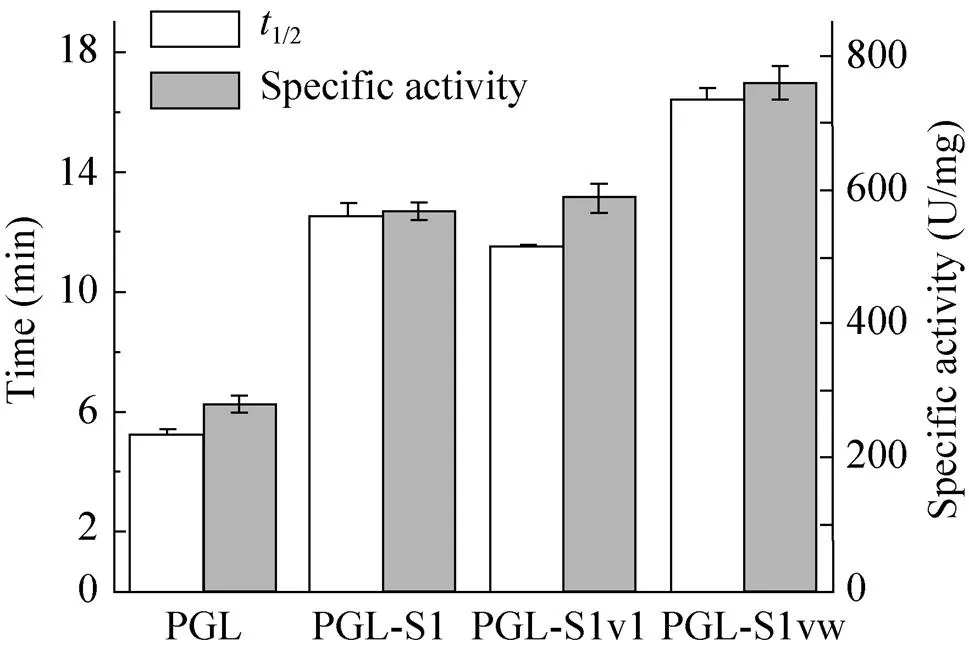
图4 PGL及其SAPs融合酶的半衰期与比酶活测定
2.6 S1vw在不同表达宿主中对融合酶表达量的影响
由于不同表达系统中异源蛋白的表达机制存在差异,故本研究以GFP为模式蛋白,比较S1w在不同宿主中(大肠杆菌、枯草芽孢杆菌和毕赤酵母)对GFP的表达量的影响。如图6所示,在大肠杆菌和枯草芽孢杆菌中,融合S1w后荧光强度显著提高,但在毕赤酵母表达系统中,GFP和GFP-S1w的荧光强度相近,说明S1w在原核表达体系中对其融合酶的表达量有促进作用,但对真核表达系统酶/蛋白异源表达的产量没有明显影响。
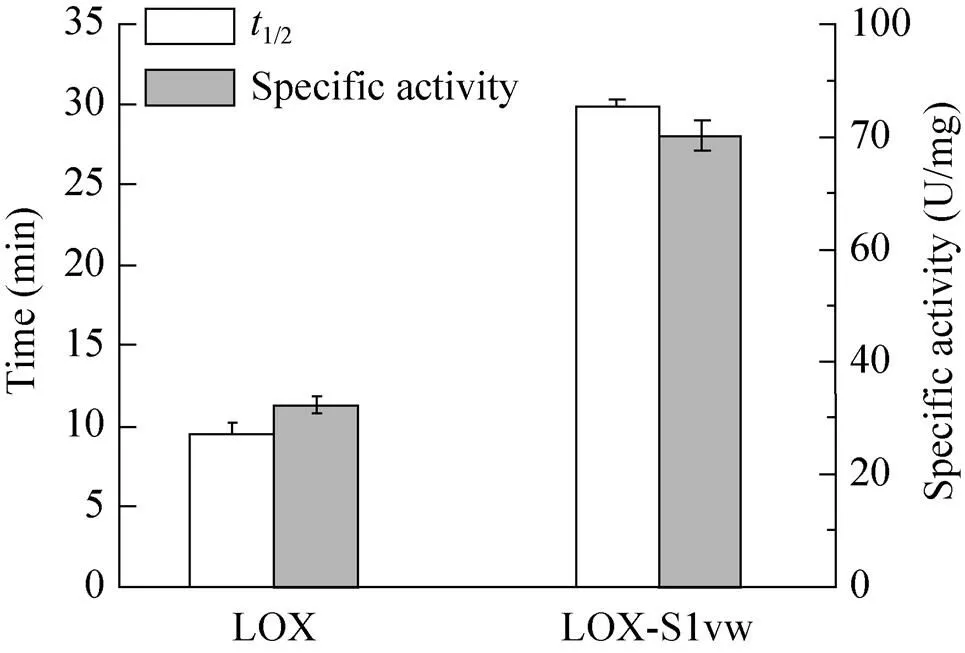
图5 LOX及其SAPs融合酶的半衰期与比酶活测定
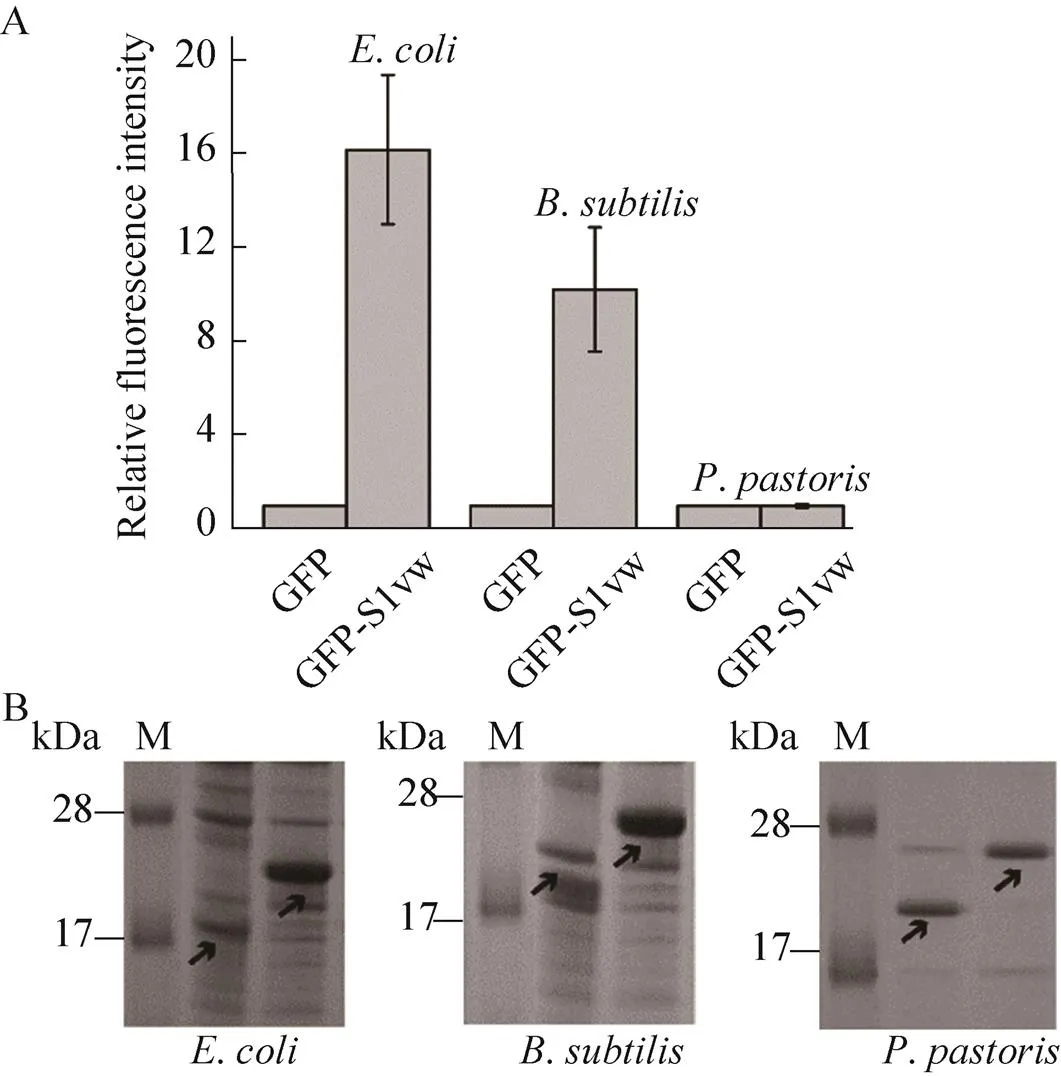
图6 GFP和GFP-S1vw在不同表达宿主中的表达量
3 讨论
酶的高表达、高稳定性、高效纯化工艺和循环利用技术是目前酶工程领域的主要研究方向。融合功能标签技术作为一种便捷、高效的酶蛋白改造策略也已经在该领域取得一定实效成果[23]。本研究在SAPs的前期研究的基础上[7, 12, 24],提出一种可促进在原核表达宿主中酶蛋白表达产量、提高融合酶稳定性并可用于镍柱纯化的多功能标签S1w。分别将S1w以PT-linker融合在PGL、LOX和GFP的N端,在大肠杆菌中培养发酵,与对应的野生型相比,粗酶活或荧光强度分别提高了3.1、1.89和16.22倍,且用镍柱进行亲和层析纯化达到了可观的回收率。PGL和LOX的融合酶在对应热处理条件下的半衰期分别提高了2.16倍和3.2倍。将GFP-S1w在枯草芽孢杆菌及毕赤酵母表达系统中表达,发现在枯草芽孢杆菌中融合酶表达量提高明显,但在毕赤酵母中表达量几乎没有改变。说明在原核表达体系中S1w可作为一种新型的促表达、稳定化和纯化的多功能标签。
S1类SAPs融合在酶蛋白N端时具有促进融合酶表达和稳定化的功能。为优化S1类SAPs的促表达特性,在S1w中引入不带电的天冬酰胺残基和带正电荷的精氨酸残基,并插入正电荷的组氨酸以便用于镍柱纯化,结果表明,优化之后的S1w促表达效果更加明显,这很有可能是S1w整体呈现净电荷为正的结果。但由于真核原核表达系统的差异,S1w在真核毕赤酵母中没有促表达的功能,这也为后续SAPs的促表达研究提供一定的研究方向。
尽管S1w整体带电情况发生改变,但其亲疏水性交替分布的形式仍然与S1和S11类似,并且保持了S1类SAPs的稳定化效果。SAPs内的疏水氨基酸残基对其融合酶形态至关重要,强疏水性的SAPs可直接导致活性包涵体的产生[24]。相比于S1和S11,S1w引入更多的疏水丙氨酸残基,故其稳定化功效进一步提高。
生物活性酶在工业生产中具有广泛的应用,酶的分离纯化是工业酶成本计算的重点考量指标之一。在所有酶的分离纯化方法中[25],亲和层析是相对简单和节约成本的方法,其中最常用的就是组氨酸标签亲和层析方法。在S1w中引入4个组氨酸,且均匀分布在S1w中,可提高组氨酸残基与镍柱的结合效率。此外,Slw融合酶的热稳定性较高,其在纯化过程中活性损失较小,有利于提高目的蛋白的回收率[26]。
多功能标签的融合可以在融合单一蛋白或短肽的同时实现多个酶/蛋白性质的优化,另一个明显的优势是可以减少由外来融合标签带来的空间组织(结构域)之间的相互影响,保持酶/蛋白原有催化或功能特性。因此,基于SAPs的多功能肽的开发将为酶或功能蛋白的改造研究提供新的技术手段和研究方向。
[1] Yu K, Liu CC, Kim BG, et al. Synthetic fusion protein design and applications. Biotechnol Adv, 2015, 33(1): 155–164.
[2] Kaur J, Kumar A, Kaur J. Strategies for optimization of heterologous protein expression in: roadblocks and reinforcements. Int J Biol Macromol, 2018, 106: 803–822.
[3] Zhang Q, Wu XY, Jiang XK, et al. Trend of hybrid enzyme design in the big data era. Chin J Biotech, 2018, 34(7): 1033–1045 (in Chinese). 张群, 吴秀芸, 蒋绪恺, 等. 大数据时代杂合酶的设计及其新趋势. 生物工程学报, 2018, 34(7): 1033–1045.
[4] Takano K, Okamoto T, Okada J, et al. Stabilization by fusion to the C-terminus of hyperthermophileRNase HI: a possibility of protein stabilization tag. PLoS ONE, 2011, 6(1): e16226.
[5] Lu XY, Liu S, Zhang DX, et al. Enhanced thermal stability and specific activity oflipoxygenase by fusing with self-assembling amphipathic peptides. Appl Microbiol Biotechnol, 2013, 97(21): 9419–9427.
[6] Zhao Q, Xu WH, Xing L, et al. Recombinant production of medium-to large-sized peptides inusing a cleavable self-aggregating tag. Microb Cell Fact, 2016, 15: 136.
[7] Zhao WX, Liu S, Liu LM, et al. Analysis of the factors influencing the expression of enzymes fused with self-assembling amphipathic peptides. Food Ferment Ind, 2017, 43(12): 1–6 (in Chinese). 赵伟欣, 刘松, 刘立明, 等. 自组装双亲短肽氨基酸组成及连接肽对其融合酶表达量的影响. 食品与发酵工业, 2017, 43(12): 1–6.
[8] Han RZ, Li JH, Shin HD, et al. Fusion of self-assembling amphipathic oligopeptides with cyclodextrin glycosyltransferase improves 2--D-glucopyranosyl-L-ascorbic acid synthesis with soluble starch as the glycosyl donor. Appl Environ Microbiol, 2014, 80(15): 4717–4724.
[9] Liu Y, Cui WJ, Liu ZM, et al. Enhancement of thermo-stability and product tolerance ofnitrile hydratase by fusing with self-assembling peptide. J Biosci Bioeng, 2014, 118(3): 249–252.
[10] Yang HQ, Lu XY, Liu L, et al. Fusion of an oligopeptide to the N terminus of an alkaline α-amylase fromsimultaneously improves the enzyme’s catalytic efficiency, thermal stability, and resistance to oxidation. Appl Environ Microbiol, 2013, 79(9): 3049–3058.
[11] Liu S, Wang MX, Du GC, et al. Improvement of thermal stability of alkaline polygalacturonate lyase by fusing with self-assembling amphipathic peptides. Food Ferment Ind, 2015, 41(11): 1–6 (in Chinese).刘松, 汪明星, 堵国成, 等. 融合自组装双亲短肽提高碱性果胶酶热稳定性. 食品与发酵工业, 2015, 41(11): 1–6.
[12] Zhao WX, Liu LM, Du GC, et al. A multifunctional tag with the ability to benefit the expression, purification, thermostability and activity of recombinant proteins. J Biotechnol, 2018, 283: 1–10.
[13] Goodman DB, Church GM, Kosuri S. Causes and effects of N-Terminal codon bias in bacterial genes. Science, 2013, 342(6157): 475–479.
[14] Zhong C, Wei P, Zhang YHP. Enhancing functional expression of codon-optimized heterologous enzymes inBL21(DE3) by selective introduction of synonymous rare codons. Biotechnol Bioeng, 2017, 114(5): 1054–1064.
[15] Chen X. Study on the expression and fermentation optimization of L-asparaginase inWB600[D]. Wuxi: Jiangnan University, 2015 (in Chinese).陈璇. L-天冬酰胺酶在WB600中的表达与发酵过程优化研究[D]. 无锡: 江南大学, 2015.
[16] Ren CH, Zhang J, Du GC, et al. Enhancing thermal stability of glucose oxidase by fusing amphiphilic short peptide. Chin J Biotech, 2018, 34(7): 1106–1116 (in Chinese). 任春慧, 张娟, 堵国成, 等. 基于融合双亲短肽提高葡萄糖氧化酶的热稳定性. 生物工程学报, 2018, 34(7): 1106–1116.
[17] Wang MX, Liu S, Liu L, et al. Fusions of amphipathic peptide to the alkaline polygalacturonate lyase fromsp. WSHB04-02 improves the production. J Food Sci Biotechnol, 2016, 35(5): 504–509 (in Chinese).汪明星, 刘松, 刘龙, 等. 融合短肽促进碱性果胶酶的高效表达. 食品与生物技术学报, 2016, 35(5): 504–509.
[18] Qiu FF. Study on the high-level expression and thermal stability oflipoxygenase[D]. Wuxi: Jiangnan University, 2017 (in Chinese).邱芳芳. 重组脂肪氧合酶的高效表达和热稳定性研究[D]. 无锡: 江南大学, 2017.
[19] Lu XY, Zhang J, Liu S, et al. Overproduction, purification, and characterization of extracellular lipoxygenase ofin. Appl Microbiol Biotechnol, 2013, 97(13): 5793-5800.
[20] O'Fágáin C. Enzyme stabilization-recent experimental progress. Enzyme Microb Technol, 2003, 33(2/3): 137–149.
[21] Charneski CA, Hurst LD. Positively charged residues are the major determinants of ribosomal velocity. PLoS Biol, 2013, 11(3): e1001508.
[22] Mei YZ, Chen YR, Zhai RY, et al. Cloning, purification and biochemical properties of a thermostable pectinase fromM29. J Mol Catal B: Enzymat, 2013, 94: 77–81.
[23] Kosobokova EN, Skrypnik KA, Kosorukov VS. Overview of fusion tags for recombinant proteins. Biochemistry (Moscow), 2016, 81(3): 187–200.
[24] Lin ZL, Zhou BH, Wu W, et al. Self-assembling amphipathic alpha-helical peptides induce the formation of active protein aggregates. Faraday Dis, 2013, 166: 243–256.
[25] Becker K, Van Alstine J, Bülow L. Multipurpose peptide tags for protein isolation. J Chromatogr A, 2008, 1202(1): 40–46.
[26] Farchaus JW, Ribot WJ, Jendrek S, et al. Fermentation, purification, and characterization of protective antigen from a recombinant, avirulent strain of. Appl Environ Microbiol, 1998, 64(3): 982–991.
Development of a purification tag to produce thermostable fused protein
Weixin Zhao, Song Liu, Liming Liu, Jian Chen, and Guocheng Du
School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China
Self-assembling amphipathic peptides (SAPs) have alternating hydrophilic and hydrophobic residues and can affect the thermal stabilities and catalytic properties of the fused enzymes. In this study, a novel multifunctional tag, S1w (HNANARARHNANARARHNANARARHNARARAR) was developed to modify fused enzymes. After fusing S1w at the enzymes/proteins N-terminus through a PT-linker, the crude enzymatic activities of polygalacturonate lyase and lipoxygenase were enhanced 3.1- and 1.89-fold, respectively, compared to the wild-type proteins. The relative fluorescence intensity of the green fluorescent protein was enhanced 16.22-fold. All the three S1w fusions could be purified by nickel column with high purities and acceptable recovery rates. Moreover, S1w also induced the thermostabilities enhancement of the fusions, with polygalacturonate lyase and lipoxygenase fusions exhibiting 2.16- and 3.2-fold increase compared with the corresponding wild-type, respectively. In addition, S1w could enhance the production yield of green fluorescent protein inandwhile the production of GFP and its S1w fusion changed slightly in. These results indicated that S1w could be used as a multifunctional tag to benefit the production, thermal stability and purification of the fusion protein in prokaryotic expression system.
self-assembling amphipathic peptides, fusion enzymes,production yield, thermal stability, purification, expression host
10.13345/j.cjb.180363
September 9, 2018;
November 5, 2018
National Natural Science Foundation of China (No. 31401638).
Song Liu. Tel: +86-510-85918307; Fax: +86-510-85918309; E-mail: liusong@jiangnan.edu.cn
Liming Liu. Tel/Fax: +86-510-85197875; E-mail: mingll@jiangnan.edu.cn
国家自然科学基金 (No. 31401638) 资助。
(本文责编 陈宏宇)
