毛竹茎秆伸长过程中赤霉素生物合成、降解和信号转导关键基因的鉴定及表达分析
2019-04-23叶家其张毓婷傅鹰周明兵汤定钦
叶家其,张毓婷,傅鹰,周明兵, 2,汤定钦
毛竹茎秆伸长过程中赤霉素生物合成、降解和信号转导关键基因的鉴定及表达分析
叶家其1,张毓婷1,傅鹰1,周明兵1, 2,汤定钦1
1 浙江农林大学 省部共建亚热带森林培育国家重点实验室,浙江 杭州 311300 2 浙江农林大学 浙江省竹资源与高效利用协同创新中心,浙江 杭州 311300

叶家其, 张毓婷, 傅鹰, 等. 毛竹茎秆伸长过程中赤霉素生物合成、降解和信号转导关键基因的鉴定及表达分析. 生物工程学报, 2019, 35(4): 647–666.Ye JQ, Zhang YT, Fu Y, et al. Genome-wide identification and expression analysis of gibberellin biosynthesis, metabolism and signaling family genes in Phyllostachys edulis. Chin J Biotech, 2019, 35(4): 647–666.
赤霉素 (Gibberellin) 是一类非常重要的植物激素,在高等植物生命活动的整个周期都起着重要的调控作用。从毛竹基因组中共鉴定出23个赤霉素途径基因,包括赤霉素生物合成相关的8个和1个基因、降解相关的8个基因、参与赤霉素感知的2个基因以及信号转导的2个基因和2个基因。拟南芥、水稻和毛竹的系统进化树和保守基序分析显示赤霉素的合成代谢与信号转导在这些物种中是高度保守的。利用外源赤霉素处理毛竹种子和幼苗,发现赤霉素能显著提高种子的萌发率和幼苗的茎秆伸长,并且有着最佳的作用浓度。在GA3处理后,毛竹体内赤霉素生物合成基因和表达量均下调而降解活性赤霉素的基因表达量上调;赤霉素受体和正调控基因的转录水平显著提高而负调控基因的表达受到抑制。这些基因在竹笋茎秆的不同形态学位置表达差异明显,大部分赤霉素生物合成与降解的相关基因、和以及赤霉素受体和正调控基因都在竹笋的形态学上端大量表达,而赤霉素信号转导的阻遏基因在笋体形态学底端大量积累而顶端基本不表达。
毛竹,赤霉素,生物合成,代谢,信号转导,基因表达
植物激素作为植物体内广泛存在的一类痕量信号分子,对于调节植物的各种生长发育过程和环境应答具有非常重要的作用[1]。赤霉素(Gibberellin,GA)是调控植物体生长发育必不可缺的一类植物激素,最早发现于水稻的“恶苗病”,患病水稻体内赤霉素过表达并且会出现疯长的现象[2]。目前已经鉴定的赤霉素有136种,按照它们被发现的顺序依次命名为GA1、GA2、GA3、GA4等[3-4],但其中只有GA1、GA3、GA4和GA7具有生物活性,其余均为GAs分子的代谢物和中间产物[5]。赤霉素在植物生长发育的各个阶段都发挥着重要作用,它参与调控植物生长发育的各种生理过程:如打破种子休眠并促进其萌发、植物生长、开花和果实发育等。其中最显著的作用是促进节间的伸长,从而促进植物的生长[6-7]。赤霉素作用可以通过不同的途径实现,主要包括赤霉素的合成代谢和极性运输,以及赤霉素信号途径,包括受体感知和信号转导。
赤霉素的主要合成部位为植株的幼嫩组织,如根尖、茎尖以及生长中的果实和种子等[8]。在高等植物中,根据赤霉素合成途径的亚细胞区域和该途径中所参与的酶的种类,赤霉素的生物合成分为3个阶段:1) 在质体中,4个类异戊二烯形成一个C20的线性分子,牦牛儿牦牛儿焦磷酸(Geranylgeranyl diphosphate,GGDP) 环化成赤霉素的前体——内根-贝壳杉烯酸(Ent-kaurenoic acid);2) 在质体折叠区和内质网中,内根-贝壳杉烯酸逐渐转变为第一种形式的GA——GA12;3) 在细胞溶质中,GA12先转变为C20-GA,然后转变为C19-GA,包括有活性的赤霉素。赤霉素的生物合成过程需要多种酶的参与,主要包括柯巴焦磷酸合酶(Ent-copalyl diphosphate synthase,CPS)、内根-贝壳杉烯合成酶(Ent-kaurene synthase,KS)、内根-贝壳杉烯氧化酶(Ent-kaurene oxidase,KO)、GA20-氧化酶(GA20-oxidase,GA20ox)、GA3-氧化酶(GA3-oxidase,GA3ox) 和GA2-氧化酶(GA2-oxidase,GA2ox) 等[8-9]。尽管赤霉素代谢途径早期代谢通量较大,但赤霉素后期的代谢酶(GA20ox、GA3ox、GA2ox) 对活性GA的精确调控具有关键作用[10]。活性赤霉素前体的合成过程都需要GA20ox的参与;GA20ox催化合成具有生物活性的赤霉素的倒数第二步,可以将GA12和GA53(C20类赤霉素) 转化为GA9和GA20(C19类赤霉素)[11]。GA3ox是赤霉素合成途径中最后一步的关键酶,进而将GA9和GA20催化合成为具有生物活性的GA1和GA4[12]。GA2ox是植物体内赤霉素降解过程的关键酶,它可以将具有生物活性的GA1和GA4分别转化为无活性的GA8和GA34,进而维持植物体内具有生物活性的GAs与其中间产物之间的动态平衡[13]。GA20ox和GA3ox的缺少,会导致合成有生物活性赤霉素的量减少;而过表达的GA2ox则会降解植物体内生物活性的赤霉素[14]。
植物体内GAs平衡的调控过程,信号通路同样发挥着重要的作用。赤霉素信号感知是植物体将细胞外赤霉素信号传入细胞内的过程。赤霉素GA信号可以被赤霉素受体GID1(Gibberellin insensitive dwarf1)感知到,当GID1感知到GA信号后,能够激活信号通路,从而调控下游基因的表达,进而影响植物的生长发育和形态建成。赤霉素信号转导的基因路径是GA-GID1-DELLA信号通路,组分包括赤霉素受体GID1、DELLA蛋白家族成员(DELLAs)以及与DELLA蛋白降解有关的带有F-Box基序的同源蛋白[15]。GA的信号转导是通过降解DELLA蛋白来实现的。当GA处于低水平时, GID1不与GA结合, 使DELLA蛋白与赤霉素应答基因结合并抑制其活性,进而阻遏植物的生长;当赤霉素处于高水平时,GID1可感知GA信号并与之结合形成GA-GID1,然后结合到DELLA蛋白中形成GID1-GA-DELLA复合三聚体[16]。当形成GA-GID1-DELLA 复合体时,F-Box蛋白中的泛素连接酶SCF能结合到DELLA蛋白的GRAS区域,通过泛素蛋白体通道迅速降解DELLA蛋白,导致其阻遏作用被解除,植物体表现出正常的赤霉素反应[15]。
近年来,在拟南芥[17]、水稻[18]、南瓜[19]、玉米[20]、大麦[21]、苹果[22]、小桐子[10]等多种植物中,赤霉素合成、降解与信号转导的基因家族已经被大量鉴定和克隆。而对于多年生木本植物毛竹,这方面的研究还甚少。毛竹作为世界上最重要的非木材林产品之一,以其茎秆的快速拔节生长而备受关注[23]。目前毛竹高生长的机制尚未完全了解,许多研究者认为植物内源激素,特别是生长素和赤霉素,在调节毛竹节间细胞伸长方面发挥着重要的作用[24]。在毛竹茎秆生长的过程中,赤霉素含量的动态变化与竹笋的快速生长有着密切的联系,毛竹笋生长初期,GA3含量较低;而到了毛竹快速生长阶段,GA3的含量急剧上升到了一个峰值[24]。因此,了解毛竹中赤霉素合成代谢途径与信号转导途径关键基因可以从分子水平上更深刻地理解赤霉素与毛竹快速伸长的作用机制。同时,毛竹的基因组序列已经被发布[25],为进行赤霉素基因家族相关基因全面分析提供了一个绝佳的机会。本研究对赤霉素的合成代谢以及信号转导相关基因进行鉴定,比较了毛竹与水稻和拟南芥在赤霉素合成代谢与信号转导相关基因的进化关系;通过实时荧光定量PCR检测了这些基因在外施赤霉素的毛竹实生苗和毛竹笋不同部位的表达特征,为深入探讨赤霉素调控竹子生长发育的机制奠定基础。
1 材料与方法
1.1 毛竹赤霉素生物合成与代谢及信号转导相关基因的数据获取及进化分析
1.1.1 同源基因的数据获取
从毛竹基因组数据库(BambooGDB,http://www.bamboogdb.org/)下载毛竹的基因注释和基因组序列。为了鉴定毛竹赤霉素途径中涉及的基因家族,从NCBI (https://www.ncbi.nlm.nih. gov/)、拟南芥信息资源(TAIR,https://www. arabidopsis.org/)、水稻基因数据库(RiceData,http://www.ricedata.cn/gene/) 和植物基因组数据库(http: //www.phytozome. net/)中下载相应GAs合成代谢和信号转导相关的氨基酸序列,作为BLAST软件搜索毛竹数据库的查询序列,搜索毛竹基因组数据库获得第一循环的候选基因;同时具有e≤10–20的和score≥100的序列被用作第二循环搜索的新查询以避免丢失额外的候选基因。利用Pfam (http://pfam.sanger.ac.uk/) 和SMART (http://smart.embl-heidelberg.de) 两个在线网站中验证这些候选基因,E值设定为 1.1.2 同源基因的进化分析和基序分布 将水稻和拟南芥中已经鉴定的上述基因的蛋白序列与上述毛竹中最终确定的同源基因的蛋白序列利用ClustalX 1.81进行多重比对,参数设定为默认值,将生成的“aln.”文件导入MEGA 7.0[26],并通过该软件中的邻接法(Neighbor-Joining,NJ)构建系统进化树。采用以下参数:模式采用“Poisson model”,缺口设置“Complete deletion”,重复次数为Bootstrap=1 000次。利用MEME在线软件(http://meme-suite.org/) 进行蛋白保守基序的分析,E值设定为 1.2.1 GA3处理种子的萌发率 试验所使用的毛竹种子是半同胞,2017年采自广西壮族自治区灵川县大境乡同一株开花毛竹,挑选大小一致的饱满种子作为试验材料。用70%酒精消毒种子表面60 s,灭菌水冲洗3遍;再用2% NaClO溶液浸泡10 min,灭菌水冲洗3遍,用不同浓度GA3(50 mg/L、100 mg/L、200 mg/L)溶液浸种,灭菌水浸种作为对照。每组选择100颗种子,黑暗浸泡24 h后用无菌水冲洗2–3次。置于灭菌的双层滤纸上萌发,萌发环境25 ℃并全程黑暗处理。每天检查并记录种子萌发数量,2周后统计种子发芽率,并进行差异显著性分析。 1.2.2 幼苗生长实验 为了确定GA3浓度对毛竹生长的影响,将毛竹种子在0、50、100、200 mg/L的赤霉素溶液中浸泡24 h并黑暗萌发2周后,每组选择萌发状态良好且一致的幼芽20颗,转移到光照培养室,培养条件为温度25 ℃,光周期为光照16 h、黑暗 8 h。4周后测量幼苗的根、茎、叶长度并进行差异显著性分析。根长为伸直的主根长度,茎长为根部以上到最近的第一片伸展叶片之间的距离,叶长为第二片伸展叶片的长度。 1.2.3 毛竹中赤霉素作用相关的基因对GA3的响应 在25 ℃培养室中16 h光照/8 h黑暗处理的条件下,在土壤中培育毛竹幼苗4周。用不同浓度的GA3(0、50、100、200 mg/L) 喷施叶片,以2 d的间隔喷施2周,在最后一次喷施后立即剪取毛竹幼苗的茎和叶组织用于下一步的RT-PCR分析;对于时间梯度的试验,4周龄幼苗用100 mg/L赤霉素喷施叶片,在不同的时间点(1、3、6、12、24 h)剪取毛竹幼苗的茎和叶组织,以4周龄喷施清水的毛竹幼苗作为对照[27]。试验的所有材料均采用3次生物学重复,剪取的幼苗叶片立即置于液氮速冻,−80 ℃保存。 采用Trizol (TaKaRa公司) 法提取毛竹幼苗的茎和叶组织的总RNA,用Prime ScriptTMRT Master Mix (TaKaRa公司) 去除基因组DNA和反转录合成cDNA。引物的设计选择在每个基因非保守区域,扩增片段均为150 bp左右,PCR检测引物特异性(表1)。反应体系(10 μL):5 μL SYBR®Premix ExTMII (TaKaRa公司),0.8 μL cDNA,0.4 μL primer-F,0.4 μL primer-R,3.4 μL 无菌水。反应条件为:95 ℃,7 min;预扩增95 ℃10 s,58 ℃ 10 s,72 ℃ 15 s,共40个循环。选取NTB为内参基因[28],以喷施清水的材料作为对照组设定为1,处理样品中每个基因的表达水平均以此为参照,以3次生物学重复结果用2-△△Ct的方法计算相对表达量[29],并进行差异显著性分析。 试验所采集的毛竹笋均来自于浙江农林大学亚热带森林培育国家重点实验室的翠竹园中,选取当年正处茎秆快速伸长的地径接近且株高150 cm左右的毛竹笋3株作为材料重复,以地面附近没有根的第一节定义为竹笋的第1节。每株笋按形态学位置自下而上分别取材第7节、第15节、第27节作为毛竹基部、中部和顶部的代表节间。RNA的提取和RT-PCR同1.2.3。采用均一化法比较每个基因在毛竹笋不同部位的表达量差异。将每个基因的表达量进行Z-score处理[30],使得每一个基因在所有样本的表达量都变成了均值为0、标准差为1的一组值。通过在线网站http://www. omicshare.com/tools/绘制表达量热图。 表1 引物序列 为了揭示赤霉素影响毛竹茎秆生长的作用,本研究搜索了毛竹全基因组,鉴定毛竹中的赤霉素关键基因。利用已知的拟南芥中26个GAs相关基因和水稻中12个GAs相关基因作为模板,经过Blastp检索,基于E值设定 2.1.1 赤霉素的生物合成基因 GA20ox和GA3ox家族基因调控赤霉素生物合成,对植物细胞中的赤霉素积累起着关键作用。它们都是由小基因家族编码,在不同的物种中有着各自的保守基序。图1为GA20ox蛋白家族在拟南芥、水稻和毛竹的进化树,显示各个基因在这3个物种中都比较保守,而毛竹与同为禾本科的水稻亲缘关系更为接近。其中PhGA20ox4、PhGA20ox6、PhGA20ox7、PhGA20ox8这4个蛋白序列的保守性比较低,并且MEME的基序搜索结果显示这4个基因的序列长度更短并且有保守基序的缺少现象。Motif 1、Motif 2和Motif 9在各个物种中高度保守,其中包含了与GA底物结合有关的LPWKET基序、H和D残基等(图1,表3)。 表2 赤霉素相关基因的鉴定及命名 GA3ox催化合成具有生物活性的GA1和GA4,是活性赤霉素合成途径的关键一步。进化关系显示GA3ox在不同的物种中高度保守,毛竹的蛋白序列与拟南芥和水稻的同源蛋白的相似度分别达到了76.77%和81.92%,并且它们都具有共同的保守基序(图2,表4)。 图1 GA20ox家族系统进化树和保守基序分析 表3 GA20ox保守基序注释 2.1.2 赤霉素的降解基因 调控GA降解的关键基因家族GA2ox在拟南芥、水稻和毛竹中的保守性较差,但共同含有几个重要的保守基序,如Motif 1和Motif 6存在于所有的基因中(图3,表5)。拟南芥GA2ox家族的基因普遍存在着Motif 10缺少现象,而水稻的基因家族缺少了Motif 9;同样在毛竹的PhGA2ox5、PhGA2ox7、PhGA2ox8蛋白存在着许多片段的丢失,表明该组基因在不同的物种中可能存在着部分功能的异化。 图2 GA3ox家族系统进化树和保守基序分析 表4 GA3ox保守基序注释 图3 GA2ox家族系统进化树和保守基序分析 表5 GA2ox保守基序注释 GA20ox、GA3ox、GA2ox这3类赤霉素氧化酶都属于2OG-Fe (Ⅱ) oxygenase亚家族,蛋白序列都含有2OG-Fe保守结构域。研究赤霉素氧化酶基因家族在拟南芥、水稻和毛竹这3个物种中的进化属性发现,功能不同的GA20ox、GA3ox、GA2ox聚类分布在不同的亚家族中(图4)。在3个物种中,GA20ox和GA2ox的基因数目均多于GA3ox,表明GA20ox和GA2ox经历了动态进化路线,导致更多功能的冗余。 2.1.3 赤霉素的信号转导基因 赤霉素信号通路的发现来源于对水稻赤霉素受体OsGID1的研究;相对于水稻,拟南芥中含有3种GID1的同源类似蛋白,分别是AtGID1A、AtGID1B和AtGID1C。通过蛋白序列同源比对,在毛竹基因组文库种找到2个GID1成员,命名为PhGID1A和PhGID1B,与水稻同源蛋白的相似性分别为89.34%和80.87%。系统进化树与保守基序的分析均显示GID1在不同的物种中高度保守(图5,表6)。 在毛竹基因组文库中找到了2个DELLA的成员,命名为PhSLR1和PhGAI。构建的系统演化树(图6) 显示毛竹的DELLA类基因与水稻更加近缘;并且在毛竹的2个DELLA蛋白都存在着保守序列的缺少现象,其中PhSLR1蛋白中缺少了Motif 1、5、8、10;而PhGAI蛋白中缺少了Motif 4、6、7、10,可能它们上功能上出现了异化和互补(表7)。 F-Box蛋白在毛竹基因组文库中有了2个F-Box的成员,命名为PhGID2A和PhGID2B,其中PhGID2A与水稻同源性更高而PhGID2B与拟南芥更加近缘。F-Box家族蛋白序列长度短且保守基序数目少,但是在不同的物种中具有着高度的保守性(图7,表8)。 2.2.1 生长参数统计 将记录的种子萌发数据进行统计,分别计算不同浓度处理后的种子萌发率,结果显示GA3处理显著提高了毛竹种子的萌发率(图8A)。100 mg/L处理组的萌发率最高,达到了67%,50 mg/L处理组和200 mg/L处理组的萌发率分别是59%和54%,均高于对照组的43%,说明在一定范围内不同浓度的赤霉素浸泡毛竹种子均能提高其种子萌发率且种子萌发的最佳赤霉素浓度在100 mg/L左右。200 mg/L处理组的萌发率虽高于对照组但已呈现下降趋势,说明过高浓度的赤霉素反而会造成生长逆境,抑制种子的萌发。 图4 GA2ox、GA3ox和GA20ox的系统进化树 同时,用不同浓度的GA3浸泡毛竹种子,萌发后的毛竹幼苗的根茎叶长度都有所增加(图8B–D。茎长和叶长增加效果显著,3个处理组的主茎长度分别提高了44.0%、55.1%、50.1%;主叶长度分别提高了41.4%、62.9%、55.9%。赤霉素浓度在100 mg/L时茎与叶达到最佳的生长效果,200 mg/L赤霉素处理虽然促进效果仍显著,但是相比 100 mg/L已经有了一定程度的抑制。而根系的增长效果不明显,3个处理组仅分别增加了1.8%、4.8%、5.4%。表明外源赤霉素可以有效刺激毛竹的营养生长,明显促进了茎和叶的生长,但对根的生长基本无促进作用。另外,赤霉素处理的毛竹幼苗,“疯长”现象仅体现在垂直方向上的高度,茎秆细长没有粗度上的增加,并且大量出现倒伏现象。 2.2.2 外源GA3处理下赤霉素作用相关基因的表达变化 通过qRT-PCR检测不同浓度(0、50、100、200 mg/L) 赤霉素GA3处理下、、、、和的相对表达量 (图9)。 图5 GID1家族系统进化树和保守基序分析 表6 GID1保守基序注释 图6 DELLA家族系统进化树和保守基序分析 应用外源性赤霉素GA3处理后,的表达量显著下调,且外源赤霉素浓度越高其表达水平越低。相一致的是,参与赤霉素生物合成的基因在各个浓度处理组中也都显示下调。而在GA3处理后的幼苗中表达量升高,并且在高浓度处理组的表达量更高。至于信号转导的相关基因,的相对表达量受到了GA3严格的负反馈,各个浓度的处理组与对照组相比全部下调表达;而GA3处理却使表现为极显著的上调表达,200 mg/L处理组的表达量达到了对照组的2.7倍。赤霉素受体对外源GA3的浓度变化不敏感,在各个处理组的表达量都略高于对照组。 表7 DELLA保守基序注释 图7 F-Box家族系统进化树和保守基序分析 表8 F-Box保守基序注释 对4周龄毛竹幼苗喷施100 mg/L GA3,通过qRT-PCR检测其在处理后不同时期(0、1、3、6、12、24 h)、、、、和的相对表达量(图10)。结果显示这些基因在GA3处理后的24 h内表达量都发现了显著的变化。赤霉素生物合成相关基因和整体呈表达量下调趋势。其中在处理后3 h表达量达到最低,仅为对照的43.8%,之后开始升高但仍低于未处理组,处理后24 h的表达量为未处理时的80.1%;而对GA3的响应有一个更为复杂的过程,其表达量也是在3 h时达到最低,只有对照组的32.9%,而6 h时恢复到了未处理时的表达水平,随后在12 h和24 h又出现了明显的降低和升高,最终在24 h时的表达量开始相比未处理时提高了38.9%。赤霉素代谢基因在GA3处理后表达量开始显著上调,1 h时的表达量比对照提高了67.0%,随后开始持续下降,12 h后的表达量下降到了未处理时的水平,24 h后表达量为对照的111.5%。赤霉素受体基因在外源赤霉素处理过程中变化相对温和,在最初的1 h和3 h,表达量比对照下降了18.2%和30.8%,6 h时的表达量升高到了未处理时的111.6%,12 h开始略微下降,24 h时又逐渐升高到了未处理时的125.7%。在处理后的各个时间段均表达上调,1 h时表达量上调10.9%,3 h时已急剧上升为对照的237.8%,达到最高,随后逐渐下降但所有处理时间段表达量均高于未处理组,24 h表达量降至对照的121.6%。类基因表达量随时间不断呈现下调-上调-下调的趋势,然而在每个时间段的表达量均未高于对照组,最低的表达量出现在6 h,为对照组的45.4%。 赤霉素关键基因在1.5 m高毛竹笋3个节间均检测到表达,并且各个基因的表达趋势在3株重复中具有较好的一致性,推测这些基因在毛 竹快速生长的过程都发挥着一定的作用(图11)。赤霉素生物合成相关的基因家族和在毛竹笋的不同部位都高表达,尤其是在顶部和中部;而调控赤霉素失活的基因家族也在毛竹笋的形态学上端高表达。赤霉素受体表达主要集中在顶部和中部,基部基本上没有检测到表达。在3个部位也都有表达,其中顶部的表达量最高,基部表达量最低,但不同部位的表达差异不是很明显;而相关基因在根部的表达量显著高于顶部及中部。可以看出,与的表达具有一致性,而与的表达趋势相反。 图8 GA3处理对毛竹种子萌发率和幼苗生长的影响 图9 不同浓度GA3处理4周龄毛竹幼苗后的基因表达水平分析 毛竹是我国分布面积最广且经济价值最高的竹种,毛竹笋的生长速度很快,高生长时期每天净高度增长量高达50 cm以上,这种快速生长的机理具有重要的学术研究价值。前人的大量研究发现,毛竹的高生长过程伴随着赤霉素等植物激素含量的急剧增加[24, 31],因此推测赤霉素在毛竹的快速生长中发挥着重要的作用。在竹笋快速生长过程中,对赤霉素动态变化及其关键基因表达量变化的研究有助于我们了解毛竹茎秆快速伸长的机制。 图10 GA3处理后不同时间段的基因表达水平分析 通过生物信息学分析,从毛竹基因组中共鉴定出了17个赤霉素合成代谢基因和6个信号转导的相关基因。相比于拟南芥、水稻、玉米等植物,毛竹基因组更为庞大,但是参与赤霉素生物合成和信号转导的基因成员数量却较少,尤其是GA3氧化酶家族,仅检索到了1位成员。这可能是由于本次研究删去了大量序列相似性较低的同源基因以及冗余基因,并且当前的毛竹基因组存在着个别序列的注释信息不完全和CDS缺失等组装问题。另一种假设是由于物种分化后,草本植物中竹子在蛋白质直系同源簇数据库(COGs)的构建和扩增中种类数量最多[25],因此导致毛竹中的基因家族比其他物种更加分散和极化。拟南芥、水稻和毛竹的赤霉素相关基因的系统发育分析显示赤霉素的合成代谢与信号传导途径基因在这些物种中是高度保守的。而毛竹的大多数基因与水稻的同源基因相似性更高,可能毛竹与水稻的赤霉素关键基因在进化关系上有着共同的祖先[32],而序列的高保守性预示着功能的保守性。 图11 赤霉素关键基因在毛竹笋不同部位的表达分析 赤霉素参与调控植物生理发育的各个过程,包括种子萌发、根的生长、茎的伸长和叶片伸展等。王巍等[33]用不同浓度的GA3处理核桃种子,发现300 mg/L的GA3处理组发芽率最高达到了87.2%。高春智等[34]在樟子松上的研究也表明,喷施GA3能显著提高樟子松种子的发芽率。毛竹自然结实率低且种子采集困难,室温贮藏还会使种子丧失发芽能力,这些都在一定程度上限制了毛竹实生苗的培育工作。本研究用不同浓度的GA3处理毛竹种子的实验也同样表明,用不同浓度的GA3浸种后促进了毛竹种子的萌发并且 100 mg/L GA3的促进效果最显著,并且有着最佳的浓度范围。吴建明等[35]研究发现赤霉素处理可以诱导甘蔗节间伸长,增加株高;杨益善等[36]在水稻上的研究也发现,赤霉素可以促进水稻茎的伸长。我们同时比较了不同浓度GA3浸种处理对毛竹幼苗根、茎、叶生长的影响,结果与GA3对发芽的效应一致,赤霉素处理后的毛竹茎和叶的伸长促进效果明显,并且最适浓度在100 mg/L左右,而对根的影响效果不明显。总之,赤霉素处理对毛竹种子的萌发与幼苗的生长均有明显的促进作用。 参与毛竹生物合成的相关基因对于外源GA3的响应有着协调一致性,外施GA3使毛竹幼苗内的赤霉素生物合成基因和表达量明显下调,并且浓度越高对基因表达的抑制作用越明显;相反,催化植物中活性GAs灭活的基因在高浓度的处理组表达量更高。同时对GA3处理后的5个时期的表达量进行测定,发现表达量先下调后上调,整体表现下调趋势,而的表达量整体呈上调趋势。这与前人关于赤霉素处理植物的结论相同,Carrera等[37]研究表明,马铃薯的gal矮化突变体具有较高的GA-20氧化酶转录水平,外施GA3后,3种GA-20氧化酶 (StGA20ox1、StGA20ox2和StGA20ox3) 在马铃薯gal突变体内表达明显减少;董凤等[22]对苹果的研究也发现外施赤霉素会使表达量减少而表达增高。与的表达趋势不同,的表达量在处理后的某段时期还出现了升高的现象,可能是因为作为赤霉素生物合成的最后一步,在赤霉素含量骤然升高或降低时,起着更重要的反调节作用,从而维持植物体内赤霉素的平衡[38]。并且,在外界GA3的刺激下,大量赤霉素受体基因与赤霉素相结合,导致赤霉素受体基因的表达量升高,结果与李俊等[39]东方山羊豆在GA3处理下的基因表达水平相一致。总之,当外施GA3时,一方面毛竹幼苗通过抑制体内赤霉素合成反应并加强体内活性赤霉素灭活基因的表达,来实现植物体内GA水平的稳态平衡;另一方面,赤霉素受体基因及正调控因子基因的表达水平显著提高,解除了DELLA蛋白的积累对毛 竹生长的阻遏作用,植株表现出正常的赤霉素 反应。 本研究选取了快速生长时期毛竹笋的基部、中部和顶部节间进行qRT-PCR分析,通过组织特异性分析发现,在毛竹笋快速生长阶段的3个节间,赤霉素合成代谢与信号转导途径关键酶基因的表达量均发生了一定变化。生物合成相关基因家族和在毛竹笋的形态学上部都过量表达,为顶端节间的伸长提供了充足的内源激素;而调控赤霉素代谢的基因家族在中部和顶部也高表达,毛竹笋幼嫩部位的生命活动最旺盛,大量合成赤霉素,的高表达能够将过量合成的赤霉素进行降解[13]。丁兴萃[31]曾分析了毛竹笋各部位的内源激素含量及动态变化,发现在竹笋生长初期,赤霉素在笋尖合成,通过极性运输到中部,一般赤霉素在各个部位的含量为顶部>中部>基部。而本研究从合成代谢关键基因进行分析,发现基因表达模式和赤霉素体内含量分布一致。信号转导途径的基因和在笋的各个部位也都有表达,并且在笋顶部和中部表达要明显高于基部。而DELLA类蛋白相关基因表达趋势相反,在毛竹笋形态学上部的中部和顶部表达量非常低甚至没有检测到表达。这三类基因已在其他物种中广泛报道,的大量表达抑制植物的生长伸长,是赤霉素的负调控基因;GID1是赤霉素的受体,能够感知赤霉素信号并介导DELLA类蛋白的泛素化降解;GID2是降解DELLA蛋白的泛素酶体复合物的主要成分,DELLA的降解使赤霉素得以大量表达并诱导植物快速生长[15, 40]。毛竹笋中赤霉素信号转导途径相关基因的表达模式与其生物学功能也是相吻合的:毛竹笋进入快速生长阶段,笋尖大量合成赤霉素,PhGID1大量表达并接收赤霉素信号,然后与DELLA蛋白形成GID1-GA-DELLA复合体,阻止赤霉素信号的传递;此时大量表达的将DELLA蛋白泛素化标记并介导其降解,DELLA的阻遏作用解除,赤霉素大量表达,笋开始快速生长。 本研究对赤霉素生物合成与信号转导途径的相关基因家族在毛竹中的同源基因进行了系统的鉴定,找到了6个多基因家族编码的蛋白,包括参与赤霉素合成代谢的GA20ox、GA3ox和GA2ox以及信号转导途径的GID1、GID2和DELLA蛋白。并初步探索了外源赤霉素处理对毛竹种子萌发的影响,证明了赤霉素在毛竹中也有着促进种子萌发和促进茎秆伸长等作用,且有最佳的浓度范围;同时,外施赤霉素会引起毛竹体内赤霉素相关基因表达模式变化,植物体通过反馈调节的方式控制体内活性GA的平衡。另外,本研究还发现了大量的赤霉素类基因参与到毛竹的快速生长这一复杂的生理过程中,并且基因的表达模式与毛竹体内的赤霉素含量分布一致,也与其生物学功能一致,为深入探讨赤霉素调控竹子生长发育的机制奠定了基础。但是,本研究尚未进行基因克隆等方面的分析,在后续的试验中应当重点关注。 [1] Hedden P, Thomas SG. Gibberellin biosynthesis and its regulation. Biochem J, 2012, 444(1): 11–25. [2] Silverstone AL, Sun TP. Gibberellins and the green revolution. Trends Plant Sci, 2000, 5(1): 1–2. [3] Reinecke DM, Wickramarathna AD, Ozga JA, et al.gene expression patterns influence gibberellin biosynthesis, growth, and development in pea. Plant Physiol, 2013, 163(2): 929–945. [4] Phinney BO, West CA, Ritzel M, et al. Evidence for “Gibberellin-like” substances from flowering plants. Proc Natl Acad Sci USA, 1957, 43(5): 398–404. [5] Eriksson S, Böhlenius H, Moritz T, et al. GA4is the active gibberellin in the regulation oftranscription andfloral initiation. Plant Cell, 2006, 18(9): 2172–2181. [6] Law DM, Davies J. Comparative indole-3-acetic acid levels in the slender pea and other pea phenotypes. Plant Physiol, 1990, 93(4): 1539–1543. [7] Lange MJP, Lange T. Gibberellin biosynthesis and the regulation of plant development. Plant Biol, 2006, 8(3): 281–290. [8] Achard P, Cheng H, de Grauwe L, et al. Integration of plant responses to environmentally activated phytohormonal signals. Science, 2006, 311(5757): 91–94. [9] Okada K, Saito T, Nakagawa T, et al. Five geranylgeranyl diphosphate synthases expressed in different organs are localized into three subcellular compartments in Arabidopsis. Plant Physiol, 2000, 122(4): 1045–1056. [10] Gao CC, Ni J, Chen MS, et al. Characterization of genes involved in Gibberellin metabolism and signaling pathway in the biofuel plant. Plant Diver Resour, 2015, 37(2): 157–167 (in Chinese). 高聪聪, 倪军, 陈茂盛, 等. 能源植物小桐子赤霉素合成代谢及信号转导相关基因的鉴定及序列分析. 植物分类与资源学报, 2015, 37(2): 157–167. [11] Hedden P, Phillips AL. Gibberellin metabolism: new insights revealed by the genes. Trends Plant Sci, 2000, 5(12): 523–530. [12] Vagts DA, Iber T, Szabo B, et al. Effects of epidural anaesthesia on intestinal oxygenation in pigs. Br J Anaesth, 2003, 90(2): 212–220. [13] Wuddineh WA, Mazarei M, Zhang JY, et al. Identification and overexpression of-() in switchgrass (.) for improved plant architecture and reduced biomass recalcitrance. Plant Biotechnol J, 2015, 13(5): 636–647. [14] Eriksson ME, Israelsson M, Olsson O, et al. Increased gibberellin biosynthesis in transgenic trees promotes growth, biomass production and xylem fiber length. Nat Biotechnol, 2000, 18(7): 784–788. [15] Fleet CM, Sun TP. A DELLAcate balance: the role of gibberellin in plant morphogenesis. Curr Opin Plant Biol, 2005, 8(1): 77–85. [16] Zentella R, Zhang ZL, Park M, et al. Global analysis of DELLA direct targets in early gibberellin signaling in. Plant Cell, 2007, 19(10): 3037–3057. [17] Phillips AL, Ward DA, Uknes S, et al. Isolation and expression of three gibberellin 20-oxidase cDNA clones from Arabidopsis. Plant Physiol, 1995, 108(3): 1049–1057. [18] Sakai M, Sakamoto T, Saito T, et al. Expression of novel rice gibberellin 2-oxidase gene is under homeostatic regulation by biologically active gibberellins. J Plant Res, 2003, 116(2): 161–164. [19] Lange MJP, Liebrandt A, Arnold L, et al. Functional characterization of gibberellin oxidases from cucumber,L. Phytochemistry, 2013, 90: 62–69. [20] Rodrigo MJ, García-Martínez JL, Santes CM, et al. The role of gibberellins A1and A3in fruit growth ofL. and the identification of gibberellins A4and A7in young seeds., 1997, 201(4): 446–455. [21] Umetsu A, Sawada Y, Mitsuhashi W, et al. Characterization of a loss-of-Function mutant of gibberellin biosynthetic gene LsGA3ox1 in lettuce. Biosci Biotechnol Biochem, 2011, 75(12): 2398–2400. [22] Dong F, Fan S, Ma XL, et al. Genome-wide identification and expression analysis of,andin apple. Acta Horticult Sin, 2018, 45(4): 613–626 (in Chinese).董凤, 樊胜, 马小龙, 等. 苹果赤霉素氧化酶基因、和家族全基因组鉴定及表达分析. 园艺学报, 2018, 45(4): 613–626. [23] Ogita S, Nomura T, Kishimoto T, et al. A novel xylogenic suspension culture model for exploring lignification in. Plant Methods, 2012, 8: 40. [24] Cui K. The mechanism research of fast-growing culms of[D]. Beijing: Chinese Academy of Forestry, 2011 (in Chinese).崔凯. 毛竹茎秆快速生长的机理研究[D]. 北京: 中国林业科学研究院, 2011. [25] Peng ZH, Lu Y, Li LB, et al. The draft genome of the fast-growing non-timber forest species moso bamboo (). Nat Genet, 2013, 45(4): 456–461. [26] Tamura K, Dudley J, Nei M, et al. MEGA4: Molecular evolutionary genetics analysis (MEGA) software version 4.0. Mol Biol Evolut, 2007, 24(8): 1596–1599. [27] Wang WJ, Gu LF, Ye SW, et al. Genome-wide analysis and transcriptomic profiling of the auxin biosynthesis, transport and signaling family genes in moso bamboo (). BMC Genomics, 2017, 18: 870. [28] Qi FY, Hu T, Peng ZH, et al. Screening of reference genes used in qRT-PCR and expression analysis ofgene in Moso bamboo. Acta Bot Boreali-Occident Sin, 2013, 33(1): 48–52 (in Chinese).齐飞艳, 胡陶, 彭镇华, 等. 毛竹实时荧光定量PCR内参基因的筛选及成花基因表达分析. 西北植物学报, 2013, 33(1): 48–52. [29] Hersperger AR, Makedonas G, Betts MR. Flow cytometric detection of perforin upregulation in human CD8 T cells. Cytometry A, 2010, 73(11): 1050–1057. [30] Zhao M, Chen O, Jin CS, et al. Study on decrease in Hrad17 expression in head and neck squamous carcinoma. Chin J Lab Diag, 2010, 14(9): 1380–1383 (in Chinese).赵明, 陈鸥, 金春顺, 等. Hrad17在头颈肿瘤中表达下降的研究. 中国实验诊断学, 2010, 14(9): 1380–1383. [31] Ding XC. Dynamic analysis for endogenous phytohormones of bamboo shoot () during different growth and differentiation state. J Bamboo Res, 1997, 16(2): 53–62 (in Chinese). 丁兴萃. 毛竹笋体生长发育过程中内源激素的动态分析. 竹子学报, 1997, 16(2): 53–62. [32] Li SX, Yin TM, Zou HY, et al. Preliminary study on molecular systematics of bamboo by SSR primers derived from rice. Sci Sil Sin, 2002, 38(3): 42–48 (in Chinese).李淑娴, 尹佟明, 邹惠渝, 等. 用水稻微卫星引物进行竹子分子系统学研究初探. 林业科学, 2002, 38(3): 42–48. [33] Wang W. Effect of different concentration treatments of GA3on seed germination and seedling growth ofL. J Hebei For Sci Technol, 2017, (1): 36–38 (in Chinese).王巍. 不同浓度赤霉素处理对核桃种子萌发及幼苗生长的影响. 河北林业科技, 2017, (1): 36–38. [34] Gao CZ, He YH, Tian YL, et al. Effect of different concentration of gibberellin on the seed germination ofvar.Litv. J Inner Mongolia Agric Univ, 2012, 33(3): 67–72 (in Chinese).高春智, 何炎红, 田有亮, 等. 不同浓度赤霉素浸种对樟子松种子萌发的影响. 内蒙古农业大学学报, 2012, 33(3): 67–72. [35] Wu JM, Li YR, Yang L, et al. Relationship between gibberellin-induced internode elongation and endogenous hormone changes in Sugarcane. Chin J Trop Crops, 2009, 30(10): 1452–1457 (in Chinese).吴建明, 李杨瑞, 杨柳, 等. 赤霉素诱导甘蔗节间伸长与内源激素变化的关系. 热带作物学报, 2009, 30(10): 1452–1457. [36] Yang YS, Xia JH, Tian JW, et al. Effects of spraying stage of gibberellin acid 3 on the internode elongation and heading related traits of PTGMS lines in rice. Res Agric Modern, 2015, 36(6): 1099–1104 (in Chinese). 杨益善, 夏俊辉, 田继微, 等. 赤霉素喷施时期对水稻光温敏核不育系节间伸长和抽穗相关性状的影响. 农业现代化研究, 2015, 36(6): 1099–1104. [37] Carrera E, Jackson SD, Prat S. Feedback control and diurnal regulation of gibberellin 20-oxidase transcript levels in potato. Plant Physiol, 1999, 119(2): 765–773. [38] Yang YH, Xu H, Chen DF, et al. Research advances on the gene for gibberellin 3-beta-dioxygenase in higher plants. Biotechnol Bulletin, 2018, 34(4): 1–6 (in Chinese).杨意宏, 徐浩, 陈端芬, 等. 高等植物赤霉素3-β- 双氧化酶基因研究进展. 生物技术通报, 2018, 34(4): 1–6. [39] Li J, Wen HY, Gao HW, et al. Construction of plant expression vector of GOGID gene and transformation ofL. Acta Agrest Sin, 2015, 23(1): 167–172 (in Chinese).李俊, 温红雨, 高洪文, 等. 东方山羊豆GOGJD基因表达载体构建及紫花苜蓿转化. 草地学报, 2015, 23(1): 167–172. [40] Sun TP. Gibberellin-GID1-DELLA: a pivotal regulatory module for plant growth and development. Plant Physiol, 2010, 154(2): 567–570. Genome-wide identification and expression analysis of gibberellin biosynthesis, metabolism and signaling family genes in Jiaqi Ye1, Yuting Zhang1, Ying Fu1, Mingbing Zhou1, 2, and Dingqin Tang1 1 State Key Laboratory of Subtropical Silviculture, Zhejiang A&F University, Hangzhou 311300, Zhejiang, China 2 Zhejiang Provincial Collaborative Innovation Center for Bamboo Resources and High-Efficiency Utilization, Zhejiang A&F University, Hangzhou 311300, Zhejiang, China Gibberellin is an essential plant hormone that plays an important regulatory role throughout the life cycle of higher plants. A total of 23 genes involved in gibberellin action were identified fromgenome, including 8and 1genes involved in the gibberellin biosynthesis, 8genes involved in the metabolism of gibberellin, 2genes involved in gibberellin perception, 2genes and 2genes involved in gibberellin signal transduction. Phylogenetic analysis of these genes from,andrevealed that gibberellin biosynthesis, metabolism, and signaling pathways are conserved in these species. Treatment of seeds and seedlings of bamboo with exogenous gibberellin revealed that gibberellin significantly increased seed germination rate and stem elongation of seedlings, and had the best concentration of action. The expression levels ofandgenes in the bamboo seedlings were down-regulated and the expression of the active gibberellin-degrading genewas up-regulated after GA3treatment, and the transcriptional level of the gibberellin receptorand the positive regulatory genewas significantly increased while the expression of the negative regulatory genewas decreased. These genes have significant differences in the expression of different spatial locations of bamboo shoot stems,,,,andare all expressed in the upper part of bamboo shoots, while the repressor geneaccumulates at the bottom of the shoots and is hardly expressed at the top. , gibberellin, biosynthesis, metabolism, signal transduction, gene expression 10.13345/j.cjb.180424 October 15, 2018; January 14, 2019 National Natural Science Foundation of China (Nos. 31500542, 31870656, 31470615), Zhejiang Provincial Natural Science Foundation of China (No. 2016C02056-8). Mingbing Zhou. Tel: +86-571-63743869; E-mail: zhoumingbing@zafu.edu.cn Dingqin Tang. Tel: +86-571-63748811; E-mail: tang@zafu.edu.cn 国家自然科学基金 (Nos. 31500542,31870656,31470615),浙江自然科学基金 (No. 2016C02056-8) 资助。 2019-02-14 http://kns.cnki.net/kcms/detail/11.1998.q.20190212.1446.001.html (本文责编 郝丽芳)1.2 毛竹种子与GA3处理
1.3 毛竹不同节间中赤霉素相关基因的表达分析

2 结果与分析
2.1 毛竹基因组中赤霉素作用关键基因家族的鉴定

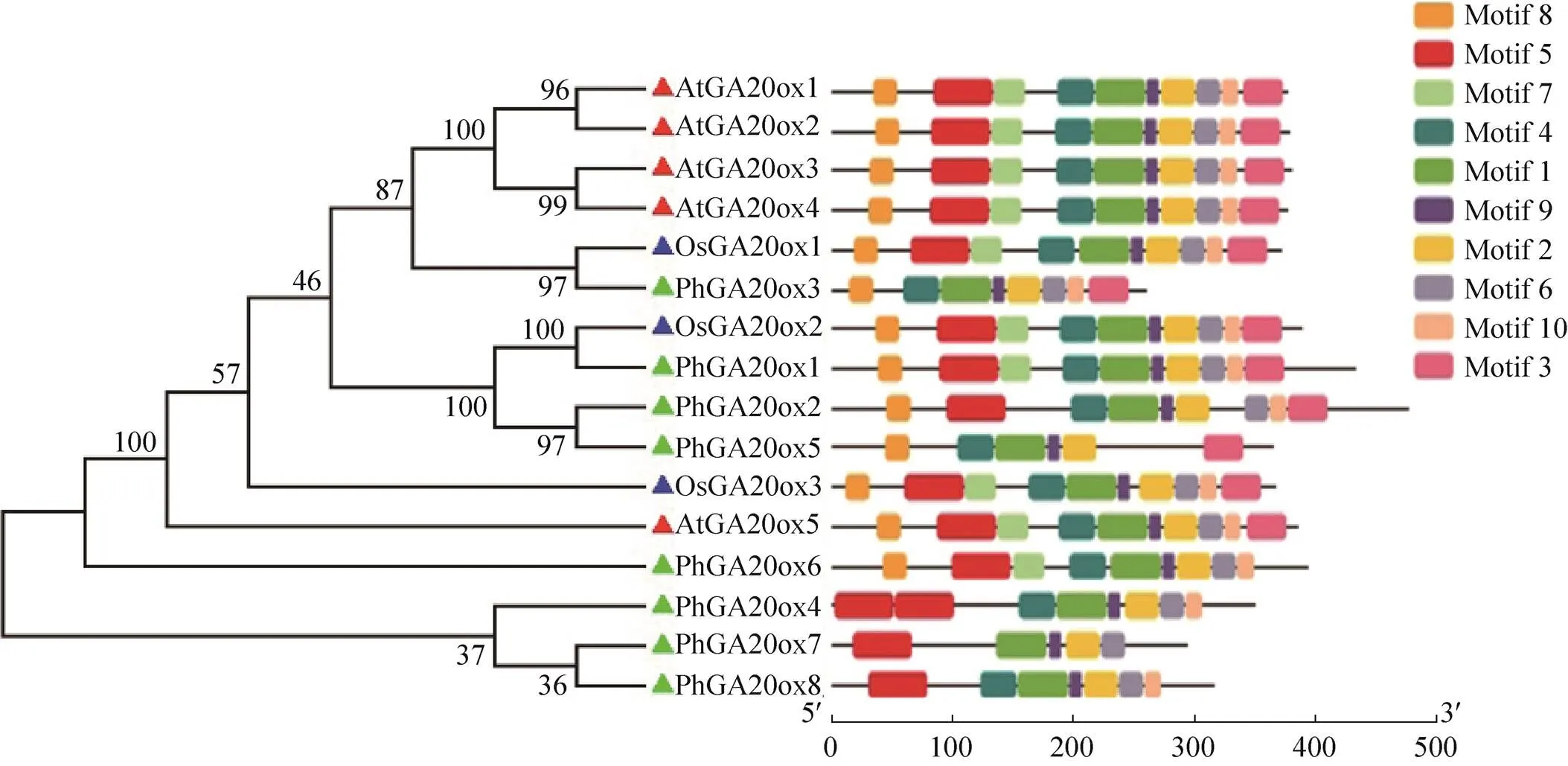





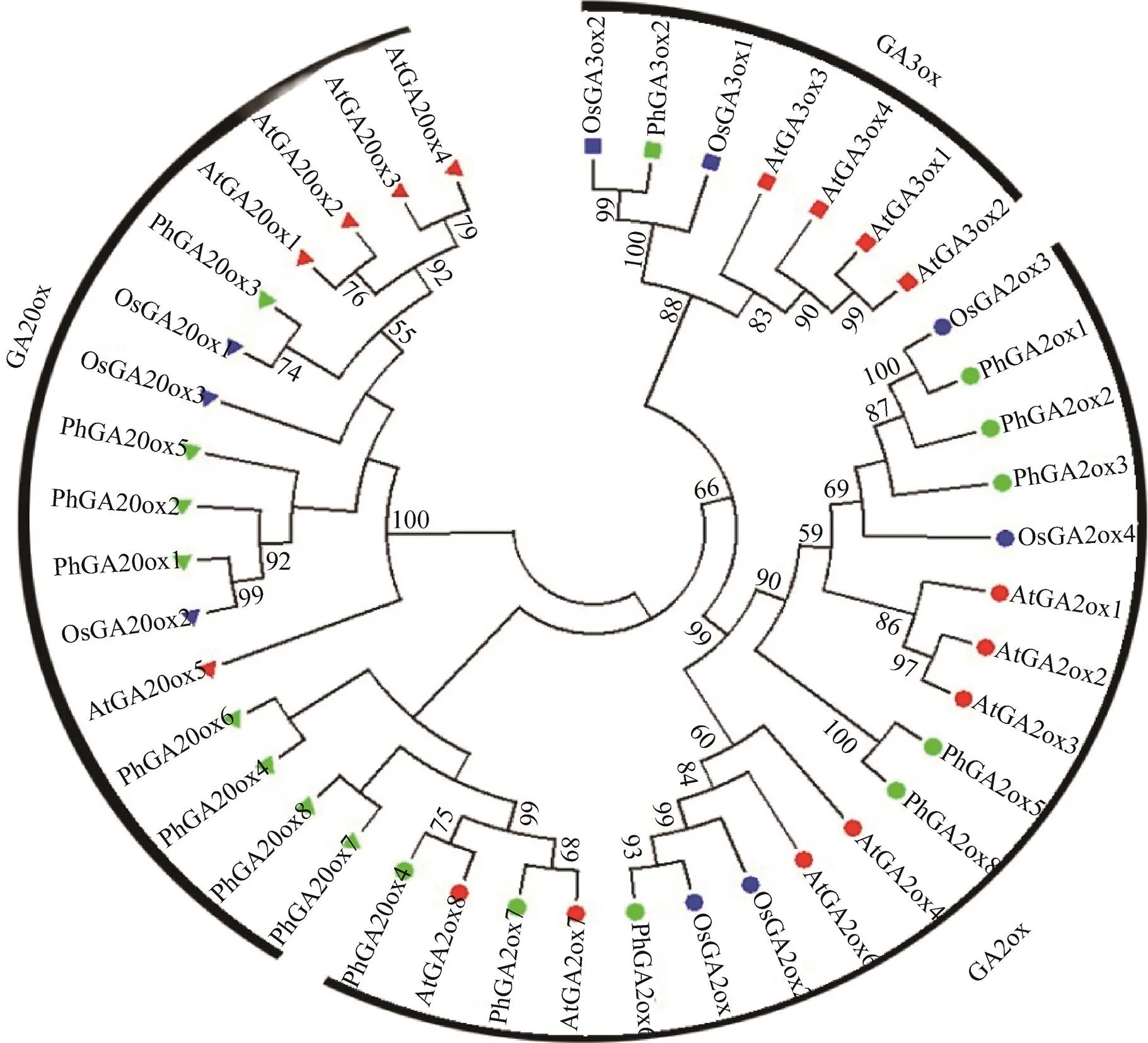
2.2 毛竹幼苗对外源GA3的响应






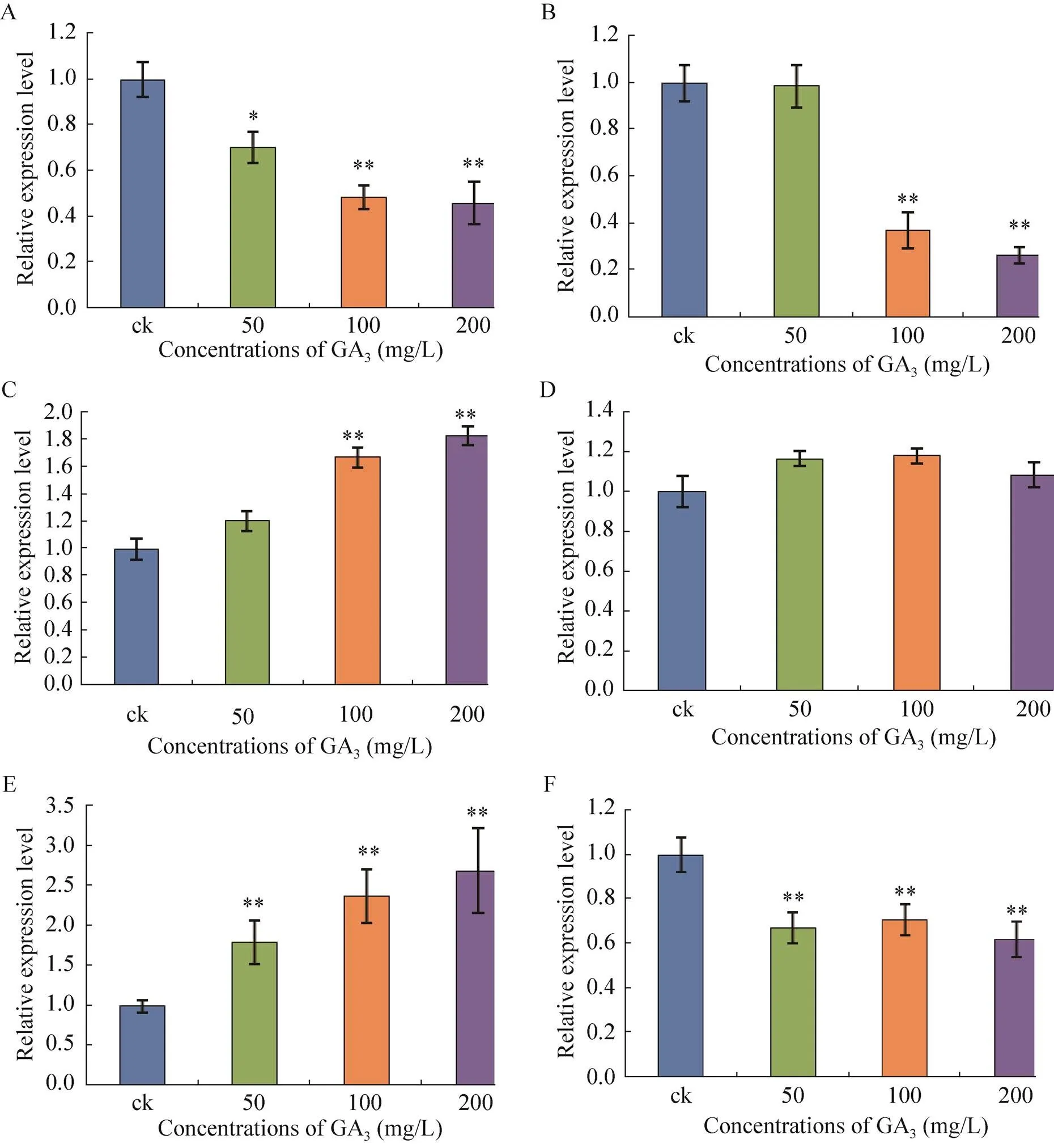
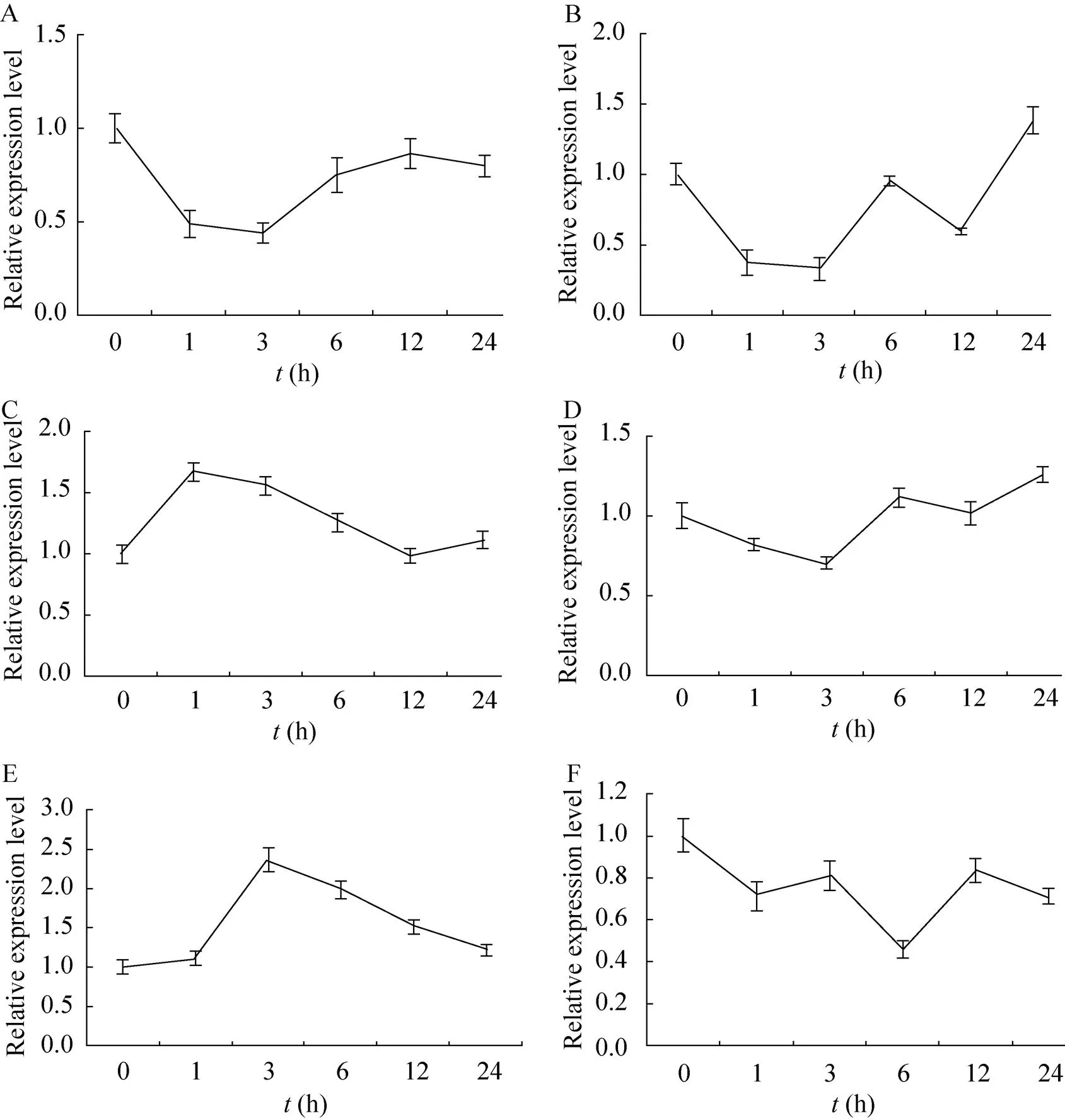
2.3 毛竹笋不同节间的表达分析

3 讨论

4 结论
