浙江大盘山华顶杜鹃菌根真菌的分离和鉴定
2019-04-23周钰鸿陈江芳陈子林唐光大
刘 亚,王 盼,周钰鸿,陈江芳,陈子林,唐光大
浙江大盘山华顶杜鹃菌根真菌的分离和鉴定
刘 亚1,王 盼2,周钰鸿2,陈江芳3,陈子林2,唐光大4
(1. 浙江省磐安县风景旅游管理局,浙江 磐安 322300;2. 浙江省大盘山国家级自然保护区管理局,浙江 磐安 322300; 3. 磐安县林业局,浙江 磐安 322300;4. 华南农业大学 林学与风景园林学院,广东 广州 510642)
于2016年5月在浙江省大盘山国家级自然保护区的3处采样地,每处采集5株华顶杜鹃的1 ~ 2支侧根,培养分离华顶杜鹃的菌根真菌,然后结合菌落形态特征和DNA ITS序列分析进行鉴定。结果表明:华顶杜鹃根系内共分离到165个菌株,分为22个菌落形态类型;结合DNA ITS序列分析,最终分为20个不同的菌种类型,其中19个菌种类型属于子囊菌门Ascomycota,包括8个属于粪壳菌纲Sordariomycetes和6个属于锤舌菌纲Leotiomycetes;3个优势菌种分别为,和某粪壳菌纲真菌的近缘种,分别占菌株总数的41.82%,22.42%和10.91%;其余17个菌种类型合计只占总数的24.85%。
华顶杜鹃;杜鹃花类菌根;菌根真菌分离;浙江大盘山
菌根是植物根系与部分土壤真菌形成的共生体,能够协助植物吸收和利用养分,促进植物对土壤营养元素的吸收,增强植物的抗逆性[1-2]。杜鹃花类菌根(Ericoid mycorrhiza,ERM)是一类特殊的内生菌根,杜鹃花科Ericaceae植物在高山、石壁、沼泽[3]等生境均有分布,ERM对杜鹃花科植物的生态适应可能起了重要的作用,同时也促进了杜鹃花科植物在不同生境的物种分化和形成[4-6]。华顶杜鹃于1990年在浙江省天台县华顶山被发现[7],新种发表时该物种被指定了2份模式标本,2005年进行了订正[8]。该物种是浙江省特有植物,发现时仅有200余株,已于2012年4月被浙江省人民政府列入《浙江省重点保护野生植物名录(第一批)》。近年来,在浙江省磐安大盘山、宁波四明山、金华北山、宁波奉化等地也陆续发现了华顶杜鹃,但种群数量小,属于衰退型[9],整体遗传多样性水平低[10-11]。华顶杜鹃主要生长在海拔750 ~ 1 150 m的光照较强的阳坡,土壤干旱贫瘠,菌根对其适应生境可能有一定的贡献。本研究采用人工培养根段分离菌株、菌落形态分类和菌株DNA ITS序列分子鉴定等方法调查华顶杜鹃菌根群落的真菌种类,并找出其优势菌种,为该物种的幼苗繁殖、迁地保护、壮苗培育和后期开发利用等提供研究基础。
1 材料和方法
1.1 根系样品采集
浙江省大盘山国家级自然保护区位于浙江中部的磐安县,是我国目前唯一以野生药用生物资源为主要保护对象的国家级自然保护区。保护区为亚热带季风气候,以常绿阔叶林为地带性植被,年平均气温为13.9 ~ 17.4℃,年均降水量1 427.8 mm,年均日照1 827.6 h,年均无霜期192 d,年均结冰期47 d,土壤主要有红壤、黄壤、水稻土,是华顶杜鹃在其模式产地之外发现的第一个自然分布点[12]。2016年5月在保护区内海拔800 ~ 1 000 m的牛角尖(120°31¢18.6²E,28°58¢14.7²N)、高姥山(120°32¢41.6²E,28°53¢43.8²N)、毛坞(120°31¢52.30²E,28°59¢7.7²N)3处采样地,每处采集5株华顶杜鹃的根系,每株采集1 ~ 2支侧根,将侧根连同侧根上的细根和泥土一起,保湿置于冰壶内带回实验室。
菌根分离培养基采用改良的马丁-孟加拉红培养基[13],配方为:葡萄糖10 g、胰蛋白胨5 g、磷酸氢二钾1 g、硫酸镁0.5 g、孟加拉红0.033 g、琼脂20 g,蒸馏水定容至1 000 mL,调节pH值至5.0,然后121℃高压灭菌20 min,冷却至60℃以下时加入0.03 g链霉素混合均匀。
菌落形态观测采用pH值调节为5.0的MEA培养基,配方为麦芽提取物20 g、胰蛋白胨1 g、葡萄糖20 g、琼脂20 g,蒸馏水定容至1 000 mL,调节pH值至5.0,然后121℃高压灭菌20 min,冷却至60℃以下时加入0.03 g链霉素。试验所用的葡萄糖、磷酸氢二钾、硫酸镁、孟加拉红、琼脂均为分析纯;胰蛋白胨、麦芽提取物为生物试剂(英国Oxoid公司生产)。
1.2 菌种分离和观测
采用根段直接培养法进行菌根分离。清洗和挑选直径在1.0 mm以下的细根,在超净工作台下置于75%乙醇中,浸泡15 s,无菌水漂洗3 ~ 5次;再在10 %的家用84消毒液中浸泡15 min,无菌水漂洗3 ~ 5次。把根系剪成长约0.5 cm的小段,用无菌滤纸吸干水滴,每个平板5条根段,置于分离培养基中培养。用接种棒蘸取少量最后一遍漂洗根系的无菌水,均匀涂抹于一个平板,作为对照,排除杂菌。把培养根段和对照的平板置于25℃培养箱中,黑暗培养14 ~ 28 d。每个样地分别培养60个根段。试验所用75%乙醇为分析纯;家用84消毒液选用蓝月亮牌84消毒液,有效成分为次氯酸钠,有效含氯量8 000 ~ 10 500 mg·L-1。
待菌落从根段中长出,用接种针挑取菌丝,置于MEA培养基上,培养7 d后,观察菌落形态的一致性和均匀性。若菌落形态有差异,进行二次分离,如此反复直至纯化。把纯化后的菌株接种至MEA培养基上,置于25℃培养箱中,黑暗培养3个星期。根据菌落形态特征进行描述记录和分类,测量指标包括菌落直径、颜色、质地、边缘、是否有液体分泌物等[14-16]。
1.3 菌株分子鉴定
从每一个菌落形态类型中根据所拥有菌株的数量多少随机挑选部分菌株进行DNA ITS序列分析。菌株DNA提取参考庄彩云等[17]的方法。
DNA ITS区段的PCR扩增采用通用引物ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)。PCR反应体系为2×PCR Buffer(Mg2+,dNTP plus)(TaKaRa)12.5 μL,引物各0.8 μL,DNA模板1 μL,rTaq酶(1.25 U·μL-1)(TaKaRa)0.5 μL;ddH20定容至25 μL。PCR反应循环参数为:98℃预变性3 min,98℃变性30 s,50℃退火30 s,68℃延伸1 min,68℃延伸7 min,38个反应循环。
PCR产物纯化后送至杭州擎科梓熙生物技术有限公司直接测序。把得到的序列提交至GenBank数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi),进行Blast相似性比对,选取并下载相似度排在前列的序列。在MEGA6软件中用ClustalW程序进行序列比对和人工校正,对比对后的序列矩阵采用最大似然法(Maximum Likelihood,ML)和贝叶斯推理法(Bayesian inference,BI)进行分析,ML采用CIPRES(https://www.phylo.org/portal2/home.action)中的RAxML-HPC2 on XSEDE(8.2.10)程序分析,在Bootstrapping phase中选择GTRGAMMA模型,用Bootstrap自检检验法进行评估,1 000次重复;BI采用MrBayes on XSEDE(3.2.6)程序分析,在筛选出最优模型的情况下,马科夫链-蒙特卡洛值(Markov chain Monte Carlo,MCMC)分别取10 000 000、抽样频率为100;计算值分裂频率平均标准差(Average standard deviation of spl-it frequencie)值小于0.01为止,并计算各分支的后验概率值(Posterior probability,PP),获得BI拓扑树。
2 结果与分析
2.1 菌落形态特征观测
3个采样地的华顶杜鹃根系内共分离到165个菌株,其中牛角尖采样地66个,高姥山采样地50个,毛坞采样地49个。依据菌株在MEA培养基上25℃黑暗条件下培养21 d的菌落形态特征,分离得到的菌株分为22个类型。其中7个类型的菌落颜色属于白色、乳白、淡黄色等浅白色系,13个类型的菌落颜色属于浅灰、灰、深灰、深褐、青棕、黑等深灰色系,2个类型的菌落颜色正面是浅白色系,背面是深灰色系;15个类型的菌落质地呈绒毡状,4个类型的菌落质地呈薄蜡状,3个类型在两者之间;2个类型的菌落在培养过程中出现透明状的分泌物(图1,表1)。
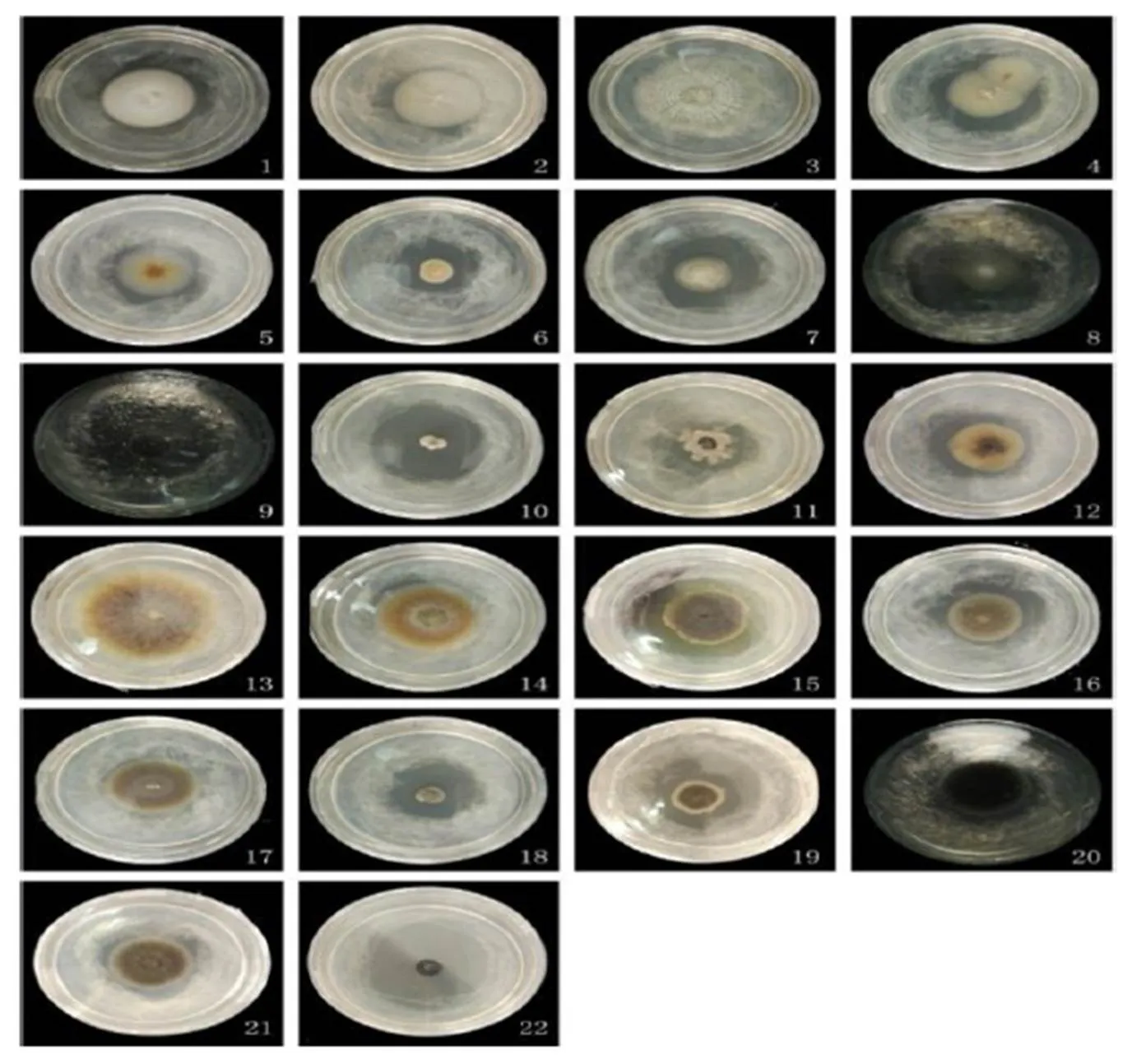
图1 菌落形态特征分类
Figure 1 Colonial morphological characteristics of mycorrhizal fungi
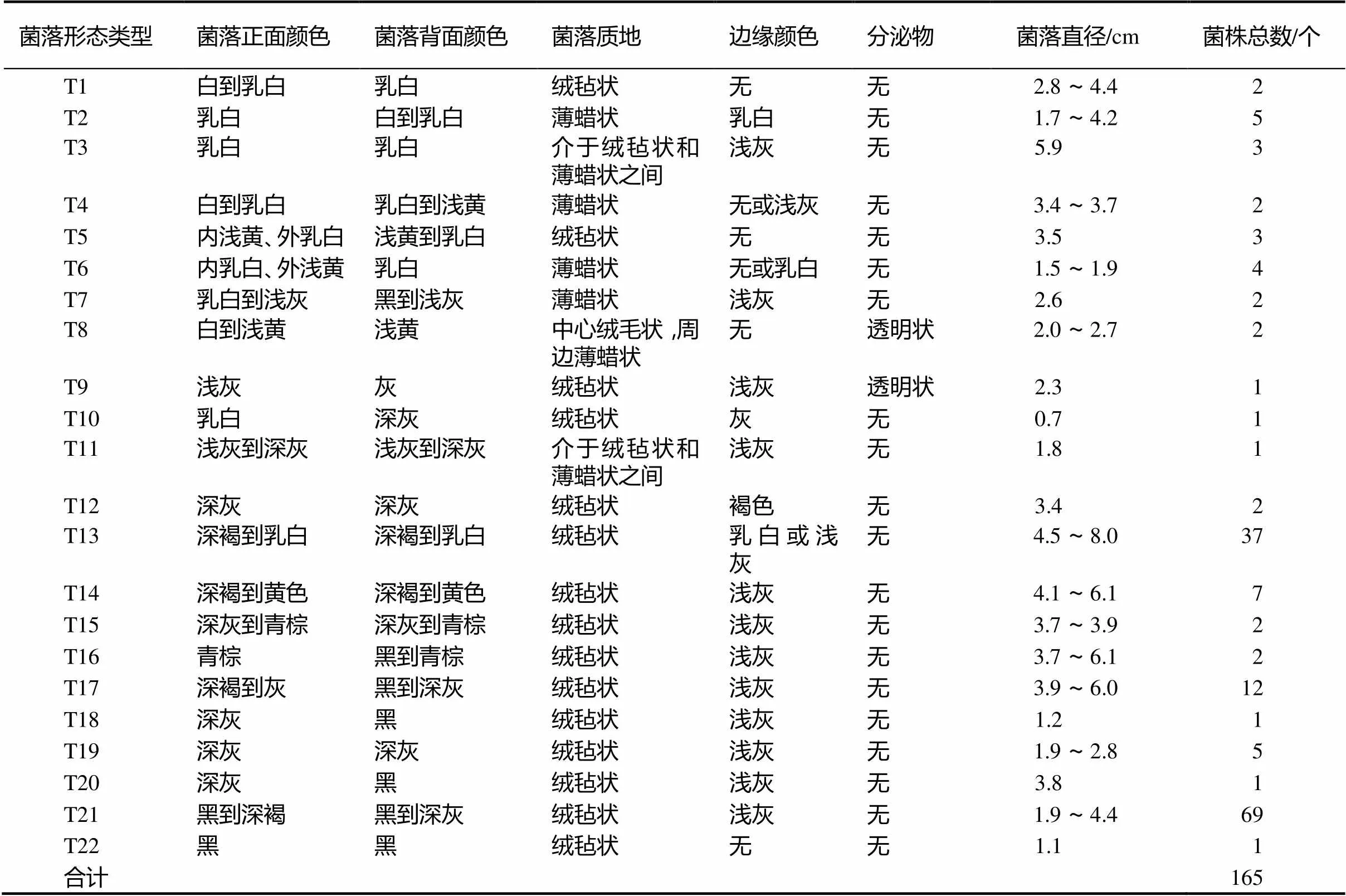
表1 菌落形态特征分类
2.2 菌株的rDNA ITS序列分析
从22个菌落形态类型的165个菌株中挑选了43个菌株进行DNA ITS序列分析,每个类型1 ~ 7个代表菌株,PCR扩增得到的ITS序列长度范围在487 ~ 679 bp之间。把所获得的序列提交至NCBI数据库进行Blast比对,选取相似度高于93%的数据库序列(表2),并以亲缘关系相对较远的裂褶菌(Genbank登录号EF155505.1)为外类群[14],构建系统发育树(图2)。
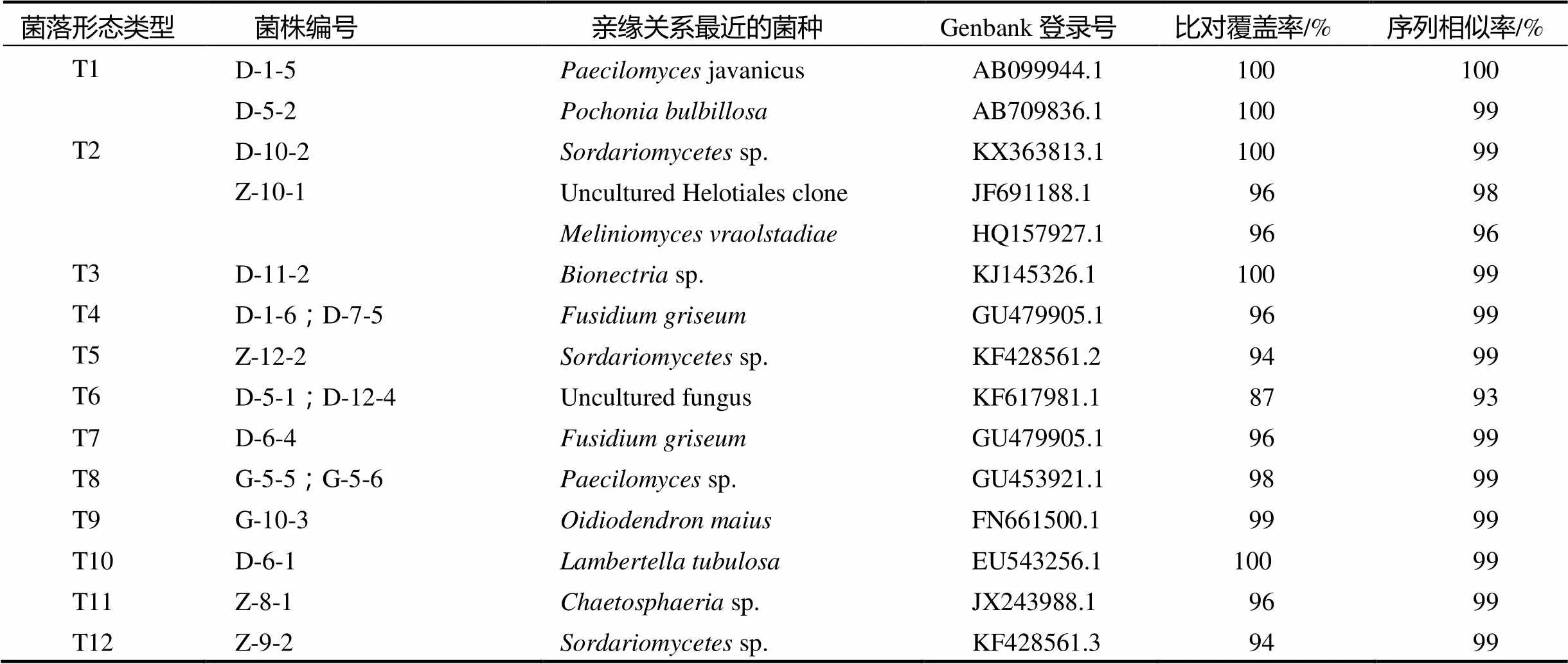
表2 菌株的rDNA ITS序列BLAST结果
表2 续
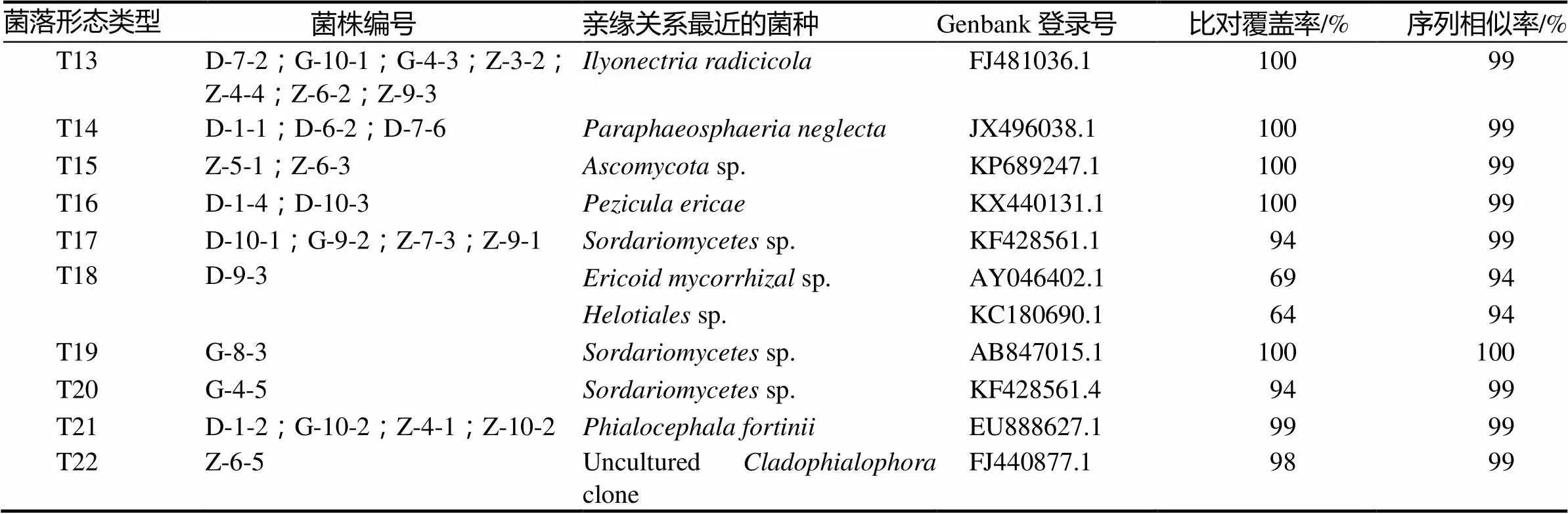
菌落形态类型菌株编号亲缘关系最近的菌种Genbank登录号比对覆盖率/%序列相似率/% T13D-7-2;G-10-1;G-4-3;Z-3-2;Z-4-4;Z-6-2;Z-9-3Ilyonectria radicicolaFJ481036.110099 T14D-1-1;D-6-2;D-7-6Paraphaeosphaeria neglectaJX496038.110099 T15Z-5-1;Z-6-3Ascomycota sp.KP689247.110099 T16D-1-4;D-10-3Pezicula ericaeKX440131.110099 T17D-10-1;G-9-2;Z-7-3;Z-9-1Sordariomycetes sp.KF428561.19499 T18D-9-3Ericoid mycorrhizal sp.AY046402.16994 Helotiales sp.KC180690.16494 T19G-8-3Sordariomycetes sp.AB847015.1100100 T20G-4-5Sordariomycetes sp.KF428561.49499 T21D-1-2;G-10-2;Z-4-1;Z-10-2Phialocephala fortiniiEU888627.19999 T22Z-6-5Uncultured Cladophialophora cloneFJ440877.19899
图2显示,利用ML和BI构建的系统发育树的拓扑结构一致。43个代表菌株聚为20个分支。属于同一菌落形态类型T1的菌株D-1-5,D-5-2和T2的D-10-2,Z-10-1在ML系统发育树中各自聚为4个不同的分支。而不同菌落形态类型T5,T12,T17,T20的菌株在ML系统发育树中聚为1个分支,T4,T7的菌株聚为1个分支。其余不同菌落形态类型的菌株在ML系统发育树中各自聚为1个分支。
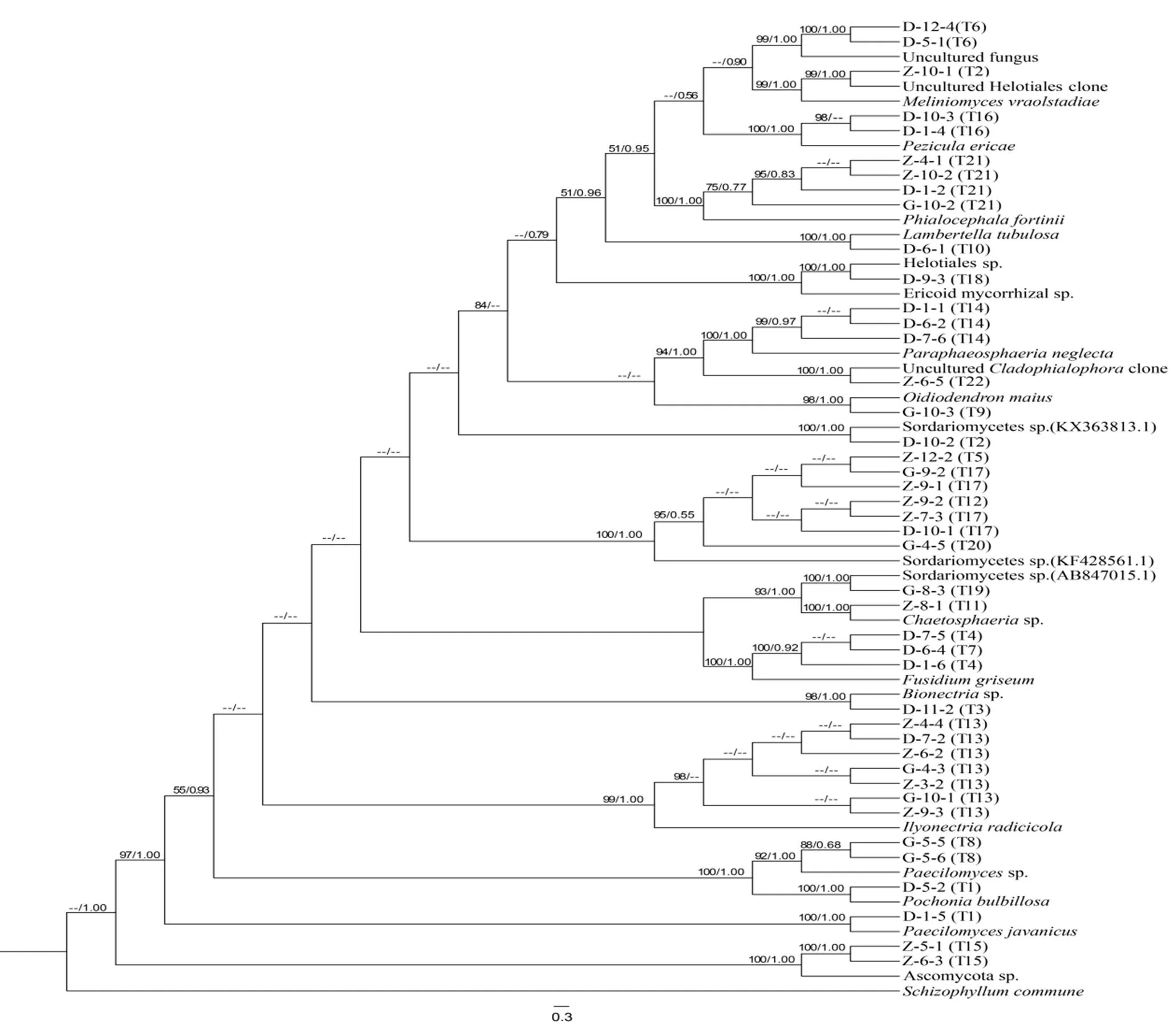
图2 基于菌株及其相似真菌的rDNA ITS序列构建的ML和BI系统发育树(节点的数值分别代表PP和BPML)
Figure 2 ML and BI phylogenetic tree based onDNA ITS sequences of mycorrhizal fungi and similar fungi from the Genbank
2.3 菌根真菌鉴定结果
结合菌落形态分类和代表菌株的DNA ITS序列分析结果,此次菌根分离得到165个菌株为20个不同的菌种类型(表3)。除了1个菌种类型N8的分类地位尚不清楚,其余19个菌种类均属于子囊菌门Ascomycota,其中8个属于粪壳菌纲Sordariomycetes,6个属于锤舌菌纲Leotiomycetes。
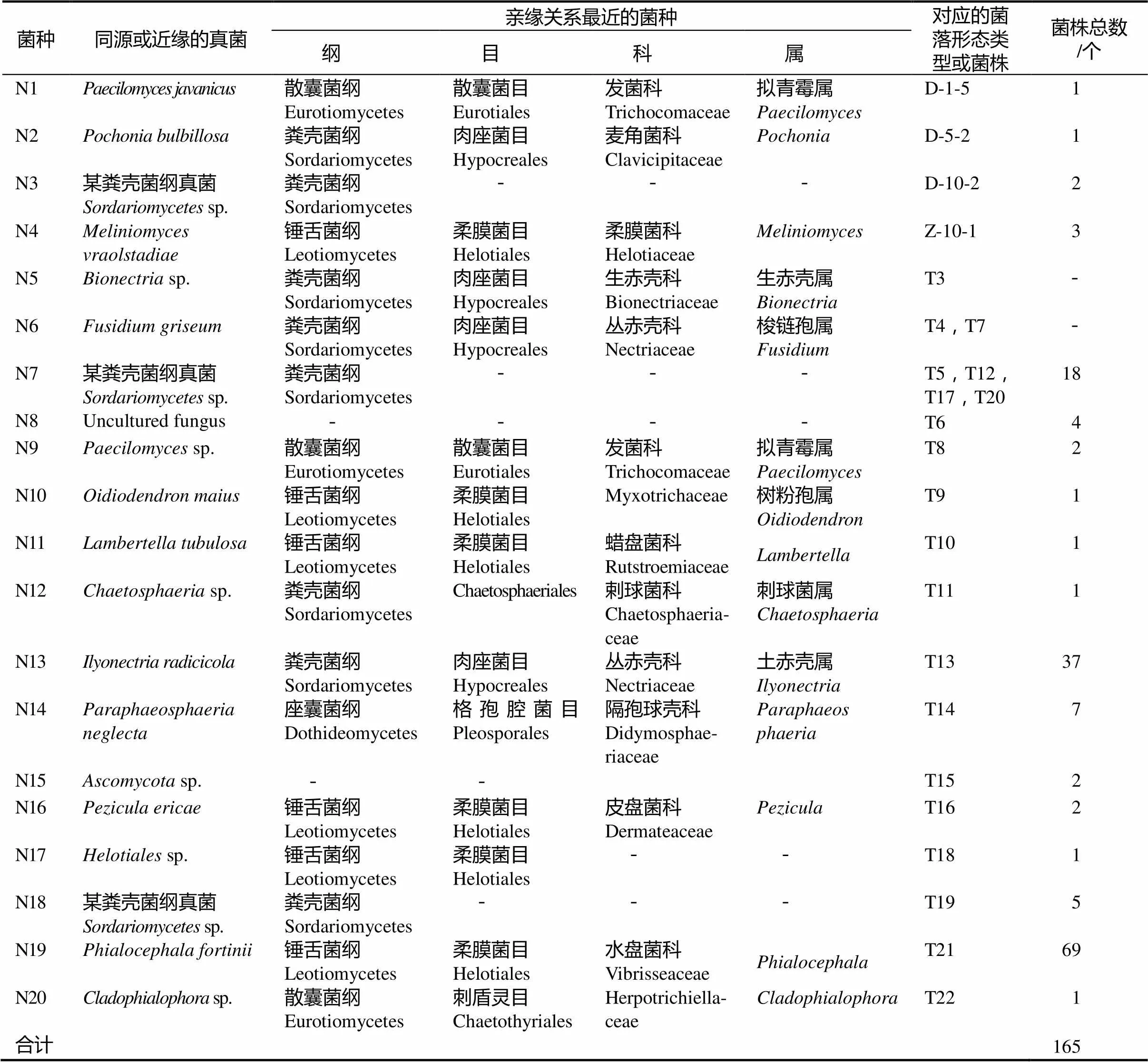
表3 菌根真菌鉴定结果及菌株数量统计
3个菌种类型N7,N13 和N19的菌株数量远远大于其他菌种类型,分别为18,37和69个,占菌株总数的75.15%,是华顶杜鹃菌根的优势菌种类型。其余17个菌种类型的菌株数量在1 ~ 7个之间,只占菌株总数的24.85%。
3 结论
从浙江省大盘山国家级保护区的华顶杜鹃的根系内,采用人工培养根段的方法分离到165个菌株,分为22个菌落形态类型。结合DNA ITS序列分析,华顶杜鹃的菌根真菌可分为20个不同的菌种类型,其中19个菌种类型属于子囊菌门,1个未能鉴定类别。
粪壳菌纲和锤舌菌纲的真菌占了华顶杜鹃菌根真菌的大多数,8个菌种类型的71个菌株属于粪壳菌纲,分别占菌种类型总数和菌株总数的40%和43.03%;6个菌种类型的77个菌株属于锤舌菌纲,分别占菌种类型总数30%和菌株总数的46.67%。优势菌种为,和某粪壳菌纲真菌的近缘种,分别占菌株总数的41.82%,22.42%和10.91%;其余菌种的菌株数量较少,17个菌种类型合计只占总数的24.85%。
4 讨论
4.1 真菌形态鉴定和分子鉴定方法的比较
真菌种类繁多、形态特征复杂,并且其形态特征常随着环境变化或菌落生长而变化,因此传统的形态鉴定方法难度较大。分子鉴定方法以真菌物种的DNA ITS序列为依据,虽然可以定量地分析,但分子试验价格昂贵,对一些特殊的菌种类型可能难以靠通用引物进行鉴别,依赖Genbank等数据库中已有同源或近缘菌株的序列信息,并且选取合适的方法和模型进行分子数据分析非常重要[18]。
本研究中由于一些菌落形态特征较难判定,因而对菌落形态分类进行得较为细致,把一些有细微差异的菌株都分为了不同的菌落形态类型,并且选取了较多的菌株进行DNA ITS序列分析,最终将其中6个菌落形态类型经过分子鉴定后被归并为2个不同菌种,而4个被归为2个菌落形态类型的菌株经过分子鉴定后发现是4个差异较大的菌种,其余菌株的形态分类和分子分类的结果一致。可见虽然菌落形态分类存在一定误差,但它可作为挑选代表菌株进行分子鉴定的重要参考,从而节约分子试验成本。通过较为细致的菌落形态分类和选取较多的菌株进行分子鉴定,可以修正菌落形态分类的误差,从而对大量真菌进行较为准确的鉴定。由于Genbank数据库中序列信息有限,本研究中3个菌种类型N4,N8,N17并未找到序列相似率在99%以上的株,这些菌种类型的鉴定结果与其准确的系统分类地位应该还有一定差距;4个菌种类型N3,N7,N15,N18虽然分别找到了序列相似率99%的菌株,但仅能鉴定到目或目以上。而除此之外的13个菌种类型,则相对准确地鉴定到了属或种。
4.2 华顶杜鹃菌根群落真菌组成
随着研究技术的进步,越来越多的子囊菌门和担子菌门真菌在杜鹃花科植物的根内被发现,包括sp.,sp.,sp.,枝顶孢属sp.,sp.,sp.,sp.,粒毛盘菌属sp.等子囊菌类和sp.,Sebacinales,Serendipitaceae,等担子菌类,其中子囊菌门盘菌属sp.,sp.和树粉孢属sp.是最常见的杜鹃花类菌根真菌,已被证实能与杜鹃花科植物的根系形成典型的胞内菌丝节结构,并进行直接的营养交换[19]。本研究中菌种类型N4,N10和N16分别是,、(同)的同源或近缘种,但它们分别只占菌株总数的3.64%,1.21%和2.42%,并未在大盘山地区华顶杜鹃的菌根群落里占优势。本研究中优势菌种类型N3,N13和N7分别是,和某种未知粪壳菌纲Sordariomycetes真菌的同源或同一种,分别占菌株总数的41.82%,22.42%和10.91%。大量研究表明,以为典型代表的深色有隔内生真菌(Dark septate endophytes,DES)在包括杜鹃花科[20]、松科Pinaceae[21],兰科Orchidaceae[22],豆科Leguminosae[23]在内的多种植物的菌根内都有发现是一种几乎没有宿主选择性的广谱性菌根真菌,并且对宿主植物具有积极的菌根效益[24]是南美洲巴塔哥尼亚地区(Patagonia)的杜鹃花科白珠树属丽果木.和波比白珠树.的侵染率较高的菌根真菌之一[25],在云南高黎贡山的大树杜鹃.var.的根内也曾分离和记录过,并且是大树杜鹃部分菌根群落的优势菌种类型[26]。然而,.及该属的真菌常对葡萄[27]、鳄梨[28]等多种植物引起严重的根腐病。有研究观点提出,植物与真菌之间的互利共生或致病寄生关系并没有绝对的界限,而是受环境、生理、基因等多种因素的影响;在特定的条件下,植物与真菌之间的互利共生或致病寄生关系可以相互转化[29]。.未对华顶杜鹃,丽果木、波比白珠树和大树杜鹃等杜鹃花科植物引起病害,同时这些杜鹃花科植物的自然分布区都非常狭小、生境环境特殊。这些杜鹃花科植物是否具有抵抗根腐病的特殊机理,或者.对这些杜鹃花科植物适应特殊环境是否具有关键性作用,可做进一步研究和探索。
[1] 石兆勇,陈应龙,刘润进. 菌根多样性及其对植物生长发育的重要意义[J]. 应用生态学报,2003,14(9):1565-1568.
[2] 徐丽娟,刁志凯,李岩,等. 菌根真菌的生理生态功能[J]. 应用生态学报,2012,23(1):288-295.
[3] Pellett N E,Rowan N,Aleong J. Cold Hardiness of Various Provenances of Flame, Roseshell, and Swamp Azaleas[J]. J Am Soc Hort,1991,116(1):23-26.
[4] Fukuchi S,Obase K,Tamai Y,. Vegetation and colonization status of mycorrhizal and endophytic fungi in plant species on acidic barren at crater basin of volcano Esan in Hokkaido, Japan[J]. Eurasian J For Res,2011,14(1):1-11.
[5] Cairney J W G,Meharg A A. Ericoid mycorrhiza: a partnership that exploits harsh edaphic conditions[J]. Europ J Soil Sci,2010,54(4):735-740.
[6] Diaz A,Green I,Benvenuto M,. Are Ericoid Mycorrhizas a factor in the success of Calluna vulgaris heathland restoration?[J]. Restor Ecol,2010,14(2):187-195.
[7] 丁炳扬,方云亿. 浙江杜鹃花属一新种[J]. 植物研究,1990,10(1):31-33.
[8] 杨旭,丁炳扬,胡仁勇. 浙江杜鹃花属植物资源开发及利用[J]. 中国野生植物资源,2005,24(2):22-25.
[9] 周莹莹,孙莉,陈子林,等. 珍稀特有植物华顶杜鹃的群落基本特征分析[J]. 杭州师范大学学报:自然科学版,2012,11(3):211-216.
[10] 褚文珂,周莹莹,陈子林,等. 珍稀植物华顶杜鹃群落分类和物种多样性研究[J]. 杭州师范大学学报:自然科学版,2013,12(3):240-244,257.
[11] 陈珍慧. 珍稀特有植物华顶杜鹃的种群特征和保护遗传学研究[D]. 杭州:杭州师范大学,2016,40-47.
[12] 陈亚琳,杨碧烟. 大盘山志[M]. 杭州:浙江科学技术出版社,2016:2-8.
[13] 张春英,尹丽娟,王胤,等. 一种简捷的分离杜鹃花类菌根真菌的方法[J]. 生物技术,2007,17(6):28-32.
[14] 刘仁阳,欧静,李冠楠,等. 梵净山雷山杜鹃根部真菌分离与鉴定[J]. 西北农业学报,2014,23(4):178-185.
[15] 杨兵,张春英,王献,等. 杜鹃花根系内生菌资源调查及多样性分析[J]. 河南农业大学学报,2010,44(3):290-294.
[16] 陈真,杨兵,张春英,等. 锦绣杜鹃菌根真菌DNA ITS序列分析及接种效应研究[J]. 菌物学报,2011,30(5):729-737.
[17] 庄彩云,李潞滨,胡陶,等. 适用于DNA ITS分析的兰属菌根真菌培养及DNA提取方法[J]. 北京农学院学报,2007,22(3):4-6,31.
[18] 张丽娜,荣昌鹤,何远,等. 常用系统发育树构建算法和软件鸟瞰[J]. 动物学研究,2013,34(6):640-650.
[19] LEOPOLD D R. Ericoid fungal diversity: Challenges and opportunities for mycorrhizal research[J]. Fung Ecol,2016,24(Part B):114-123.
[20] 魏杰,杨秀丽. 大兴安岭4种杜鹃花科植物的DSE真菌分布[J]. 内蒙古林业科技,2014,40(4):43-46.
[21] 徐风美,王春燕,褚洪龙,等. 松萎蔫病发生区和未发生区油松根部真菌群落研究[J]. 西北植物学报,2014,34(8):1627-1634.
[22] Kohout P,TAMAEA T,ROY M,. A diverse fungal community associated with Pseudorchis albida (Orchidaceae) roots[J]. Fung Ecol,2013,6(1):50-64.
[23] 孙茜,薛子可,解琳琳,等. 沙冬青及其伴生植物深色有隔内生真菌物种多样性[J]. 植物生态学报,2017,41(7):729-737.
[24] Newsham K K. A meta-analysis of plant responses to dark septate root endophytes[J]. New Phytol,2011,190(3):783-793.
[25] Bruzone M C,Fontenla S B,Vohník M. Is the prominent ericoid mycorrhizal fungus Rhizoscyphus ericae absent in the Southern Hemisphere’s Ericaceae? A case study on the diversity of root mycobionts in Gaultheria spp. from northwest Patagonia, Argentina [J]. Mycorrhiza,2015,25(1):25-40.
[26] 张新军. 极小种群野生植物大树杜鹃的形态解剖特征及内生真菌多样性研究[D]. 昆明:云南大学,2015,32-42.
[27] CARLOS A B,GRAMAJE D,JOSE G J,. Detection of black-foot disease pathogens in the grapevine nursery; propagation process in Spain[J]. Europ J Plant Pathol,2013,137(1):103-112.
[28] Vitale A,Aiello D,Guarnaccia V,. First Report of Root Rot Caused by Ilyonectria (Neonectria) macrodidyma on Avocado (Persea americana)in Italy[J]. J Phytopathol,2012,160(3):156-159.
[29] Kogel K H,Franken P,Hückelhoven R. Endophyte or parasite-what decides?[J]. Curr Opin Plant Biol,2006,9(4):358-363.
Isolation and Identification of Mycorrhizal fungi inRoot in Zhejiang Dapanshan National Nature Reserve
LIU Ya1,WANG Pan2,ZHOU Yu-hong2,CHEN Jiang-fang3,CHEN Zi-Lin2,TANG Guang-da4
(1. Pan’an Administration of Tourism of Zhejiang, Pan’an 322300, China; 2. Administration of Dapanshan National Natural Reserve of Zhejiang, Pan’an 322300, China; 3. Pan’an Forestry Bureau of Zhejiang, Pan’an 322300, China; 4. College of Forestry and Landscape Architecture, South China Agricultural University, Guangzhou 510642, China)
Three sample plots were established in Dapanshan National Nature Reserve, Zhejiang province in May of 2016. 5were selected for 1-2 lateral roots each. Ericoid mycorrhiza (ERM) was cultured from collected roots and studied by morphological characteristics and molecular identification ofDNA ITS sequence. The result showed that 165 mycorrhizal fungal strains were isolated which were classified into 22 types based on colony characteristics.DNA ITS demonstrated that these mycorrhizal fungi could be identified into 20 species, among them, 19 species belonging to Ascomycota, including 8 Sordariomycetes, 6 Leotiomycetes. The dominant 3 species were,andsp., respectively accounting for 41.82 %, 22.42% and 10.91% of the total strains. The lest 17 species occupied only 24.9%.
; ericoid mycorrhiza (ERM); Mycorrhizal fungi isolation; Dapanshan National Nature Reserve
10.3969/j.issn.1001-3776.2019.01.001
S685.21
A
1001-3776(2019)01-0001-08
2018-07-24;
2018-11-29
金华市重点科技计划项目(2017-2-022)资助
刘亚,工程师,从事植物生态与植物旅游开发利用研究工作;E-mail:785480407@qq.com。
唐光大,博士,副教授,从事植物资源和植物生态方面的研究;E-mail:gdtang@scau.edu.cn。
