湖北稻区穗腐病病原ITS鉴定及其生物学特性分析
2019-04-23杨小林殷得所张瑞洋张佑宏
杨小林,韩 烨,殷得所,张瑞洋,张佑宏,张 舒
(1.农作物重大病虫草害防控湖北省重点实验室/湖北省农业科学院 植保土肥研究所,湖北 武汉 430064;2.武汉市江夏区农业局,湖北 武汉 430200; 3.湖北省农业科学院 粮食作物研究所,湖北 武汉 430064;4.湖北工业大学,湖北 武汉 430068; 5.湖北省生物农药工程研究中心,湖北 武汉430064)
水稻穗腐病(Rice spikelet rot disease,RSRD),又名颖枯病、黑穗病、褐变穗病[1]或谷霉斑病、谷斑点病等[2],病害初期时,颖壳上出现黄褐色病斑,后期病斑扩展至整个谷粒,谷粒变成黑褐色或黑色,穗部表面覆盖白色或黑色霉层,米粒畸形或变色,结实率下降,瘪粒多,严重影响水稻的产量和品质[3]。目前国内多地有该病害的报道,学者们围绕引起病害的病原真菌进行了广泛研究[3-5],包括病原真菌的鉴定和生物学特性的研究,以期对水稻穗腐病的病因有明确了解,从而增强对病害的有效控制,减少其流行和危害的发生。
湖北地处华中,气候适宜,稻瘟病和稻曲病是水稻的重要病害[6-7],近年在湖北的主要稻区零星发现穗腐病。为防患于未然,于田间采集病穗标本,开展湖北稻区穗腐病病原菌的分离鉴定及其生物学特性研究,为该病害的科学防控提供理论依据。
1 材料和方法
1.1 材料
1.1.1 供试标样 2015—2016年在湖北省东南稻区采集穗腐病标样,分别记录、装袋,置于实验室4 ℃冰箱保存,以待分离。
1.1.2 水稻品种 利用水稻品种晚籼98进行柯赫氏法则验证。晚籼98是湖北省农业科学院选育的籼型晚稻品种,田间高感稻瘟病,易感稻曲病。
1.2 方法
1.2.1 培养基制备 马铃薯葡萄糖培养基(PDA培养基):马铃薯200 g、葡萄糖20 g、琼脂20 g、水1 000 mL。
查氏培养基(CDA培养基):硝酸钠 3 g、磷酸氢二钾 1 g、硫酸镁0.5 g、氯化钾0.5 g、硫酸亚铁0.01 g、蔗糖30 g、琼脂15 g、水1 000 mL。
1.2.2 病原菌的分离和柯赫氏法则验证 参照方中达[8]方法进行穗腐病病原菌的分离与纯化。将获得的菌株于水稻扬花期进行针刺接种,以注射清水为对照,7 d后调查结果并分别取样、分离、培养,完成病原菌柯赫氏法则验证。
1.2.3 病原菌的ITS鉴定 参照HE[9]的方法提取病原菌基因组DNA。利用真菌ITS鉴定通用引物ITS4和ITS5对分离获得的病原菌进行ITS-PCR鉴定[10]。通过PCR产物测序获得病原真菌ITS序列,与GenBank中的序列进行BLAST分析。引物合成由上海生工生物工程技术服务有限公司完成,PCR扩增产物测序由武汉天一辉远公司完成。
1.2.4 生物学特性研究 生物学特性研究采用菌丝生长速率法[11-12]。用直径5 mm的打孔器切取病原菌的菌饼,转至系列处理的PDA培养基平板(不同温度、不同琼脂含量、不同酸碱度)或查氏培养基为基础的培养基平板上,7 d 时用十字交叉法测量菌落直径,计算平均值。
1.2.5 数据分析 运用DMRT法[13]对病原菌生物学特性的相关试验数据进行统计分析,并比较差异显著性。
2 结果与分析
2.1 水稻穗腐病病原菌的菌落形态特征
2015—2016年从湖北省东南稻区采集感病标本,病穗上有褐色病斑,小穗枯黄,籽粒干瘪或霉烂,病穗与苞叶间充满白色菌丝体,籽粒间可见灰白色菌丝体(图1)。采用植物病理学组织分离方法,从感病谷粒上分离、纯化获得外形特征有区别的5株菌,分别记为菌Ⅰ、菌Ⅱ、菌Ⅲ、菌Ⅳ、菌Ⅴ。在PDA培养基上,菌Ⅰ菌落为白色,圆形,气生菌丝发达,蓬松,边缘整齐;菌Ⅱ菌落为灰褐色,平整,边缘整齐;菌Ⅲ菌落初为灰白色,后变为灰黑色,圆形,平整,边缘整齐;菌Ⅳ菌落深褐色,圆形,周缘整齐;菌Ⅴ菌落为黑色,松软,生长速度快(图2)。

图1 水稻穗腐病的田间采样标本Fig.1 Sampling specimens of RSRD in field

A.菌Ⅰ;B.菌Ⅴ;C.菌Ⅱ;D.菌Ⅲ;E.菌Ⅳ
2.2 水稻穗腐病病原菌的ITS鉴定
为鉴定试验中分离获得的菌株与已知病原真菌的异同,并确定其科学分类地位,利用PCR技术对分离获得的5个菌株的ITS序列进行了扩增(图3)并测序,5段序列的大小介于529~544 bp。与GenBank中已登录的序列进行比对分析,菌Ⅰ与岭南聚孢霉(Clonostachyepichloe,登录号为JN198444.1)的ITS序列相似性达99%;菌Ⅱ—Ⅳ与稻毛锥孢(Alternariapadwickii,登录号为GU373650.1)的ITS序列相似性达到99%;菌Ⅴ与稻黑孢菌(Nigrosporaoryzae,登录号为KU254608.1)的ITS序列相似性达99%。
结合菌落形态和ITS序列分析,分离获得的5个菌株被分为3类:菌Ⅰ为一类菌,被鉴定为子囊菌亚门(Ascomycota)粪壳菌纲(Sordariomycetes)肉座菌目(Hypocreales)生赤壳科(Bionectriaceae)螺旋聚孢霉属(Clonostachys)岭南聚孢霉(Clonostachyepichloe),有性态为Bionectriaepichloe;菌Ⅱ—Ⅳ属于同一类菌,被鉴定为盘菌亚门(Pezizomycotina)座囊菌纲(Dothideomycetes)格孢腔菌目(Pleosporales)格孢菌科(Pleosporaceae)链格孢属(Alternaria)稻毛锥孢(Alternariapadwickii);菌Ⅴ为一类菌,被鉴定为盘菌亚门(Pezizomycotina)粪壳菌纲(Sordariomycetes)假毛球壳目(Trichosphaeriales)假毛球科(Trichosphaeriaceae)黑孢属(Nigrospora)稻黑孢菌(Nigrosporaoryzae)。据此,采用菌Ⅰ、菌Ⅳ和菌Ⅴ完成后续研究。
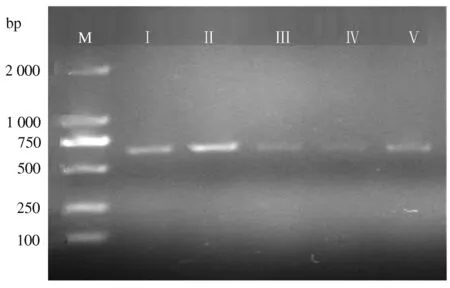
M:DL 2000 marker;Ⅰ—Ⅴ:菌Ⅰ—Ⅴ的PCR产物
2.3 水稻穗腐病病原菌的柯赫氏法则验证
为进一步确定分离、纯化获得的3类菌株(菌Ⅰ、菌Ⅳ和菌Ⅴ)是否为引起水稻穗腐病的病原真菌,依据柯赫氏法则进行了验证。把制备好的菌液采用注射接种法于水稻扬花期进行人工接种,7 d后调查结果,发现相比健康的对照植株,菌株接种后稻株出现症状。菌Ⅰ处理的穗部变为白色,菌Ⅳ处理的穗部出现灰褐色,菌Ⅴ处理的穗部明显变黑(图4)。分别采样后进一步分离、纯化,获得的菌株生长性状与接种病菌一致,因此,确定菌Ⅰ、菌Ⅳ和菌Ⅴ均是引起田间水稻穗腐的病原真菌。

A—D依次为对照、菌Ⅰ、菌IV、菌V接种后症状
2.4 水稻穗腐病病原菌的生物学特性研究
2.4.1 温度对病原菌生长的影响 试验设定5、15、25、35、40 ℃等5个温度处理,以25 ℃温度处理作为对照,于恒温培养箱中培养7 d后利用十字交叉法分别调查菌落的直径大小。结果显示,培养温度对菌Ⅰ、菌Ⅳ和菌Ⅴ 3类菌的生长均有影响,且存在差异(图5)。极端低温5 ℃时,菌Ⅰ的生长出现停滞,菌Ⅳ和菌Ⅴ的生长速度缓慢;极端高温40 ℃时,3类菌的生长均停止,表明极端低温和极端高温均不利于病原菌的生长。方差分析的结果表明,培养温度为25 ℃时,3类菌的菌落直径均显著高于其他4个温度处理。

小、大写字母分别表示同一类菌的不同处理在0.05、0.01水平上差异显著或极显著,下同
2.4.2 培养基中琼脂质量浓度对病原菌生长的影响 为研究培养基中琼脂含量对病原菌生长的影响,将培养基中琼脂质量浓度依次设置为10、15、20、25、30 g/L。25 ℃恒温培养箱中培养7 d后,利用十字交叉法分别调查菌落的直径大小。3类菌在不同琼脂含量的培养基上生长情况有差异。对于菌Ⅰ,15~30 g/L琼脂处理之间的菌落直径有差异但没有达到显著水平,它们与10 g/L琼脂处理菌落直径的差异达到极显著水平。对于菌Ⅳ,20~30 g/L琼脂处理之间的菌落直径没有显著差异,它们与10 g/L处理有显著差异,与15 g/L处理有极显著差异。对于菌Ⅴ,相同时间内生长最快的是10 g/L琼脂处理,菌落直径与其余各处理存在极显著差异,15~25 g/L琼脂处理之间的菌落直径无显著差异,这3个处理与30 g/L处理的菌落直径有显著差异(图6)。结果表明,3类菌培养基最佳的琼脂质量浓度不尽相同,菌Ⅰ最适宜生长的琼脂质量浓度为20 g/L;菌Ⅳ在培养基的琼脂质量浓度为25 g/L时表现出最快的生长势头;最适菌Ⅴ生长的琼脂质量浓度为10 g/L。

图6 培养基中琼脂质量浓度对水稻穗腐病病原菌生长的影响Fig.6 Effect of agar mass concentration in medium on the growth of pathogenic fungi causing RSRD
2.4.3 氮源对病原菌生长的影响 试验设置8个氮源处理,分别以大豆蛋白胨、酵母浸粉、牛肉浸膏、硫酸铵、尿素、黄豆粉、甘氨酸等7种物质作为不同的氮源代替硝酸铵,以查氏培养基中3 g/L硝酸铵的含氮量为标准,分别称取和查氏培养基中相等含氮量的氮源物质制备培养基,研究不同氮源物质对病原菌生长的影响。25 ℃恒温培养箱中培养7 d后,利用十字交叉法分别调查菌落的直径大小。结果表明,同一类菌在不同氮源培养基上的生长速度存在差异,同一氮源培养基上不同菌的生长速度也不尽相同,最适宜菌Ⅰ生长的氮源为硝酸铵,最适宜菌Ⅳ生长的氮源为黄豆粉,最适宜菌Ⅴ生长的氮源为黄豆粉和甘氨酸,在以尿素为氮源时3类菌的生长均表现停滞(图7)。
2.4.4 碳源对病原菌生长的影响 试验设置8个碳源处理,分别以葡萄糖、麦芽糖、乳糖、淀粉、山梨醇、甘露醇、羧甲基纤维素钠等7种物质作为不同的碳源代替蔗糖,以查氏培养基中30 g/L蔗糖的含碳量为标准,分别称取和查氏培养基中相等含碳量的碳源物质制备培养基,研究不同碳源物质对病原菌生长的影响。结果表明,同一类菌在不同碳源培养基上生长有差异,不同类菌在同一碳源培养基上的生长同样存在差异,但3类菌的最适宜碳源均是甘露醇(图8)。
2.4.5 酸碱度对病原菌生长的影响 试验设置5.0、5.5、6.0、6.5、7.0、8.0、9.0、9.5共8个梯度的pH值,以研究病原菌生长最适宜的酸碱度。结果表明,3类菌在相同pH值的培养基上生长状况不同,同类菌在不同pH值的培养基上生长也表现出差异(图9)。菌Ⅰ最适合生长的pH值为9.5,菌Ⅳ最适合的pH值为8.0,而菌Ⅴ的生长情况并未随着pH值的变化而发生明显改变,可见菌Ⅴ是一种pH值适应范围很广的菌。

图7 不同氮源对水稻穗腐病病原菌生长的影响Fig.7 Effect of different nitrogen source on the growth of pathogenic fungi causing RSRD
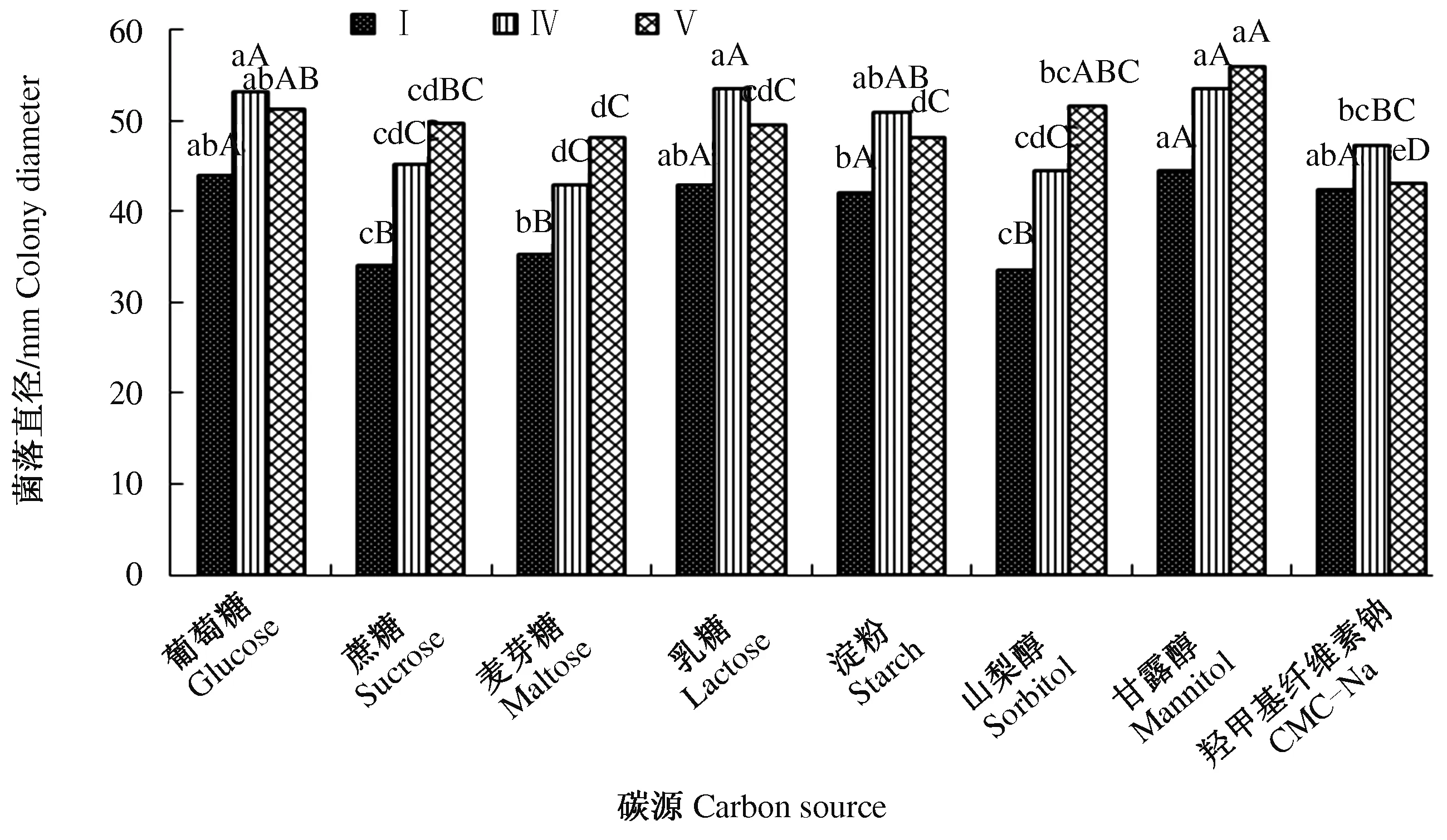
图8 不同碳源对水稻穗腐病病原菌生长的影响Fig.8 Effect of different carbon source on the growth of pathogenic fungi causing RSRD
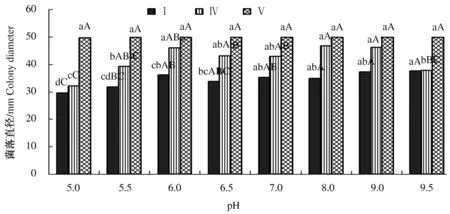
图9 不同pH值对水稻穗腐病病原菌生长的影响Fig.9 Effect of different pH values on the growth of pathogenic fungi causing RSRD
3 结论与讨论
近年穗腐病的发生在各地稻区呈上升趋势[14],湖北稻区虽然是零星发病,但未雨绸缪,本研究采集标本并通过形态学和分子生物学鉴定,获得了3类菌株:菌Ⅰ被鉴定为岭南聚孢霉(Clonostachyepichloe),有性态为Bionectriaepichloe;菌Ⅳ被鉴定为稻毛锥孢(Alternariapadwickii);菌Ⅴ被鉴定为稻黑孢菌(Nigrosporaoryzae)。对此3类菌的生物学特性开展研究,温度(5~40 ℃)对病菌生长影响的研究结果表明,3类菌的最适宜生长温度均为25 ℃,而且以最适温度为中心向两侧温度转变,3类病原菌的生长表现出不同程度的抑制,极端低温和极端高温下3类菌的生长几乎停止。培养基中最适琼脂含量的研究结果表明,菌Ⅰ最适宜的琼脂质量浓度为20 g/L,菌Ⅳ为25 g/L,菌Ⅴ为10 g/L。通过改变pH值(5.0~9.5)研究病菌的最佳酸碱环境,发现菌Ⅰ和菌Ⅳ培养基pH值的改变会影响菌落的生长,2类菌生长的最佳环境均偏碱,而菌Ⅴ的生长不受pH值的影响。最适氮源和碳源的研究结果表明,菌Ⅰ生长最适宜的氮源为硝酸铵,菌Ⅳ为黄豆粉,菌Ⅴ为黄豆粉和甘氨酸,3类菌的最适碳源均是甘露醇。穗腐病害病原真菌的鉴定与分类,以及生物学特性的分析,为该病害的进一步研究提供了必要的理论依据。
学者们通过研究发现,浙江稻区穗腐病的病原真菌有4类,即层出镰刀菌、澳大利亚平脐蠕孢菌、新月弯孢菌和细交链孢菌[4,15];新疆稻区穗腐病的样中也分离到3类真菌,主要致病菌是层出镰刀菌,次要致病菌为新月弯孢菌和细交链孢菌[16];黑龙江稻区穗腐病样中也分离到3类真菌,分别是链格孢菌、镰孢菌和青霉菌,其中链格孢菌是致病菌,镰孢菌和青霉菌未致病[17]。本研究中湖北稻区穗腐病的病原真菌有3类,通过注射接种菌Ⅳ稻毛锥孢和菌Ⅴ稻黑孢菌,水稻小穗出现典型的穗腐病症状,其中菌Ⅳ稻毛锥孢与细交链孢菌同属链格孢属真菌,表明浙江、新疆、黑龙江、湖北稻区的穗腐病存在相同属的病原真菌。同时多地稻区穗腐病病原真菌的鉴定结果证明,引起穗腐病的病原真菌不是单一的而是具有多样性[14]。以上研究结果不仅表明鉴定穗腐病病原真菌的必要性,而且预示了田间病害防控的复杂性。各地穗腐病害分离菌株生物学特性的研究表明,不同的分离菌株对温度、pH值的适应性以及在不同碳、氮源的选择上存在差异。
除了引起穗腐病多样性的病原真菌,稻蝽象取食谷粒造成谷粒伤口、引起病菌的侵入,以及颖壳伯克氏菌的存在,是引起谷斑或谷霉的另外2个重要原因[2],其中颖壳伯克氏菌的存在易造成细菌性谷枯病害远距离传播与发生。针对谷斑病或谷霉病的病因,利用化学药剂可以开展对穗腐病病原真菌和稻蝽象的有效控制,同时利用频振式杀虫灯[18]以及对环境友好无害的信息素或生物菌剂[19-20],是进行稻蝽象和颖壳伯克氏菌防治的另一途径。通过综合使用各种防治手段,达到有效控制谷斑病或谷霉病的目的,实现粮食的安全生产。
致谢:感谢湖北省农业科学院植保土肥研究所薛敏峰博士在测序结果分析中给予的无私帮助!
