内侧丘脑不参与电针对疼痛记忆模型大鼠诱发情绪的干预作用*
2019-04-23何俏颖佘丽娇朱怡霖方剑乔邵晓梅
何俏颖 沈 醉 佘丽娇 朱怡霖 方剑乔 邵晓梅
(浙江中医药大学第三临床医学院浙江省针灸神经病学研究重点实验室,杭州310053)
已有研究发现对过去的疼痛产生的疼痛记忆会影响以后的疼痛经历并在慢性疼痛的发展过程中发挥重要作用,而疼痛经历和疼痛伴发情绪在疼痛记忆中共同起着关键作用[1]。疼痛伴发情绪作为疼痛记忆中的重要组成维度,是目前使疼痛病人的生活质量极大降低的重要原因,因此认识疼痛记忆过程中伴发情绪的调节机制越来越受到研究者的关注。
疼痛记忆伴随的疼痛感觉和疼痛诱发情绪主要由大脑中枢神经网络所调制,以往研究表明一些大脑区域,包括内侧丘脑、前扣带皮层、杏仁核的中央、基底外核及纹状体尾状核[2],其中内侧丘脑,是内侧疼痛系统的重要组成部分,可将脊髓获得的不同类型伤害性信息进行存储和整合通过脊髓丘脑束将信息传入皮层的重要中继站,其中喙侧内侧丘脑(medial thalamus,MT)涉及到疼痛的情感和动机方面[3]。Isseroff等[4]研究发现如果内侧丘脑受损,伤害性感受和情景记忆之间的联系将不能形成或延缓形成;中央内侧丘脑核参与疼痛情绪维度被认为取决于其对前扣带皮层(24区)和基底外侧杏仁核的强烈投射[5]。多方研究表明MT参与将伤害性信息传至大脑皮层,并在疼痛过程中对疼痛诱发情绪也有参与作用。目前未有研究明确MT是否可能参与疼痛记忆形成过程中的厌恶性情绪的产生及减弱或消除过程。
电针是针灸临床镇痛常用的治疗方法,多方临床及前临床研究表明针灸对慢性疼痛、疼痛记忆的疼痛感觉及疼痛情绪的改善疗效明确[6,7],然而目前尚未有电针抑制痛记忆的唤醒及疼痛诱发情绪的中枢相关神经环路调节机制的研究,而MT作为与疼痛感知及诱发情绪相关的一个信息整合及传递的重要核团[8],是否参与由继发性损伤引起疼痛记忆的诱发情绪过程,并且电针对疼痛记忆模型大鼠疼痛诱发情绪的干预机制是否通过MT这一核团实现,等机制仍有待深入研究。因此在本次研究中,拟通过MT核团定向电损毁术,观察MT在疼痛记忆模型大鼠伴发厌恶性情绪中的作用及电针干预作用,从痛感觉和痛情绪的较新层面和较深层次阐述疼痛记忆的形成和电针干预机制,揭示电针对疼痛记忆形成过程中疼痛诱发情绪的中枢干预机制是否通过作用于MT这一核团实现。
方 法
1.实验动物与分组
实验动物选用清洁级健康雄性SD大鼠51只,体重285~315 g,由浙江中医药大学实验动物中心提供。按分层随机化法将大鼠分成5组:空白组(C)、模型组(M) 10只、模型+电针组(M+EA)10只、损毁+模型组(L+M) 10只、损毁+模型+电针组(L+M+EA) 11只。实验过程中对动物的处置遵照中华人民共和国科学技术部2006年颁布的《关于善待实验动物的指导意见》。实验前适应性喂养一周,实验过程中,室温23~25 ℃,湿度40%~60%,自由饮水与进食。
2.主要试剂及仪器
0.9%氯化钠注射液(杭州民生药业有限公司);碘伏(江西健宝医药科技有限公司);水合氯醛(上海展云化工有限公司);3.0%过氧化氢(浙江三鹰化学试剂有限公司);角叉菜胶(carrageenan,Carr)(Sigma Chemical Co,St.Louis,MO,USA);75%医用消毒酒精(杭州欧拓普生物技术有限公司);尼氏(Nissl)染色液(C0117,碧云天);数字显示脑立体定位仪(深圳瑞沃德生命科技有限公司);体视显微镜(XTZ-03,上海光学仪器一厂);电动牙科钻(上海医用分析仪器厂);电损毁仪(#53500,UGO Basile,Italy);动态足底触觉仪(#37450,UGO Basile,Italy);ZAP胶(台湾);体温维持仪-大鼠型(69000,深圳瑞沃德生命科技有限公司);韩氏电针仪(HANS 200E,北京华卫产业开发公司);不锈钢颅骨固定螺钉(格罗贝尔生物科技公司);SMART 3.0小动物行为学视频采集与分析系统(Panlab,Spain);冰冻切片机(Thermo Fisher Scientific,USA)。
3.MT损毁术
手术当天取L+M组、L+M+EA组大鼠,采用7%水合氯醛(0.5 ml/100 g)腹腔麻醉,备皮。将大鼠头部固定于脑立体定位仪上。大鼠头顶部皮肤经消毒后采用眼科剪将皮肤剪开充分暴露颅骨的前囟、后囟和前额叶视野。根据大鼠脑立体定位图谱(第六版)确定内侧丘脑(medial thalamus,MT)的方位参数(2.76 mm posterior to bregma,±0.9 mm mediolateral,5.2 mm dorsoventral),并于各点做好标记。以牙科钻在颅骨表面小心打磨,穿透硬脑膜,直至在显微镜下可以观察到脑实质,然后将损毁电极经液压微驱动器缓慢推进电极末端至MT,将损毁电极上的线与电损毁仪相连接,启动输出恒定直流电。损毁参数:直流电,强度1 mA,频率50 Hz,持续30 s。完毕后待红色LED指示灯熄灭,关闭电源,移除电损毁仪。
4.造模与电针干预方法
根据Kissin等[9]的二次足底注射角叉菜胶的方法制备疼痛记忆模型。M组、M+EA组、L+M组、L+M+EA组大鼠分别在造模当天采用生理盐水配置的2%的Carr于左后足足底注射,剂量为100 μl,以诱导急性炎性痛,Carr首次左后足注射后14 d再次以同浓度同剂量的Carr于大鼠右后足足底注射。C组大鼠在相同时间点相同位置注射同剂量生理盐水。
L+M+EA组大鼠于Carr首次左后足注射造模后第5 h、1~5 d予EA干预治疗。取穴:双侧“后三里”及其下方1 cm处(李忠仁《实验针灸学》),每日1次,共6次。毫针规格:0.3 mm×13 mm。电针参数:恒流方波输出(脉冲宽度:0.6 ms 2 Hz,0.2 ms 100 Hz),频率2/100 Hz,强度1~2 mA(起始1 mA,以后每隔10 min增加0.5 mA)。电针持续时间:30 min。L+M组大鼠在相应时间点仅进行抓取固定。
5.取材及后固定
L+M组、L+M+EA组大鼠Carr二次右后足注射后2 d,行7%水合氯醛腹腔麻醉并处死大鼠,经4%多聚甲醛灌注、滴注后迅速取出大脑,多聚甲醛浸泡过夜,再经15%、30%蔗糖梯度脱水后放置入-80℃冰箱保存,备用于后续的冰冻切片及尼氏染色。
6.检测方法
(1)痛感觉检测
采用动态足底触觉仪机械测痛方法检测大鼠后足缩足阈(paw withdrawal threshold,PWT)作为机械痛阈值。每次检测时间为9:00 am~12:00 am。实验环境:室内温度23~25℃,湿度45%~55%,噪音40分贝以下。
PWT检测时间点分别为:-1 d、Carr首次注射后4 h、1 d、5 d、13 d及15 d,测痛部位为左右后足足趾部。将大鼠单独放入底面为铁丝网的透明有机玻璃盒中,盖上透气盖,适应15 min左右,直到大鼠停止探索、理毛、洗脸等活动后,开始检测。动态足底触觉仪上一不锈钢探针(直径0.5 mm)垂直上升至大鼠后足掌底中央部(避开足垫)后,再以速度为2.5 g/s逐渐增大刺激强度(刺激最大值为50 g),当大鼠发生缩足反应后探针立即停止,触觉仪自动记录缩足时的压力值,即为大鼠该次测量的PWT值。同法连续检测5次,每次间隔1~2 min,取其后四次的平均值作为PWT值。
主要统计Carr首次注射后各时间点PWT与Carr首次注射前PWT的差值(paw withdrawal threshold difference value,PWT D-value)。
(2)CPA检测
对Hummel等[10]的条件性位置范式进行修改,自制偏爱性情绪记忆范式箱体,并根据疼痛记忆模型的特点制定检测厌恶性情绪的方案。每次检测时间为9:00 am~4:00 pm。实验环境:室内温度23~25℃,湿度45%~55%,噪音40分贝以下。
条件性位置厌恶范式箱体分为两个等大的箱体(35 cm×28 cm×45 cm),中间一挡板可控制箱体独立或开放,分别用不同颜色(黑色和白色)、不同宽度条纹(3 cm宽和9 cm宽)的壁纸相间组合粗细条纹箱,底部为加网栅板(网格1 cm2左右)。在厌恶性情绪记忆范式箱体的正上方安装一摄像机,调整好影像画面。采用SMART 3.0小动物行为学视频采集与分析系统的视频采集软件自动开始计时,并进行实时录像和数据分析,观察并记录每只大鼠在30 min内两个箱体的活动时间。
整个实验流程分为三个阶段:
第一阶段为条件化前(pre):Carr首次左后足注射前1 d,箱体之间开放(去除中间挡板),观察大鼠30 min内在两箱体中的活动情况。根据所有大鼠在两个箱体的时间,随机分配每只大鼠的条件箱和非条件箱。
第二阶段为条件化:Carr首次左后足注射当天(0 d),在造模前30 min将中间挡板关闭,成为两个独立的箱体,将各组大鼠置于非条件箱中自由活动30 min以非条件化。Carr首次左后足注射后的第4 h开始对大鼠进行条件化训练30 min,此时间段挡板仍关闭。前5 min使大鼠在条件箱中适应,后25 min对大鼠左后足足底进行连续25次机械刺激(动态足底触觉仪调节参数为:以5 s内达到最大刺激值50 g的速度),每次刺激之间间隔1 min,记录刺激过程中抬足次数。
第三阶段为条件化后(post):各检测时间点为1 d、5 d、13 d、15 d。此期间检测过程中中间挡板被拆除,分别记录每只大鼠在条件箱中的活动时间。
主要观察的指标是CPA score值。CPA score值是条件化后(1 d)大鼠在条件箱自由活动的时间Tpost减去条件化前大鼠在条件箱活动时间Tpre-的差值(Tpost- Tpre),即 Tscore= Tpost- Tpre,来评价大鼠的痛厌恶情绪的情况。
(3)旷场
各组大鼠于Carr首次左后足注射后第16 d进行旷场实验以评判大鼠自发性探索运动活性及焦虑样行为。每次检测时间为9:00 am~12:00 am。实验环境:室内温度23~25℃,湿度45%~55%,噪音40分贝以下。
旷场是一1 m×1 m的正方体无盖木箱,将底边的纵横四边均匀分成4等分,共16小格。将外周12小格定义为外周区域,中间4小格定义为中央区域。在旷场的正上方安装摄像机,调整好影像画面。采用SMART V3.0小动物行为学视频采集与分析系统记录并分析10 min内大鼠的活动情况。主要记录大鼠在中央区域、外周区域的活动时间,进入中央区域的次数,在中央区域、外周区域的总运动路程。
(4)尼氏染色
从-80℃冰箱中取出脑组织,于冰上沿下丘脑从背侧向腹侧垂直切下,留前部分平摆于提前滴上OCT的冻头上,速置于冰冻切片机中复温约30 min。将复温好的脑组织连同冻头夹紧固定于切片机持承器上,启动粗/进退键,调整好切片角度,转动旋钮,将组织修平。调好欲切的厚度(FINE: 50 μm;TRIM:50 μm),开始冷冻冠状位连续切片,切片时,轻揭盖防卷板,以切出完整、平滑、不卷曲的切片为准,注意避免产生气泡,将粘附有脑组织切片的载玻片置于烘片机上过夜。将尼氏染色液置于37℃水浴箱中预热30 min,将粘附有脑片的载玻片于蒸馏水中浸泡5 s取出,将尼氏染色液滴于切片组织上(每个脑片4~5滴),置于37℃水浴箱中染色10 min,使染色均匀。于蒸馏水中洗涤2次(每次数秒即可)。先后于90%、70%的乙醇中分别浸泡1遍、2遍,每遍约10 s,最后在体视显微镜下观察MT损毁的位置。在本实验中,L+M组、L+M+EA组大鼠大脑的冠状位冰冻切片取前囟后2.16~3.48 mm,中线旁开± 0.9 mm,颅骨下5.3 mm观察MT损毁位置。其示意图如图1所示,此两组大鼠大脑经冠状位冰冻切片观察有7只大鼠损毁位置不在MT正确位置内,损毁电极放置正确率为75%,不在正确损毁位置内的大鼠予剔除,且不计入行为学结果及统计学分析。
7.统计方法
采用SPSS 19.0软件对数据进行统计学分析,所有实验数据以均数±标准误(±SEM)表示。多组间比较采用单因素方差分析,组间两两比较,方差齐时采用LSD检验。其中各组大鼠左后足Carr首次注射后1 d、5 d及Carr二次右后足注射后5 d PWT 方差不齐,采用Dunnett' s T3检验,均以P<0.05为差异有统计学意义。
结 果
1.组织学结果
MT损毁位置及代表切片示意图见图1。
2.各组大鼠PWT D-value值比较。
如图2所示,图2A和图2B分别为Carr首次及二次注射后左右后足PWT D-value值。如图2A所示,造模后4 h、1 d,与C比较,其余四组PWT D-value值均显著降低(P<0.01),提示Carr首次注射后造模成功,且在造模后1 d大鼠PWT仍保持较低水平。Carr首次注射后13 d,Carr注射后的四组大鼠痛阈基本恢复至造模前水平。Carr二次右后足注射后,与C组比较,M组大鼠未注射足(左后足)PWT D-value值显著降低(P<0.05),而M+EA、L+M、L+M+EA组大鼠左后足PWT D-value值无显著变化(P> 0.05)。与M组比较,L+M、L+M+EA组大鼠左后足PWT D-value值显著增加(P<0.01)。如图2B所示,Carr首次左后足注射后,与空白组比较,其余各组大鼠右后足PWT D-value值无显著改变,而Carr二次右后足注射后1 d,与C组比较,M组、EA组、L+M组大鼠右后足PWT D-value值显著降低(P<0.01,P<0.01,P<0.05)。表明早期电针干预可明显抑制疼痛记忆模型大鼠的疼痛感觉。
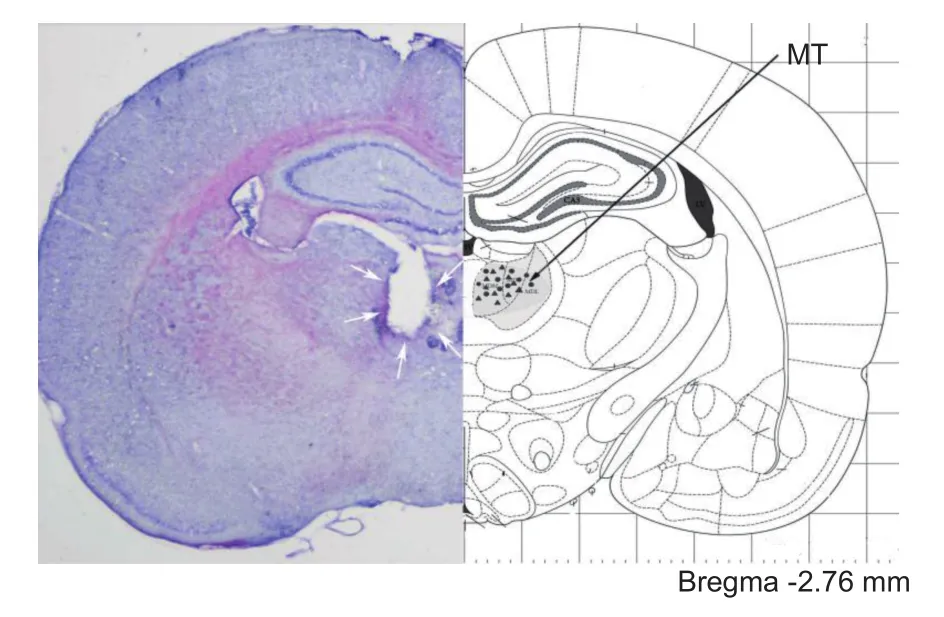
图1 MT损毁位置及代表切片示意图图左半侧为MT损毁后大鼠大脑冠状切片尼氏染色结果,其中白色箭头表MT损毁后确切区域;图右半侧为参照Paxinos等[11]的大鼠大脑图谱(第六版)绘制的前囟后2.76 mm (Bregma -2.76 mm)的冠状切片图,灰色区域表MT核团确切位置,▲表L+M组大鼠(10只)右侧MT损毁位置,●表L+M+EA组大鼠(11只)右侧MT损毁位置Fig.1 Location of lesion of the MT and representative schematic diagram The left half of the figure shows the results of Nissl staining of coronal slices of rats’ brain after MT lesion,and the exact location of MT lesion is marked with white arrows.The right half of the figure is a coronal section of 2.76 mm posterior to bregma (Bregma-2.76 mm) according to the atlas of Paxinos and Watson(sixth edition),the gray area presents the exact location of the MT,▲ indicates the location of lesion of the MT in L+M group rats (10 rats),● represents the location of lesion of the MT in L+M+EA group rats (11 rats).

图2 各组大鼠左后足(A)与右后足(B) PWT D-value值比较(±SEM)*P<0.05,**P<0.01,与C组同期比较;△P<0.05,△△P<0.01,与M组同期比较;#P<0.05,##P<0.01,与M+EA组同期比较Fig.2 Comparison of left hindpaw (A) and right hindpaw (B) of PWT D-value among all groups (±SEM)*P<0.05,**P<0.01,compared with group C;△P<0.05,△△P<0.01,compared with group M; #P<0.05,##P<0.01,compared with group M+EA.
3.各组大鼠CPA检验结果
如图3所示,在Carr首次左后足注射后1 d,5 d,13 d,CPA score值均为负值,各组间两两比较差异无统计学意义(P> 0.05);而在Carr二次右后足注射后1 d,与C组比较,M组、L+M组大鼠CPA score值明显降低(P<0.01)。Carr二次注射后可诱导M、L+M组大鼠疼痛厌恶性情绪,MT损毁后未抑制疼痛厌恶性情绪的产生。
4.旷场实验
如图4所示,图4A、4B、4C分别为各组大鼠中央区域运动时间、中央区域运动距离、总运动距离。与M组、L+M组大鼠同期比较,M+EA组大鼠中央区域运动时间、中央区域运动距离均有增多趋势,但无显著性差异(P> 0.05),L+M+EA组中央区域运动时间显著增多(P<0.05);与M+EA组、L+M组比较,L+M+EA组大鼠中央区域运动距离均显著增多(P<0.05,P<0.01);与C组同期比较,M组大鼠总运动距离显著下降(P<0.01),而L+M组、L+M+EA组大鼠总运动距离均显著增加(P<0.01);与M组同期比较,M+EA组、L+M组、L+M+EA组大鼠总运动距离均显著增多(P<0.05,P<0.01,P<0.01);与M+EA组同期比较,L+M组、L+M+EA组大鼠总运动距离均明显增加(P<0.01),而L+M组、L+M+EA组大鼠总运动距离差异无统计学意义。Carr二次右后足注射可诱导疼痛记忆模型大鼠焦虑样情绪的产生,且MT损毁未抑制疼痛记忆模型大鼠焦虑样情绪的出现。

图3 各组大鼠在Carr注射后各时间点的CPA score值的比较(±SEM)**P <0.01,与C组同期比较;△△P <0.01,与M组同期比较;※※P <0.01,与M+EA组同期比较;##P <0.01,与L+M组同期比较Fig.3 Comparison of CPA scores at various time points after Carr first injection of all group (±SEM)**P <0.01,compared with group C; △△P <0.01,compared with group M; ※※P <0.01,compared with group M+EA; ##P <0.01,compared with group L+M.

图4 各组大鼠在左后足Carr首次注射后15 d旷场实验中央区域运动时间(4A)、中央区域运动距离(4B)、总运动距离(4C)的比较(±SEM)4A:△P<0.05,与M组同期比较;#P<0.05,与L+M组同期比较;4B:△△P<0.01,与M组同期比较;※P<0.05,与M+EA组同期比较;##P<0.01,与L+M组同期比较;4C:**P<0.01,与C组同期比较;△P<0.05,△△P<0.01,与M组同期比较;※※P<0.01,与M+EA组同期比较;##P<0.01,与L+M组同期比较Fig.4 In an Open Field test,the travelled distance (4B) and the time spent in centre zone (4A),total travelled distance in the whole arena (4C) among 5 groups the 15th day after Carr first injection on left hindpaw were compared (±SEM)4A:△P<0.05,compared with group M; #P<0.05,compared with group L+M.4B: △△P<0.01,compared with group M; ※P<0.05,compared with group M+EA,##P<0.01,compared with group L+M.4C: **P<0.01,compared with group C; △P<0.05,△P<0.01,compared with group M; ※※P<0.01,compared with group M+EA; ##P<0.01,compared with group L+M.
讨 论
疼痛经历可被疼痛强度和疼痛不愉快感唤醒,临床上疼痛记忆的产生大多由于疼痛的继发性诱导。实验性研究中有关疼痛记忆模型的制备方法有很多,在本实验中采用的是经典的疼痛记忆模型制备方法,即Carr二次对侧足注射,也是模仿临床上疼痛的继发性诱导。在疼痛研究领域中,疼痛的定义经历了由原来只包括疼痛感觉到“并不止于疼痛感觉”的演变,其还包括疼痛情绪等其他维度,因此本实验评价方法主要从疼痛感觉和疼痛情绪两个方面阐述。本实验过程中,大鼠双侧MT损毁后,制备疼痛记忆模型大鼠,在此期间分别运用足底PWT检测、CPA、旷场实验检测双侧MT损毁后的疼痛记忆模型大鼠的疼痛感觉、疼痛诱发情绪及电针干预效应。采用动态足底触觉仪检测得到PWT D-value值来评估Carr二次右后足注射后诱导的继发性痛觉过敏是否唤醒了左后足的疼痛感觉记忆,CPA检测得到的CPA score值反应的是疼痛诱发厌恶性情绪变化情况,而旷场实验是检测大鼠焦虑样情绪及运动能力的经典检测方法之一,其分析数据包括大鼠进入中央区域时间、中央区域运动距离、总运动距离等。
电针是目前临床上缓解疼痛的主要治疗方法之一,大量临床和基础实验研究表明其通过作用于中枢神经环路而发挥镇痛作用,可明显抑制炎性痛、神经病理性痛、癌性痛等多种急慢性疼痛的疼痛感觉及炎性痛痛情绪。近年来,大量基础研究结果示电针对疼痛诱发的情绪改变疗效显著,如Yan等[12]研究表明电针通过作用于慢性神经病理性痛模型大鼠杏仁核中μ阿片受体而影响大鼠的痛感觉和情绪;弱刺激手针缓解神经病理性镜像痛大鼠负性情绪的机制可能与抑制ACC中小胶质细胞增殖活化相关[13];本课题组前期研究结果示2/100 Hz电针频率对疼痛记忆的唤醒有抑制作用,且早期电针干预比晚期电针预处理对缓解疼痛记忆的产生具有更显著的干预疗效[14],因此本次研究主要延续前期研究成果,采用2/100 Hz频率早期电针干预。我们的初始假说认为MT损毁后,Carr首次左后足注射诱导大鼠急性炎性痛后其疼痛感受及疼痛厌恶性情绪均会随之减弱,Carr二次对侧足注射后其疼痛记忆及疼痛诱发情绪将不会被唤醒。值得关注的是,Carr二次右后足注射后,M组大鼠左后足PWT D-value值显著降低,而L+M、L+M+EA组大鼠左后足PWT D-value值仍较高,此两组大鼠在Carr二次注射后左后足未出现疼痛感觉记忆唤醒现象,提示双侧MT损毁后,影响了疼痛记忆模型大鼠的疼痛感觉记忆唤醒过程。笔者认为其中可能原因:Carr足底注射,大鼠足底伤害性感受显著增加,表现为机械缩足阈显著降低,而疼痛记忆现象是一个长期的学习记忆的高级认知过程,需要经双侧MT之间将外周伤害性感受信息进行交换、整合并传递至皮层[15],而双侧MT损毁后,阻断了双侧MT之间进行信息交流、整合并传至更高级疼痛感受处理加工的核团,因此Carr二次右后足注射后大鼠左后足疼痛感觉记忆将不再被唤醒。
与初始假说相反的是,CPA检测结果示L+M组大鼠在Carr二次对侧足注射后CPA score值显著降低,与M组、L+M组大鼠比较,M+EA组、L+M+EA组MT损毁后的疼痛记忆模型大鼠CPA score值显著增加,MT损毁后的大鼠仍产生了对条件箱的回避行为,提示MT损毁后的疼痛记忆模型大鼠疼痛记忆被唤醒,而早期电针干预抑制了疼痛记忆模型大鼠厌恶性情绪;旷场实验中,与C组比较,M、L+M组大鼠中央区域运动时间减少,而电针干预后,与模型组比较,M+EA组、L+M+EA组大鼠中央区域运动时间、中央区域运动距离、总运动距离均增加,提示早期电针干预可有效缓解疼痛记忆模型大鼠焦虑样情绪的产生。与M+EA组同期比较,L+M组、L+M+EA组大鼠总运动距离均明显增加(P<0.01),而L+M组、L+M+EA组大鼠总运动距离差异无统计学意义,提示MT损毁后的疼痛记忆模型大鼠活动能力在一定程度有所增加。总之,双侧MT损毁后,并未对疼痛记忆模型大鼠诱发的厌恶性情绪形成及改变过程产生一定抑制作用,也不会减弱或消除Carr二次注射后产生的厌恶性情绪的记忆,MT可能不在疼痛记忆模型大鼠疼痛诱发情绪及中发挥关键作用,而且电针对诱发情绪的干预过程可能不是通过MT这一核团实现。
针对此研究结果,做出以下推测:第一,Carr先后两次注射诱导的疼痛记忆模型大鼠的疼痛诱发情绪,关于外周至中枢的神经传导通路中,脊髓-杏仁核或脊髓-ACC神经环路的作用可能比脊髓-MT通路的作用更显著、更重要。例如,Bushnell等[16]在1989年研究证明脊髓-丘脑通路投射到边缘系统中的各个结构,并认为在痛情绪的加工过程中发挥作用;Seok等[17]研究表明内侧隔核在内侧隔核-杏仁核或内侧隔核-海马神经环路中作为一中结点核团而在伤害性刺激诱导的情绪变化中发挥关键作用。第二,经查阅相关文献,也有研究表明MT在疼痛情绪信息的传递与参与作用是有限的,如:Wang等[18]研究表明MT不参与内脏疼痛负面情绪的加工过程;Jurik等[19]运用化学遗传将内侧丘脑室旁核特异性抑制后改变了内脏疼痛行为,而未见其对痛情绪行为的影响。Wilson等[20]的研究表明,在福尔马林诱导的急性炎性痛模型中,MT损毁并未诱导大鼠的厌恶性情绪减弱或消失,MT在编码疼痛强度和痛情绪维度的作用是有限的,他们推测其中的原因可能是MT的损毁中断了MT与前扣带皮层(anterior cingulate cortex,ACC)之间的连接,而ACC是边缘系统不可分割的一部分,是处理痛情绪的核心,它对疼痛的感知、疼痛不愉快感的认知和评估非常重要[21]。MT-ACC通路的连接中断,可能加强了其他核团与ACC之间的二级连接,以补偿来自MT的伤害性信息输入缺失。本实验中MT损毁后在Carr先后交叉注射后诱导疼痛记忆模型,疼痛诱发情绪仍然发生,可能也与该研究中推测原因一致。ACC是参与情绪调控的终极核团,而MT只是作为伤害性信息加工并将疼痛感觉、疼痛情绪进行整合及传递至皮层的中继核团。如果MT损毁,那么传递至MT这样一个信息整合中枢的信息将被迫中断,外周伤害性信息还是可能会通过其他调控通路而传至ACC,并产生相应情绪改变。第三,内侧丘脑中包括8~12个不同核团,这些核团的大小、传入传出连接及神经化学特性方面各有不同[20],这也使得它们在疼痛调节过程中表现出独特的作用,这些单个核团尺寸大小不一、位置各有不同,因此为成功精确损毁操作过程提供了一定难度。此外,不同研究团队通过不同行为学检测方法探讨MT在疼痛加工过程中的作用,且定义MT损毁位置也有不同的评判标准,如Munn等研究表明丘脑束旁核(PF)内注射吗啡明显抑制了由尾部电击-发声范式诱发的恐惧反应[22]。在本实验中,MT损毁位置严格的纳入标准是背内侧丘脑(MDM和MDM)、背内侧中央丘脑(MDC)、丘脑中央核(PL和PC),那么除此之外的MT中其他核团之间的相互连接是否对疼痛记忆模型大鼠疼痛诱发情绪产生代偿调节作用还有待进一步探讨。
本实验研究结果表明MT损毁后明显影响了疼痛记忆模型大鼠的疼痛感觉但不对疼痛诱发情绪产生作用,MT在疼痛记忆模型大鼠的疼痛诱发情绪可能不发挥关键作用,早期电针干预可明显缓解MT损毁后疼痛记忆模型大鼠疼痛感觉及疼痛诱发情绪改变,而电针对疼痛记忆模型大鼠疼痛诱发情绪的干预机制可能不是通过MT这一核团实现。当然,本实验也存在未设计假手术组,未检测MT损毁后的疼痛记忆模型大鼠的热痛阈值的不足,将在以后研究中补充这些不足,也将对MT中特异性核团与疼痛情绪相关的核团之间的相互连接是否对痛记忆模型大鼠疼痛诱发情绪产生代偿调节作用做进一步探讨。
