骨髓间充质干细胞移植治疗大鼠复杂性区域疼痛综合征I型的疗效及机制研究*
2019-04-23郭凯凯徐龙河路桂军姜雨鸽米卫东
郭凯凯 徐龙河 路桂军 姜雨鸽 米卫东
(解放军医学院 解放军总医院第一医学中心麻醉手术中心,北京 100853)
复杂性区域疼痛综合征[1](complex regional pain syndrome,CRPS) 是一种继发于局部损伤或/和全身性疾病之后出现的以严重的慢性痛觉异常,伴有区域性自主神经功能紊乱/萎缩、组织营养不良、微循环和运动功能障碍等为主要临床表现的慢性疼痛综合征。根据交感神经的关系及有无明确的神经损伤,通常将CRPS分为两型;CRPS-I型又称反射性交感神经营养不良症 (reflex sympathetic dystrophy,RSD);CRPS-II型也称灼性神经痛。顽固且多变的疼痛和痛觉过敏,疼痛程度、范围与刺激损伤部位不一致是CRPS-I 型最主要的临床特征。随着病情的进展,患肢常出现不同程度的功能缺陷甚至畸形,致残率很高[2]。CRPS病理机制尚未明确,暂无有效治疗手段,最终疾病进展并严重影响病人生存质量。
近年来应用骨髓间充质干细胞 (bone marrow derived stroma cells,BMSCs) 移植治疗神经系统疾病在动物实验和临床研究上均获得了肯定的疗效,能够极大地保护神经元损伤,促进神经元再生,恢复神经功能等,因而越来越受到学者的青睐[3]。然而应用BMSCs移植治疗CRPS的相关研究目前国内外鲜有报道。本研究采用鞘内注射BMSCs治疗CRPS-I型大鼠的脊髓,观察其对CRPS-I大鼠的治疗效果,并探讨其治疗相关机制,力求为BMSCs治疗CRPS的临床应用提供实验依据。
方 法
1.材料
健康成年雄性SD大鼠,体重250±20 g,购自解放军总医院医学实验动物中心。LG-DMEM 培养基、胰酶、胎牛血清和1%青霉素/链霉素(美国Gibco公司);FITC-CD44、FITC-CD105、PE-CD45、PE-CD90和PE-CD11b抗体(美国e-BIOSCIENCE公司);TIANscript RT Kit(北京天根生化科技有限公司);Hot Start Fluorescent PCR Core Reagent Kits(SYBR Green I) (意大利BBI公司);山羊抗兔二抗、山羊抗小鼠二抗、兔抗山羊二抗 (北京中山金桥公司);流式细胞仪(德国Partec公司);MCO-15AC型CO2孵育箱(日本SANYO公司);IX-70型倒置显微镜(日本Olympus公司);Nanodrop®ND-1000(美国NanoDrop公司);Agilent 2100 生物分析仪购自安捷伦科技公司;Prism®7300实时荧光定量PCR仪(美国ABI公司)。
2.方法
(1)大鼠BMSCs的分离培养:采用贴壁法培养BMSCs。脱臼处死四、五周龄SD大鼠,获取股骨、胫骨的骨骺端,PBS反复冲洗骨髓腔,收集骨髓冲洗液。反复吹打成单细胞悬液,1 500 rpm离心5 min,弃上清。调节细胞密度为(1~3)×106/ml接种至含10%胎牛血清,100 U/ml青霉素,100 U /ml链霉素的DMEM F12 培养液的细胞培养瓶,在37℃、5%CO2饱和湿度的培养箱中培养。培养48 h后全量更换完全培养液,弃去非贴壁细胞,纯化细胞,每3天更换一次培养液。待细胞长至80%左右融合时,0.25%胰蛋白酶,以1:3的比例传代。取第3代生长良好的细胞进行实验研究。
(2)大鼠BMSCs的鉴定:细胞表型鉴定:收集第3代骨BMSCs,PBS制成单细胞悬液,调节细胞密度为1×106/ml。分别加入荧光直标的CD90、CD44、CD45、CD11b单克隆抗体。混匀后避光条件下孵育30 min,用PBS缓冲液洗涤3次,每组样品设立阴性对照。采用流式细胞仪进行检测。
成脂和成骨诱导分化:收集第3代骨BMSCs接种于6孔细胞培养板,细胞融合达 80%以上后,分别添加成脂诱导分化培养基和成骨诱导分化培养基。每3 d更换1次细胞培养液,其中成脂细胞诱导剂诱导12 d后,油红O染色细胞后倒置显微镜下观察拍照;成骨细胞诱导剂诱导18 d后,茜素红染色细胞后倒置显微镜下观察拍照。
(3)CRPS-I型动物模型建立:所有实验大鼠术前禁食12 h,自由饮水。大鼠称重后,3%戊巴比妥钠50 mg/kg 腹腔内注射麻醉后,固定于小动物手术台,待麻醉生效后备皮,之后先用剪去两头的3 ml注射器套筒套在大鼠右后肢上,圆型橡胶环(内径5.0 mm)通过注射器套筒套扎于大鼠右后肢踝关节上方1.5 cm处,3小时后剪断橡皮环[4]。手术1周后进行机械性缩足反射阈值(thermal withdrawal latency,MWT)和热缩足反射潜伏期 (mechanical withdrawal threshold,TWT)测定。若MWT和TWT值降低百分之五十以上即可判断造模成功。
(4)实验分组和BMSCs移植:大鼠称重后,3%戊巴比妥钠50 mg/kg 腹腔内注射麻醉后取俯卧位,腹部垫物使腰部拱起。L4-5腰部备皮消毒。微量进样针与水平面呈30°角度沿棘间韧带穿刺硬脊膜进入蛛网膜下腔。鞘内注入10 μl的细胞悬液(细胞浓度约1×107/ml)。采用随机数字表法将实验大鼠随机分为空白组(未接受任何干预的大鼠),模型组(未接受任何干预的CRPS-I型大鼠模型),治疗组(接受鞘内BMSCs移植治疗的CRPS-I型大鼠模型),对照组(接受鞘内细胞培养液注射的大鼠)。每组15只大鼠。
(5)动物模型行为学测定:热缩足反射潜伏期(TWL) 的测定[5]:安静的环境下,将实验大鼠置于透明玻璃板上适应30 min,以BME-410C型自动热痛刺激仪记录热缩足潜伏期 (TWL)。测试前调好焦距和光强度,使焦点对准大鼠足底,从照射开始至大鼠出现抬腿的时间为TWL(单位s)。每次刺激间隔10 min以上,每只动物测定5次并取其平均值。
机械缩足反射阈值 (MWL) 的测定[6]:安静的环境下,将实验大鼠置于金属筛网上适应30 min,以Von Frey纤毛丝刺激大鼠足底皮肤,逐渐加大刺激强度,至大鼠对刺激出现快速缩足或添足行为时的刺激强度值即为MWT。每次刺激间隔10 min以上,每只动物测定5次并取其平均值。
(6)免疫荧光染色测定大鼠背根神经节中BDNF的表达:大鼠背根神经节石蜡切片脱蜡、水化和抗原修复,固定液固定切片,加入免疫染色封闭液,封闭60 min。加入稀释好的一抗(1:500,兔抗大鼠,Abcom,美国),4℃孵育过夜。滴加生物素标记的山羊抗兔二抗 (1:200),37℃恒温箱中孵育1 h。甘油封片、镜检。
(7)实时荧光定量PCR测定大鼠背根神经节中BDNF和炎性因子的mRNA水平:收集实验各组大鼠背根神经节,采用Trizol法抽提取组织总RNA。Agilent 2100 生物分析仪检测提取RNA的完整性,NanoDrop®ND-1000测定提取RNA的浓度和纯度。按照TIAN script RT Kit 的说明进行cDNA 的合成。构建50 μl反应体系:Total RNA 40 μg,10×DNase I buffer 5 μl, RNase Inhibitor 20 U,DNase I (RNase-free) 2 μl (10 U),加入RNase free dH2O至总体积50 μl。反应条件:42℃反转录50 min,95℃ 5 min灭活反转录酶。构建20 μl的Realtime PCR反应体系:RT product 1 μl,10 µM 的PCR特异引物F 1 µl,10 µM 的PCR特异引物R 1 µl,2×Master Mix 10 μl,Nucleasr-Free Water 7 μl。反应条件如下:96℃ 4 min;然后94℃ 30 s,58℃30 s,72℃ 30 s,共40个循环。收集荧光信号,以U6为内参基因, 2-△△CT法分析检测基因表达的相对定量值。各检测基因引物,见表1。
(8)免疫印迹法(Western Blot)检测大鼠背根神经节中BDNF和炎性因子蛋白表达:收集实验各组大鼠背根神经节,使用RIPA裂解液裂解提取组织中的蛋白,BCA方法进行蛋白定量检测。将蛋白样品中加入适量浓缩的SDS-PAGE蛋白上样缓冲液,沸水浴加热5 min以充分变性蛋白。冷却至室温后,将蛋白样品直接加入到10% SDS-PAGE胶的上样孔内电泳3 h,然后转印至硝酸纤维素膜上。转膜完毕后,移至含有封闭液的平皿中,室温下脱色摇床上摇动封闭1 h。先后加入稀释好的一抗孵育和辣根过氧化物酶(HRP)标记的二抗孵育。ECL法显色,GIS凝胶图像分析系统照相,Image Studio图像分析软件分析图片。
3.统计学分析
采用SPSS 19.0统计软件进行统计学分析。实验数据采用均数±标准差 (±SD)表示。痛阈改变的比较采用重复测量方差分析,多重比较采用LSD法。而BDNF及炎症介质的比较采用单因素方差分析,多重比较采用LSD法。P<0.05为差异具有统计学意义。
结 果
1.大鼠BMSCs的鉴定
光镜下观察BMSCs呈典型多角形或者不规则的梭形贴壁生长,两端有较长突起,胞核为圆形或者椭圆形(见图1)。流式细胞仪检测结果显示(见图2), BMSCs的重要标志物CD44和CD90的表达阳性率均大于90%;而CD45和CD11b的表达阳性率均不足5%。成骨诱导后茜素红染色显示培养细胞有明显的矿化结节形成(见图2 A);成脂诱导后油红O染色显示培养细胞内含鲜红色串珠样或大的融合脂滴(见图2 B)。

表1 PCR引物序列Table 1 PCR primer sequences
2.BMSCs移植对CRPS-I型动物模型行为学的影响
模型组大鼠术后各时间点TWL值和MWL值均较术前和空白组大鼠显著减少(P<0.05);BMSCs移植后的治疗组大鼠术后各时间点TWL值和MWL值均有上升,同模型组比较有统计学差异(P<0.05);而对照组大鼠术后各时间点TWL和MWL值同模型组相比较无统计学差异(P> 0.05,见图3、4)。
图1 A:大鼠MBSCs显微镜图 标尺= 20 μm (×10);B、C、D共聚焦原始图 标尺= 20 μm (×10、×20、×40)Fig.1 A: Microscopic maps of rat MBSCs,Scale bar = 20 μm(×10); B,C,D: Original Confocal maps.Scale bar =20 μm (× 10,× 20,× 40)
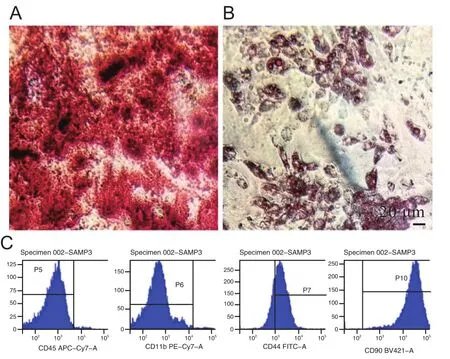
图2 骨髓间充质干细胞成骨分化(A)、成脂分化(B)及流式细胞仪检测骨髓间充质干细胞表面标志物的表达(C) 标尺= 20 μm (×200)Fig.2 Flow cytometry was used to detect the surface markers expression of bone marrow mesenchymal stem cells,the osteogenic differentiation (A) and the adipogenic differentiation (B) of bone marrow mesenchymal stem cells.Scale bar = 20 μm (× 200)

图3 各组大鼠不同时点TWL(s)的比较(±SD,n = 15)*P<0.05,同空白组相比;#P<0.05,同模型组相比Fig.3 The comparison of TWL(s) in different time point of different group rats (±SD,n = 15)*P<0.05,compared with Sham group; #P<0.05 compared with group Model.

图4 各组大鼠不同时点MWL(g)的比较(±SD,n = 15)*P<0.05,同空白组相比;#P<0.05,同模型组相比Fig.4 The comparison of MWL(s) in different time point of different group rats (±SD,n = 15)*P<0.05,compared with Sham group; #P<0.05,compared with group Model.
3.BMSCs移植对大鼠背根神经节BDNF表达的影响
如图5所示,模型组和对照组大鼠背根神经节中BDNF免疫荧光强度明显高于空白组。BMSCs移植后的治疗组大鼠BDNF免疫荧光强度则明显低于模型组和对照组。
4.BMSCs移植对大鼠背根神经节BDNF和炎性因子mRNA表达的影响
如图6实时荧光定量PCR结果所示,模型组大鼠BDNF、CGRP、SP、TNF-α和IL-6 mRNA的表达水平均较空白组显著升高(P<0.05);对照组大鼠各因子mRNA的表达同模型组相比较无统计学差异(P>0.05);BMSCs移植后的治疗组大鼠各因子mRNA的表达均低于模型组术后,比较有统计学差异(P<0.05)。
5.BMSCs移植对大鼠背根神经节BDNF和炎性因子蛋白表达的影响
如图7示:模型组大鼠BDNF、CGRP、SP、TNF-α和IL-6 mRNA的蛋白表达的灰度值均明显高于空白组 (P<0.05);对照组大鼠各因子蛋白表达同模型组相比较无统计学差异(P> 0.05);BMSCs移植后的治疗组大鼠各因子蛋白表达的灰度值均低于模型组,比较差异有统计学意义(P<0.05,见图8)。

图5 大鼠背根神经节BDNF免疫荧光图及统计图 标尺= 20 μm (× 200)#P<0.05,同空白组相比;*P<0.05,同模型组相比Fig.5 Immunofluorescence of BDNF in rat dorsal root ganglion Scale and Statistical analysis scale bar = 20 μm (×200)#P<0.05,compared with group Sham; *P<0.05,compared with group Model.
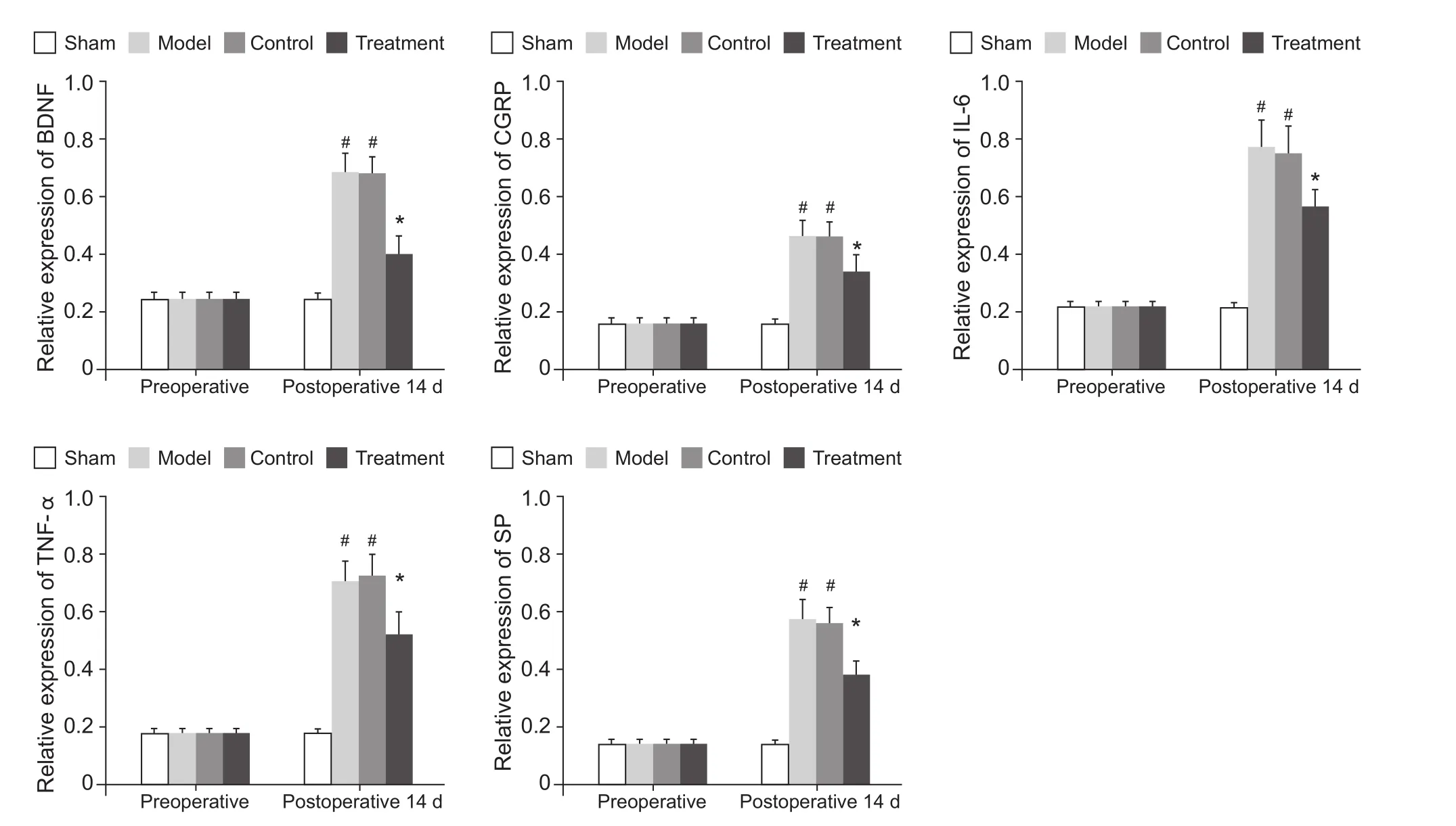
图6 BMSCs移植对大鼠背根神经节BDNF和炎性因子mRNA表达的影响 (±SD)#P<0.05,同空白组相比;*P<0.05,同模型组相比Fig.6 The effects of BMSCs transplantation on the expression of BDNF and inflammatory factors in rat dorsal root ganglion (±SD)#P<0.05,compared with group Sham; *P<0.05,compared with group Model.

图7 BMSCs移植对大鼠背根神经节BDNF和炎性因子蛋白表达的影响Fig.7 The effects of BMSCs transplantation on the protein expression of BDNF and inflammatory factors in rats dorsal root ganglion

图8 大鼠背根神经节BDNF和炎性因子蛋白水平表达(±SD)*P<0.05,同空白组相比;#P<0.05,同模型组相比Fig.8 Statistical analysis of protein expression of BDNF and inflammatory factor in dorsal root ganglion (±SD)*P<0.05,compared with group Sham; #P<0.05,compared with group Model.
讨 论
CRPS-I型为CRPS 的主要类型,有统计显示正常人群患病率为0.05%~0.15%,尤其外伤后患病率高达35%~64%。疼痛、痛觉过敏以及局部交感神经的改变(皮温升高、皮肤红肿、泌汗异常等)是CRPS-I型最主要的临床特征,其是涉及多系统损害的致残性疾病[7]。CRPS-I型具体病理机制尚不明确,因而临床上针对CRPS的治疗一直都是面临着巨大的挑战[8]。由于神经元为不可再生细胞,因此损伤处神经元往往无法进行再生和修复。BMSCs为多能干细胞,具有较强的自我更新和分化能力。在合适条件下可分化为骨/软骨、肌肉/肌腱、神经样细胞、心肌细胞、脂肪细胞等多种细胞,因而在再生医学领域里的应用备受关注[9,10]。近年来医学研究通过移植BMSCs治疗中枢神经系统疾病,且已经取得了一定的效果。Wang等[11]研究发现,尾静脉注射BMSCs能有效修复2,5-己二酮中毒导致的脊髓神经细胞损伤,且显著改善模型大鼠的神经行为。Zong等[12]采用VEGF转染BMSCs后移植入急性脑梗死模型大鼠,能明显改善中脑动脉闭塞导致缺血性神经功能缺损。这些令人鼓舞的研究结果为干细胞治疗神经系统疾患开辟了新的领域。
本次实验在获取BMSCs方面,我们采用的是全骨髓贴壁培养法,利用BMSCs贴壁速度快的特性来分离纯化大鼠骨髓组织中的BMSCs。通过显微镜下观察,干细胞细胞表型分析、成脂和成骨诱导分化证明所得到的细胞为BMSCs。动物模型我们采用是基于损伤缺血的发病假说的CPIP模型,研究证实该模型能模拟CRPS-I型相似的疼痛症状[4]。造模后采用TWL和MWL对模型大鼠行为学改变情况进行评估。结果显示造模后7 d时大鼠TWL值和MWL值均显著减少,提示模型大鼠的痛觉加重和痛觉过敏,这与其他报道的实验结果一致,证明模型建立成功。本实验对CRPS-I型大鼠模型进行了BMSCs鞘内注射移植。经过BMSCs移植后,大鼠术后各时间点TWL值和MWL值均有上升,提示BMSCs移植能够缓解CRPS-I型大鼠肢体的疼痛和痛觉敏化状态。
BMSCs移植治疗神经系统疾病的机制可能为[13,14]:①再生与分化后的替代机制。即BMSCs具有的多向分化潜能,移植入后通过归巢作用到达受损神经区域分化成相应的神经元、少突胶质细胞或星形胶质细胞。②旁分泌机制。BMSCs能分泌调节神经元的存活及轴突再生的神经营养因子、抗炎因子、血管新生因子等,并形成有利于脊髓修复的微环境。虽然CRPS-I型发生的具体病理生理机制尚不明确。但是目前的研究证实多种神经和炎性因子的释放 (如BDNF、CGRP、SP、TNF-α和IL-6)在CRPS-I型的发病过程中起着至关重要的作用。BDNF主要在中枢神经系统表达的神经营养因子。其在损伤后的神经组织中表达明显升高,有助于神经元损伤后的再生/修复和防止神经系统退行性变等。然而,BDNF在促进神经功能恢复的同时也会产生的不良影响,如导致神经病理性疼痛和反射亢进等[15]。有研究发现[16]CRPS大鼠患肢神经组织中的BDNF呈明显过表达,提示其与CRPS导致的痛觉和痛觉过敏密切相关。CGRP、SP、TNF-α和IL-6是目前已经证实的与神经源性炎症密切相关的神经肽和细胞因子[17,18]。在CRPS动物模型中发现,CGRP、SP、TNF-α和IL-6不仅仅在损伤的神经组织中,在邻近神经肌肉中表达也有所升高,这提示神经肽与多种细胞因子在神经源性炎症播散中起着不容忽视的作用[19]。本研究中,CRPS-I型模型大鼠背根神经节中BDNF、CGRP、SP、TNF-α和IL-6 mRNA和蛋白的表达均较普通大鼠显著升高。经BMSCs鞘内注射移植后,模型大鼠背根神经节中各因子mRNA和蛋白的表达均明显降低。其可能机理在于移植BMSCs能够修复CRPS-I型模型大鼠受损的神经,减少受损神经和周围组织中BDNF、CGRP、SP、TNF-α和IL-6这些神经肽和炎症细胞因子的释放,进而缓解神经病理性疼痛。
虽然本实验结果提示BMSCs移植能够改善CRPS-I型模型大鼠的症状。其机理可能在于BMSCs修复受损的神经,减少受损神经和周围组织中神经肽和炎症细胞因子的释放来发挥其生物学效能。此外,有研究报道BMSCs移植存在致瘤风险。本实验中BMSCs体外分化过程中未见异常染色体核型。但由于本实验周期较短,其BMSCs移植后的生物安全性尚待进一步研究论证。
