MicroRNA在外周神经损伤所致神经病理性疼痛中的作用*
2019-04-23郭佳宝陈炳霖彭梦思陈佩杰王雪强
郭佳宝 陈炳霖 朱 毅 宋 歌 彭梦思 陈佩杰△ 王雪强△
(1上海体育学院运动科学学院,上海200438; 2徐州医科大学医学技术学院,徐州 221004; 3郑州大学附属第五医院肌骨疼痛康复科,郑州470000)
神经病理性疼痛(neuropathic pain,NP)是由躯体感觉神经系统的损伤或疾病而直接造成的疼痛,常见病因包括代谢性疾病(如糖尿病)、病毒感染(如带状疱疹病毒)、神经毒性药物的使用(如化疗药物)和外伤等。据一项流行病研究的系统评价显示,一般人群中NP的患病率约为7%~10%[1]。主要表现为自发性疼痛、痛觉超敏、痛觉过敏和继发性痛觉过敏,此外,还可能伴有疼痛部位的感觉缺失、自主神经功能紊乱等症状。与生理性疼痛相比,NP在损伤痊愈或病灶去除后,疼痛仍可能持续,甚至转化为慢性疼痛。NP顽固性的特点显著降低了病人的生活质量(如睡眠、工作、社交和休闲娱乐),并使其出现焦虑和抑郁的情绪问题[2]。然而现有的治疗方式还不能完全有效控制NP诱发的疼痛,故NP的管理仍然是一项挑战,这在一定程度上是由于目前NP相关分子机制尚未完全阐明。近年来,已在基础研究中发现微小RNA (microRNA,miRNA)参与了NP的发生和发展[3]。miRNA在细胞中具有特定的调控功能,可以抑制同源靶基因的表达,这提示了miRNA可能通过调控疼痛相关靶基因从而实现在NP中的作用。故本文将围绕外周神经损伤所致NP的miRNA调控作用及可能机制进行阐述,以期为NP管理提供新的研究思路。
一、miRNA的概述
miRNA是内源性非编码微小RNA,长度约23个核苷酸,它是由一个带有发夹形二级结构的长RNA转录物经过两步剪切反应而产生[4]。第一步是释放柄环,称为miRNA前体,第二步由miRNA前体加工为成熟的miRNA。柄环有3'端和5'端两条臂,能各自产生功能性的miRNA,miRNA-3p和miRNA-5p的命名就是根据其是从miRNA前体的3'端臂还是5'端臂加工而来的。随后miRNA功能的实现是通过与靶信使RNA (mRNA) 3'端非编码区(untranslated region,UTR)的不精确碱基互补配对引起靶mRNA的降解或抑制其翻译。1993年,Lee等[5]在研究线虫时序性发育时发现了第一个miRNA基因lin-4。随后2001年Science上发表关于miRNA系列研究,证明miRNA广泛存在于动植物细胞中,如蠕虫、蝇类、植物和哺乳动物[6,7]。据估计在人类基因中,超过三分之一的基因表达都受到miRNA的调控,miRNA参与人体内重要生物调节过程,如细胞的增殖、分化、凋亡等[8]。miRNA在各物种间具有高度保守性,脊椎动物中已发现的miRNA有一半具有同源性[9]。Li等[10]比较慢性坐骨神经压迫模型(sciatic chronic constriction injury,CCI)大鼠与假手术大鼠背根神经节(dorsal root ganglion,DRG)、脊髓、海马和前扣带皮层miR-203的表达差异,发现仅在脊髓中miR-203显著下调。综上,miRNA具有时序性、高度保守性和组织特异性的特点。此外,miRNA作为表观遗传机制的重要参与者,与DNA甲基化、组蛋白修饰存在密切关系。一方面,DNA甲基化和组蛋白修饰可影响miRNA的成熟过程;另一方面miRNA可通过调控DNA甲基转移酶的表达或改变组蛋白修饰等途径来调节表观遗传[11]。
二、NP病理生理机制
NP的病理生理机制极为复杂,目前主要涉及外周水平、脊髓水平和脑水平,疼痛传递路径见图1[12]。在外周水平,外周敏化是重要机制。伤害性刺激(如热、冷、化学物质、压力刺激)侵袭外周伤害性感受器,传入由DRG神经元发出的有髓鞘Aβ纤维、Aδ纤维或无髓鞘C纤维中,经DRG胞体投射到脊髓背角。其中外周神经损伤后炎性介质,如P物质、组织胺、前列腺素等能作用于伤害性感受器,使传入神经兴奋性升高,放大其传入的疼痛信号,引起外周敏化。在脊髓及脑水平,中枢敏化是主要机制。外周传入神经元长时间或过度的超兴奋触发了脊髓背角前、后突触易化,导致突触传递效率的长时程增强,正常或阈下刺激也能引起动作电位,并向脊髓上水平传递,形成中枢敏化[13]。脊髓背角是中枢神经系统接收疼痛传入信号的第一站,经初步整合后上传至丘脑,丘脑核团组成投射系统将信息进一步传递到大脑皮层引起痛觉。其中脊髓丘脑侧束和前束接收脊髓感觉信息后上传至丘脑腹后外侧核,负责处理感知和疼痛的辨别;脊髓脑桥臂旁束接受信息后上传至边缘系统,负责疼痛的情感。
三、NP诱导miRNA在神经系统各部位的表达
为使分析简明,本文选取CCI、坐骨神经分支选择性损伤(spared nerve injury,SNI)和脊神经结扎(spinal nerve ligation,SNL)这三种模型进行讨论。检索PubMed、EMBASE、Web of Science、Ebsco数据库,检索日期为建库至2018年5月。检索式为("MicroRNA*" OR "mir*" OR "micro RNAs" OR "micro RNA" OR "micro-RNAs" OR "micro-RNA")and("sciatica*" OR "chronic constriction injury" OR "CCI"OR "spinal nerve ligation" OR "SNL" OR "spared nerve injury" OR "SNI")。经过系统检索后,对这三种NP模型中miRNA在DRG、脊髓和脑中的表达变化进行分类阐述,已被验证性实验证明的miRNA结果见表1。
1.DRG
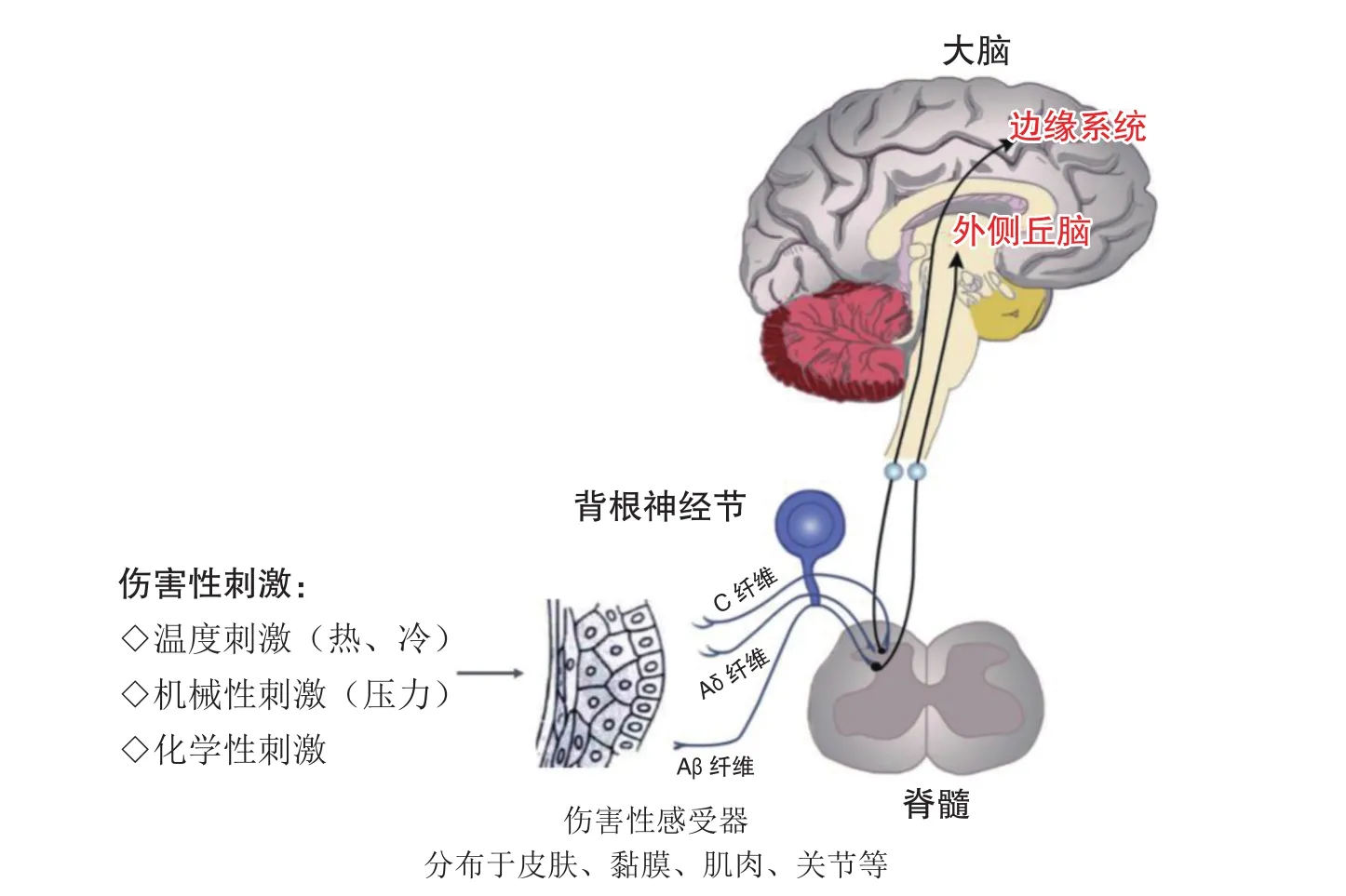
图1 神经病理性疼痛的主要传递路径

表1 NP模型中miRNA的差异性表达
DRG是NP研究的主要外周神经组织,内有接受躯体、四肢伤害性刺激传入的初级感觉神经元。在芯片技术检测中,Chang等[48]采用SNL模型的大鼠,检测发现损伤后DRG中上调的miRNAs有14个,下调的有20个。随后NP诱导DRG中miRNA表达的改变在实验中得到验证,如已验证了miR-132-3p、miR-21表达的上调[18,21],miR-96、miR-141、miR-206、miR-183、miR-30b、miR-126、miR-182、miR-7a、miR-143和miR-142-3p表达的下调[3,14~17,19,20,22~28]。其中较多研究的是miR-183及miR-96,它们同属miR-183家族。miR-183家族是高度保守的基因簇,最先被报道参与外胚层细胞和器官的功能,对脊椎动物神经系统的发育和功能至关重要[49]。Aldrich等的研究发现DRG中富含miR-96和miR-183,且在SNI模型中miR-96和miR-183明显下调[22]。2017年6月Science期刊报道[3],miR-183家族能调节NP诱导的基因网络中80%的疼痛基因。与对照组小鼠比较,SNI所致NP模型小鼠的DRG神经元中miR-183家族表达下调,敲除miR-183家族会让SNI模型小鼠对机械刺激和触摸的敏感性提高近一倍,在成年小鼠中急性下调50%的miR-183家族表达量会显著提高其对疼痛的敏感性。该实验证明了miR-183家族能控制小鼠的病理性机械痛觉。
2.脊髓
检索发现在外周神经损伤所致NP的基础研究中,最多关注的部位是脊髓。2012年Brandenburger等[50]使用微阵列芯片技术检测CCI大鼠脊髓中miRNA的表达变化,结果发现在脊髓中6个miRNAs下调,分别是miR-30b、miR-100、miR-10a、miR-99a、miR-582-3p和miR-720。随着芯片技术的逐渐成熟,近年来越来越多研究使用低密度阵列(TaqMan Low Density Array,TLDA)或微阵列芯片技术检测CCI大鼠脊髓背角中miRNA的表达变化[51,52]。其中Li等[10]不仅进行了TLDA检测,而且选取了其中表达下调的miR-203进行了定量实时聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)验证,结果证实了miR-203在脊髓背角中的下调。脊髓背角在疼痛信号上行传递过程中发挥重要作用,目前较多研究在文章中能明确检测部位为脊髓背角,但还有部分研究提到的是脊髓,原因可能与实验设计或技术成熟度有关。
3.脑
关于NP在脑水平miRNA的研究,学者们较多关注海马及边缘系统中的前扣带皮层。Arai等[53]采用低密度阵列检测CCI大鼠海马组织miRNA表达谱的变化,结果确定了20个下调的miRNAs及2个上调的miRNAs,进一步通过qRT-PCR检测miR-132、miR-125b在损伤后7d和15d的表达变化,结果发现miR-132的表达先下降后稳定,而miR-125b先下降后上升。这不仅证实了miR-132、miR-125b在CCI诱导NP过程中差异性表达,也说明miRNA的表达具有时间依懒性。Ding等[47]同样采用CCI诱导的NP模型检测前扣带皮层miRNA的表达变化,微阵列芯片技术发现9个miRNAs上调,12个下调。对其中一个下调的miR-539进行qRTPCR检验,结果发现较假手术组,CCI组在造模后7d和14d时,miR-539在双侧前扣带皮层中的表达均显著下降,其靶基因N-甲基-D-天冬氨酸型受体亚型-2B (N-methyl-D-aspartate receptor,NMDA)-subunit 2B (NR2B)则相应显著上调。该实验提示前扣带皮层的miR-539可能通过影响NR2B的表达来调节NP。
四、miRNA参与NP的可能机制
miRNA与NP的发生发展密切相关。认识miRNA在NP中的作用机制关键是明确miRNA及其靶基因的作用关系。目前神经炎症反应、突触可塑性、神经元兴奋性和DNA甲基化作用是主要研究方向。
1.神经炎症反应
早在1998年,Wagner等[54]就证实对CCI大鼠进行抗炎治疗可以缓解其热痛觉过敏,因此推测炎症反应是NP发展过程的重要组成部分。外周神经炎症反应后激活了免疫细胞(如巨噬细胞、T淋巴细胞和肥大细胞)和胶质细胞(如星形胶质细胞和小胶质细胞),这些活化的免疫细胞和胶质细胞释放炎性介质来参与疼痛信号传递,如P物质、白介素(Interleukin,IL)1、IL-6、神经营养因子和一些神经递质。高迁移率族蛋白B1 (High-mobility group box-1 protein,HMGB1)是一种对DNA修复十分重要的核蛋白,损伤后可释放到细胞质中。研究发现由神经元释放的HMGB1在中枢神经系统中作为内源性炎性介质可影响相邻的神经元和神经胶质[55]。近年来有证据显示HMGB1在NP的发展中有重要作用,NP模型大鼠的DRG神经元和卫星细胞、脊神经的施万细胞中都出现上调的HMGB1,持续的HMGB1释放能引起NP模型大鼠机械性痛觉超敏和机械性痛觉过敏现象[56,57]。为证实miR-141是通过直接调控DRG神经元中的HMGB1来影响NP神经炎症反应,Zhang等[15]研究人员首先通过双荧光素酶实验检测验证了miR-141与HMGB1的3'URT相互作用,然后使用RT-qPCR检测分别注射miR-381激动剂和抑制剂后HMGB1的表达变化,结果证实了他们的假设。随后脊髓背角中小胶质细胞的miR-381通过直接调控HMGB1表达影响脊髓炎症反应也得到研究证实[41]。信号转导和转录激活蛋白(signal transducer and activator of transcription 3,STAT3)广泛表达于神经系统,并在神经损伤后被激活,激活的STAT3参与神经炎症反应。Yan等[36]发现CCI模型大鼠中miR-93的过表达能显著减少炎症因子的表达,如IL-1β、肿瘤坏死因子和IL-6。此外,通过双荧光素酶报告发现STAT3是miR-93的靶基因,miR-93直接作用于STAT3的3' UTR,STAT3的过表达能逆转由于miR-93过表达诱导的对神经炎症反应的抑制效应。Jin等[40]推测X染色体失活特异转录因子(X-inactive specific transcript,XIST) /miR-544/ STAT3轴对NP的发展具有重要作用。经证实属于长非编码RNA的XIST与miR-544呈现负相关的关系;miR-544能缓解CCI诱导的NP发展,而XIST过表达能逆转这种影响;生物信息学预测及实验又证实了STAT3是miR-544的靶基因。作者通过以上系列研究证实了XIST/miR-544 / STAT3轴在NP中的影响,并指出NP治疗新的靶点。细胞因子信号抑制因子(Suppressor of cytokine signaling,SOCS)是炎症信号的负反馈调节者,SOCS的缺失会使机体出现高炎症反应。已有基础研究发现SOCS蛋白的过表达能阻断Janus Kinase激酶/ STAT3信号通路,进而缓解外周神经损伤后脊髓炎症反应和机械性痛觉超敏[58]。在NP的miRNA研究中发现SOCS1是miR-19a、miR-155和miR-221的共同靶基因,实验结果表明这三个miRNAs均能通过直接调控SOCS1影响神经炎症反应和NP的发展[29,30,32]。Li等[31]研究发现miR-218能直接作用于SOCS3的3' URT,体内外实验均显示miR-218抑制剂能显著促进SOCS3表达,抑制STAT3及其下游促炎症基因的激活。这提示外周神经损伤后上调的miR-218能通过抑制SOCS3激活STAT3 信号通路,进而促进神经炎症反应和NP发展。
2.突触可塑性
神经元与神经元之间的突触连接随神经元活性的变化而改变,外周传入神经元长时间或过度的超兴奋可持续改变突触的结构和功能,具体表现为突触传递的长时程增强,该现象是突触可塑性变化的主要形式之一。突触传递快速兴奋性由谷氨酸(Glutamic acid,Glu)介导,突触前膜兴奋释放Glu,与突触后膜上的Glu离子型受体结合,如α- 氨基-3-羟基-5- 甲基-4- 异恶唑丙酸(α-amino-3-hydroxy-5-methyl-4- isoxazole-propionic acid receptor,AMPA)受体、NMDA受体,介导信号传递,产生兴奋性突触后电位。GluA1和GluA2是AMPA受体的两个亚型,Toyoda 等[59]的研究发现GluA1能增强ACC中突触传递效率的长时程,激活细胞外信号调节激酶(extracellular signal-regulated kinase,ERK),其中ERK的激活被认为是中枢敏化形成的标志。此外,有研究报道[18],与正常人比较,NP病人白细胞中miR-132-3p显著增多。随后在SNI大鼠模型中进行验证,与假手术组大鼠相比,SNI模型使得大鼠脊髓背角中miR-132-3p表达显著增加,在10d时达到高峰。在SNI模型大鼠脊髓中注射miR-132-3p抑制剂,13d后发现可显著减少DRG中miR-132-3p的表达,最终改善痛觉过敏。经荧光素酶检测发现GluA1是miR-132-3p的靶基因,外源性注射miR-132-3p模拟物可减少GluA1的表达。这表明miR-132-3p可能通过下调GluA1影响突触可塑性,进而缓解NP引起的痛觉过敏。NR2B是NMDA受体的亚基,NR2B磷酸化可减弱NMDA受体活性,从而提高疼痛阈值。Ding等[47]研究发现CCI模型大鼠前扣带皮层中miR-539的表达明显减少,伴随NR2B表达显著增加。这提示miR-539可能通过调节NR2B影响NMDA受体活性,进而改变兴奋性突触后电位的释放参与NP的发生与发展。在神经元中,Ras家族蛋白质及其下游信号通路,如丝裂原激活蛋白激酶(mitogen-activated protein kinases,MAPK)等对神经元的病理生理发挥重要作用。RAS相关蛋白Rap-1a (Rap1a)是Ras家族蛋白质的成员之一,在突触可塑性的分子机制中扮演着关键的角色。Li等[10]发现CCI大鼠模型脊髓背角中miR-203表达显著下降,miR-203能直接作用于Rap1a的3' URT,提示miR-203可能通过调节靶基因Rap1a及其下游信号通路ERK激酶(MEK) / ERK来影响NP的发展。
3.神经元兴奋性
外周神经系统损伤后,伤害性刺激转化为神经冲动经由传入神经纤维到达DRG胞体,DRG神经元出现超兴奋性,进而产生异位放电,这种异位放电可能是NP产生和维持的基础之一。电压门控离子通道是神经元中动作电位产生和传导的分子基础,当细胞膜去极化时,钠离子通道开放使离子内流,引发动作电位的起始,复极化时钠离子通道开始关闭,钾离子通道缓慢开放使离子外流,两个离子通道相互协作结束一次动作电位。Nav1.3是河豚素敏感型(Tetrodotoxin-sensitive,TTX-S)的电压门控钠离子通道,在哺乳动物胚胎时期的中枢神经系统和外周神经系统中有较高表达,成年后几乎检测不到[60]。但在神经损伤后,Nav1.3在受损的DRG中明显上调[14,23,26]。Nav1.3表达的增多及其快速激活、快速从失活中恢复的生物物理特点使其成为异位放电产生和维持的主要研究对象。研究发现Nav1.3与NP的miRNA调控关系密切[14,23,26]。以往有学者证实Nav1.3是miR-96、miR-183和miR-30b共同调控的靶基因,如Chen等[14]在CCI模型大鼠的DRG中注射miR-96模拟物以上调miR-96的表达,结果抑制了Nav1.3表达的上调,进而缓解了CCI诱导的NP。这说明miR-96、miR-183和miR-30b可能通过负向调控Nav1.3的表达,进而微调伤害性刺激向中枢神经系统传递的信号。另一种TTX-S型的钠离子通道Nav1.7也被证实是miR-30b的靶基因,SNI模型大鼠DRG中miR-30b的过表达或敲低可以引起Nav1.7表达相应的降低或增多,进而影响疼痛[19]。T型钙离子通道是一种低电压门控离子通道,研究发现它是NP治疗的新靶点[61]。Favereaux等[45]的研究发现在SNL诱导的NP状态下,大鼠脊髓miR-103表达的下调能够使Cav1.2-LTC (Cav1.2-comprising L-type calcium channel)的三种亚型Cav1.2-α1,Cav1.2-α2δ1和Cav1.2-β1的表达出现上调,这三种亚型分别由Cacna1c,Cacna2d1 and Cacnb1编码而成。这证明了大鼠脊髓的Cav1.2-LTC参与了神经元超兴奋调控,miR-103在脊髓中过表达可以通过抑制Cav1.2-LTC上调缓解NP引起的疼痛。
4.DNA甲基化
DNA甲基化是基因表观遗传修饰方法,一般情况下,DNA甲基化可关闭基因活性,去甲基化则可诱导基因的重新活化或表达。王英等[62]研究发现CCI大鼠脊髓中的DNA甲基化水平明显上调,并伴随DNA甲基转移酶(DNA methyltransferase,DNMT1、DNMT3a、DNMT3b和甲基化CPG结合蛋白2 (methyl CpG binding protein 2,MeCP2)的上升。其中DNMT家族是催化DNA甲基化的重要酶类,而MeCP2是MeCP家族成员之一,可通过特异性结合甲基化CpG位点的蛋白抑制基因表达[63]。研究发现miRNA与DNA甲基化密切相关,DNA甲基化可影响miRNA成熟过程,miRNA也可通过调控DNMT的表达来调节表观遗传。因此,DNA甲基化机制很有可能参与miRNA调控NP的过程中。Manners等[20]研究发现神经损伤后小鼠DRG中的MeCP2表达显著上升,MeCP2表达的上调可抑制miR-126的表达,下调的miR-126又能使DNMT1和血管内皮生长因子A表达增多。这表明MeCP2能通过抑制miR-126激活DNMT1和Vegfa的表达,该研究也使我们更好地理解NP中表观遗传调控诱导分子水平变化的分子基础。Xu等[27]在SNL诱导的NP模型中证实miR-143是DNMT3a的负向调节器,且通过在DRG内注射DNMT3a抑制剂发现阿片类受体MOR和KOR的表达增加,这进一步表明外周神经损伤后DNMT3a的增多会抑制MOR和KOR的表达,进而加速NP发展。
五、小结
本文对miRNA及其靶基因在CCI、SNI及SNL这三种NP模型中的表达、调控关系及可能作用机制进行了阐述,明确了miRNA在外周神经损伤所致NP发生发展过程中起着极为重要的作用。但是目前miRNA在NP发生发展不同阶段的参与情况尚不清楚,今后在基础研究中还需进一步探索。miRNA及其靶基因有望作为预防和治疗外周神经损伤所致NP的潜在生物标记和治疗新策略。目前已知基础实验的机制探索选取了背根神经节、脊髓和脑等重要神经组织,但在NP生物标记物的临床研究中,标本较多集中在病人的外周血液、腓肠神经和皮肤等。如Leinders等[64]已发现在慢性NP病人外周血液白细胞及活检的腓肠神经中miR-132-3p表达均显著高于健康人。体液中的miRNA表达稳定,可能是一种理想的非侵入性的NP生物标记物。目前已有不少疾病使用血液中的miRNA作为生物标记物,如2型糖尿病肾病、肿瘤[65,66]。近年来有关miRNA与NP的临床研究逐渐增多,希望未来能将这些发现应用于NP的临床诊疗工作中。
