雷帕霉素改善Aβ31-35所致小鼠昼夜节律紊乱*
2019-04-22王昌图任亚楠王晓晖
王昌图, 张 蕊, 原 媛, 赵 今, 任亚楠, 王 丽△, 王晓晖△
(山西医科大学基础医学院 1病理教研室, 2形态学实验室, 太原 山西 030001)
阿尔茨海默病(Alzheimer disease,AD)是一种常见的与老化密切相关的神经退行性疾病[1]。近年来,AD发病率逐渐升高,给社会和家庭带来沉重的经济和心理负担。据研究报道,80%的65岁以上AD患者在发病早期阶段就已出现昼夜节律紊乱,而昼夜节律紊乱又加重AD的其它临床表现,如学习记忆功能障碍和认知缺陷等[2-3]。大量研究表明作为AD主要的病理变化之一,神经元间隙沉积的β-淀粉样蛋白(amyloid β-protein,Aβ)是导致AD患者出现昼夜节律紊乱的重要因素[4]。本课题组前期研究同样发现,C57BL/6小鼠海马内注射Aβ31-35后,其跑轮行为出现明显的昼夜节律紊乱,同时Per2的mRNA和蛋白表达明显异常[5]。然而目前针对AD患者早期出现的昼夜节律紊乱,尚缺乏有效治疗手段。
雷帕霉素(rapamycin,Rapa)是一种大环内酯内抗生素,早期主要作为肾移植免疫抑制药物应用于临床。近年研究发现,Rapa除了免疫抑制作用外,在抗衰老和脑保护方面的作用更为显著[6]。已有研究显示,Rapa可以用于治疗AD,减轻AD小鼠的认知功能损害,抑制Aβ的产生和聚集,降低tau蛋白的过度磷酸化,从而延缓AD的病理过程[7]。然而,Rapa是否能改善Aβ诱导的小鼠昼夜节律紊乱目前尚未见报道。因此,本研究拟探讨Rapa对Aβ31-35诱导的小鼠昼夜节律紊乱的作用,为临床治疗AD患者昼夜节律紊乱提供新的治疗措施。
材 料 和 方 法
1 动物
清洁级雄性C57BL/6小鼠6~8周龄,体重18~22 g;由山西医科大学动物中心提供,许可证号为SCXK(晋)2015-001;随机分为溶剂对照(control)组、Aβ31-35(Aβ)组、Rapa预处理(Rapa+Aβ)组和Rapa组,每组各9只。将小鼠置于室温20~24 ℃、湿度35%~55%、自由饮食的较恒定环境中。
2 主要试剂和仪器
Rapa(碧云天,SBJ-I1028);Aβ31-35(Abcam,ab120974);胎牛血清(Sciencell,0500);DMEM高糖培养基(Thermo SH,30022.01B);Cell Counting Kit-8试剂盒(Dojindo,CK04);RNAiso Plus(DRR036A)、Prime Script RT Master Mix(DRR036A)和SYBR Premix Ex TaqTMⅡ(DRR820A)均购自TaKaRa;SDS-PAGE凝胶制备试剂盒(索莱宝,P1200);抗Per2抗体(Santa Cruz,sc-25363);小鼠抗β-actin单克隆抗体(TA-09)、辣根过氧化酶标记山羊抗小鼠IgG(ZB-2305)和辣根过氧化酶标记山羊抗兔IgG(ZB-2301)均购自中杉金桥。VitalView实时数据监测仪和ActiView生物节律分析系统(Mini-Mitter);HERAcell 150i CO2恒温细胞培养箱(Thermo);IX51显微镜(Olympus);SMP500-071 47-HLXU酶联免疫检测仪(SoftMax),LR56495低温高速离心机(Thermo Fisher);MX3005P PCR扩增仪(Stratagene);MX3005P热循环仪(MJ Research); BioSpectrum 810凝胶成像系统(UVP)。
3 主要方法
3.1海马内给药 高压灭菌三蒸水将Aβ31-35溶解稀释至1 g/L,37 ℃恒温水浴锅中孵育36 h,使其充分老化。二甲基亚砜(DMSO)将Rapa充分溶解后再用PBS稀释至 2.5 g/L。10%水合氯醛腹腔注射对C57BL/6小鼠进行麻醉,剪去小鼠头顶毛发,将小鼠头部固定在三维脑立体定位仪上,剪开头皮暴露颅骨,以前囟为基点,向后移动2 mm,然后分别向左和右移动1.8 mm,做好标记,对应标记处缓慢进针1.8 mm即为小鼠海马CA1区的解剖位点,缓慢注射药物,速度约为0.2 μL/min。Control组给予等量的高压三蒸水; Aβ组给予 Aβ31-35(每只15 nmol,单侧海马每只注射4.1 μL,双侧海马共注射8.2 μL,给药时间约每只41 min); Rapa组给予 Rapa(每只20 nmol,单侧海马每只注射3.7 μL,双侧海马共注射7.4 μL,给药时间约每只37 min); Rapa+Aβ组先给予20 nmol Rapa处理,15 min之后给予15 nmol Aβ31-35。给药完毕后缓慢退针,缝合伤口,给予抗生素预防感染。
3.2跑轮行为学实验 为评估各组小鼠跑轮节律状态,将各组小鼠置于明暗(light-dark,LD)环境2周,之后改为持续黑暗(constant darkness/dark-dark,DD)环境2 周。采用VitalView生物节律检测系统对小鼠跑轮活动进行实时监测,系统每隔5 min记录一次跑轮数据,跑轮实验结束后,利用ActiView生物节律分析系统对跑轮运动原始图及小鼠自由运转周期进行分析。
3.3细胞培养及处理 小鼠海马神经元细胞系HT22购自广州吉尼欧生物科技有限公司,配置含有10% 胎牛血清和1%的双抗的DMEM高糖培养基,用于HT22细胞培养。将培养瓶置于含5% CO2、 37 ℃恒温及饱和湿度的CO2恒温细胞培养箱中,待细胞融合度达到80%~90%后开始进行处理,先用含有1%胎牛血清的培养基对各组细胞进行1 h的饥饿处理,使各组细胞内部节律达到同步化,此时记为circadian time 0 (CT0),换液为完全培养基继续培养并进行相应处理:对照组继续用完全培养基培养;Aβ组加入5 μmol/L的Aβ31-35;Rapa+Aβ组先加入100 μmol/L Rapa作用1 h后加入5 μmol/L的Aβ31-35; Rapa组加入100 μmol/L的Rapa。

3.5Real-time PCR实验 采用real-time PCR实验检测Per2的mRNA表达水平。在各个时点收集处理后的HT22细胞,提取RNA,反转录成cDNA,选用SYBR Green试剂盒加入相应引物进行扩增。Per2(GenBank ID: NM_011066.3)的上游引物序列为5’-TGGTCTGGACTGCACATCTGG-3’,下游引物序列为5’-AGGTCACTTGACGTGGAGATGG-3’;GAPDH(GenBank ID: NM_008084.2)的上游引物序列为5’-AAATGGTGAAGGTCGGTGTGAAC-3’,下游引物序列为5’-CAACAATCTCCACTTTGCCACTG-3’。扩增完毕后用所得的结果与CT4时点的GAPDH的表达标化,采用2-ΔΔCt法进行相对定量。
3.6Western blot实验对Per2蛋白的表达量进行定量分析 在Per2 mRNA表达差异最大的时点CT16收集处理后的HT22细胞,加入RIPA裂解液,冰上裂解1.5 h,4 ℃、12 000 r/min离心10 min后提取上清,BCA法测蛋白浓度并进行蛋白定量,金属浴100 ℃加热10 min使蛋白变性,配制SDS-PAGE凝胶进行电泳,将蛋白转膜至PVDF膜上,5%脱脂奶粉室温封闭2 h,加入抗Per2抗体4 ℃过夜,TBST洗膜3次后加入相应 II 抗室温孵育2 h,TBST洗膜3次,每次10 min。使用凝胶成像系统进行曝光并采集图像。利用ImageJ软件对图像灰度值进行分析,计算各组Per2蛋白的相对表达量。
4 统计学处理
采用SPSS 16.0软件对数据进行统计分析。实验数据以均数±标准误(mean±SEM)表示。多组间比较采用单因素方差分析,组间两两比较采用SNK-q法。以P<0.05为差异有统计学意义。
结 果
1 Rapa明显缓解Aβ31-35所致C57BL/6小鼠跑轮昼夜节律紊乱
选择6~8周龄雄性C57BL/6小鼠进行跑轮行为学实验,在全黑暗(DD)环境中,对照组C57BL/6小鼠存在较为规律的跑轮活动,即运动相-休息相分界清晰,活动相主要集中在主观黑夜,休息相主要集中在主观白天,小鼠的自由运转周期为(23.55±0.05) h;而海马内注射Aβ31-35后,小鼠跑轮行为的昼夜节律出现明显紊乱,跑轮活动起始时间的变异性增大,运动相-休息相分界不清,并且小鼠自由运转周期延长,为(23.75±0.03) h (P<0.05);给予Rapa预处理后,小鼠的跑轮昼夜节律在一定程度上得到改善,表现为运动相-休息相分界较为清楚,自由运转周期明显恢复,为(23.52±0.07) h (P<0.05);此外,Rapa单独处理组小鼠自由运转周期为(23.49±0.06) h,运动相-休息相分界明显,且活动主要集中在小鼠主观夜间,与对照组小鼠均无统计学差异,见图1。
2 Rapa改善Aβ31-35诱导的HT22细胞活力降低
分别用浓度为0、2.5、5和10 μmol/L的Aβ31-35处理HT22细胞,24 h后行CCK-8实验,结果显示Aβ31-35对HT22细胞具有一定的细胞毒性作用,表现为与对照组相比,在Aβ31-35浓度为5和10 μmol/L时,HT22细胞活力明显降低(P<0.05),见图2A。本研究选择5 μmol/L 作为Aβ31-35的给药浓度,进一步采用Rapa预处理,结果表明100 μmol/L Rapa预处理1 h后HT22细胞的相对活力为(98.76±3.60)%,与Aβ31-35处理组相比有显著提高(P<0.05),而Rapa单独处理组细胞相对活力为(98.28±3.30)%,与对照组比较差异无统计学显著性,见图2B。以上结果表明Rapa能显著提高Aβ31-35引起的HT22细胞活力下降,具有神经保护作用。
3 Rapa有效逆转Aβ31-35所致HT22细胞Per2的mRNA和蛋白表达异常
采用real-time PCR检测小鼠海马神经元HT22细胞Per2的mRNA表达水平,结果发现对照组细胞的Per2 mRNA表达水平呈现一定的节律性,表现为CT8、CT16和CT24处表达水平相对较高,而在CT4、CT12和CT20处表达水平相对较低,且在CT16处表达水平最高;而经5 μmol/L Aβ31-35处理后,我们发现Per2的mRNA表达水平与对照组相比出现明显异常,具体表现为在CT16、CT20和CT24处Per2的mRNA表达水平较对照组降低(P<0.05),且在CT16处降低幅度最大,提示Aβ31-35能诱导HT22细胞Per2的mRNA表达水平出现明显异常;给予Rapa预处理1 h,HT22细胞Per2的表达节律在一定程度上得到了改善,与Aβ31-35单独组相比,HT22细胞Per2的mRNA表达水平在CT16、CT20和CT24处均显著提高;Rapa单独处理组Per2的表达水平与对照组比较差异无统计学显著性,见图3A。
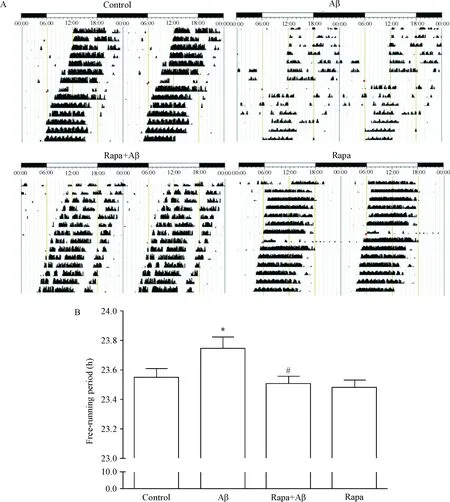
Figure 1.Rapa attenuated the circadian rhythm disorder induced by Aβ31-35 in C57BL/6 mice. A: representative actograms displayed running wheel activity of the individual mouse from 4 groups under constant DD conditions after 1 week of LD environment; B: free-running period of individual mouse from 4 groups. Mean±SEM.n=9.*P<0.05vscontrol group;#P<0.05vsAβ31-35 group.
图1雷帕霉素改善Aβ31-35所致小鼠跑轮节律紊乱

Figure 2.The viability of the HT22 cells was decreased by the treatment of Aβ31-35, and Rapa reduced the toxicity of Aβ31-35. A: Aβ31-35 decreased the viability of the HT22 cells; B: Aβ31-35 (5 μmol/L) reduced the cell viability and pretreatment with Rapa increased the viability of HT22 cells after 24 h. Mean±SEM.n=12.△P<0.05vs0 μmol/L;*P<0.05vscontrol group;#P<0.05vsAβ group.
图2Rapa改善Aβ31-35诱导的HT22细胞活力降低
为了进一步验证这一结果,我们选取mRNA表达差异最大的CT16时点(图3B)对各组细胞的Per2蛋白表达进行检测,结果显示经 Aβ31-35处理后Per2蛋白的相对表达量与对照组相比显著降低(P<0.05);而经Rapa预处理1 h后Per2蛋白的相对表达量为较Aβ31-35处理后显著升高(P<0.05);Rapa单独处理后Per2蛋白的相对表达量与对照组比较差异无统计学显著性,见图3C。以上结果均表明Rapa能有效改善Aβ31-35诱导的小鼠海马神经元HT22细胞Per2的mRNA和蛋白表达异常。

Figure 3.Rapa improved the abnormal expression of Per2 induced by Aβ31-35 in HT22 cells. A: the amount of Per2 mRNA at diffe-rent CT was quantified by real-time PCR; B: there were significant differences of mRNA expression levels between subgroups at CT16 (n=12); C: the results of Western blot for determining the protein levels of Per2 at CT16 in the HT22 cells (n=6). Mean±SEM.*P<0.05vscontrol group;#P<0.05vsAβ group.
图3Rapa有效逆转Aβ31-35所致HT22细胞Per2表达异常
讨 论
本研究发现,海马内单独注射Aβ31-35后可导致C57BL/6雄性小鼠跑轮昼夜节律出现明显紊乱,而给予Rapa联合注射明显缓解了Aβ31-35所致C57BL/6雄性小鼠昼夜节律紊乱。进一步采用HT22神经元细胞研究发现,Rapa可以明显缓解Aβ31-35诱导的Per2异常表达。这提示Rapa可以有效改善Aβ31-35诱导的昼夜节律紊乱。
AD是一种渐进性的神经退行性疾病[1],以老年斑、神经纤维缠结和海马区神经元丢失为主要病理特征[8]。研究证实,作为老年斑主要成分的Aβ在脑内沉积可触发级联病理反应加重神经元纤维缠绕和神经元丢失,进而加速AD病情进展[9]。Aβ在脑内的异常形成并堆积而产生的神经毒性作用已被公认是AD形成和发展的关键因素[10]。有报道显示,Aβ的核心片段之一Aβ31-35可对大鼠原代皮层神经元产生明显的毒性作用[11]。本研究采用CCK-8细胞毒性实验发现5 μmol/L的Aβ31-35可导致小鼠海马神经元HT22细胞的存活率明显降低。
近年来越来越多的证据表明,大部分AD患者早期即出现昼夜节律紊乱,而昼夜节律紊乱又可加重AD的其它症状如学习记忆功能障碍和认知功能缺陷等,从而加速AD病情进展[12-13]。此外,相关文献报道称,AD患者的昼夜节律紊乱与脑内Aβ异常沉积密切相关,这一观点在AD模型鼠上亦得到证实,APP/PS1双转基因鼠脑内存在大量的Aβ沉积,表现出睡眠-觉醒周期紊乱[10]。本课题组通过跑轮行为学实验也表明C57BL/6小鼠跑轮节律可被Aβ的核心毒性片段Aβ31-35明显扰乱[5]。在本研究中,小鼠跑轮行为学实验的结果也证实Aβ31-35可诱导6~8周龄雄性C57BL/6小鼠出现昼夜节律紊乱,自由运转周期延长。
昼夜节律俗称生物钟,是指在生物体内存在的以近似24 h为周期的生物节律,其主要目的是使机体内部各器官相互协调以更好地适应外界环境变化。昼夜节律的维持依赖于由一系列的节律基因/蛋白构成的正负转录翻译反馈环路(transcription translation feedback loop,TTFL),即由Bmal1和Clock组成的正反馈环路和由Per和Cry组成的负反馈环路[14-15],其中Per2作为昼夜系统的重要组成部分,在多种伴有昼夜节律紊乱的疾病中均受到破坏[16]。相关研究表明,per2-/-小鼠的跑轮行为可出现明显的节律紊乱[17]。而per2基因突变的人群,会出现家族性睡眠时相提前综合征[18]。本研究发现,小鼠海马神经元HT22细胞经5 μmol/L Aβ31-35处理后per2基因的表达水平同对照组相比在CT16、CT20和CT24均降低,其中以CT16降低最为显著,提示Aβ31-35可使per2基因表达发生异常。在per2基因表达差异最大的时点CT16检测Per2蛋白表达水平,我们也得到了类似的结果。由此可见,Aβ31-35可以诱导C57BL/6小鼠出现昼夜节律紊乱,导致HT22神经细胞Per2基因/蛋白出现明显异常。然而,针对Aβ31-35诱导的昼夜节律紊乱,目前仍缺乏有效的治疗手段。
Rapa是一种大环内酯内抗生素,主要通过与哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)结合发挥一系列生物学效应。mTOR是一种丝-苏氨酸蛋白激酶,在多条信号传导途径中发挥至关重要的作用。目前诸多文献报道称,Rapa可通过mTOR信号通路,抑制免疫、抗氧化应激反应及减少一氧化氮量来减轻局部损伤反应,同时增加细胞自噬能力,清除异常堆积的物质,发挥其神经保护作用[19]。已有大量证据表明,在AD模型小鼠中,Rapa可以通过抑制mTOR,提高自噬水平及Aβ载体α7型烟碱样乙酰胆碱受体(α7nAChR)的表达量以清除细胞胞外沉积的Aβ和异常磷酸化的tau蛋白,起到神经保护和改善认知功能缺陷的作用[20-21];除此之外,Cao等[22]发现,在光照条件下,在不同时点给予小鼠侧脑室注射Rapa可影响小鼠视交叉上核(suprachiasmatic nucleus,SCN)中Per2蛋白表达水平。然而Rapa是否能拮抗Aβ所致昼夜节律紊乱,目前尚未见研究报道。在本次研究中,我们应用小鼠跑轮行为学实验,发现与Aβ31-35单独组相比,Rapa+Aβ31-35联合处理组小鼠的昼夜自发运动较为规律,运动相/休息相分界清晰,自由运转周期降低,证实了Rapa对Aβ31-35诱导的C57BL/6小鼠昼夜节律紊乱具有改善作用;进一步采用HT22神经元细胞进行研究,结果显示Rapa可逆转Aβ31-35所致HT22细胞Per2的异常节律性表达。以上结果表明,Rapa可能通过调节Aβ31-35诱导的Per2异常节律性表达,从而改善昼夜节律紊乱。然而,本研究证实的Rapa拮抗 Aβ 神经毒性作用是否也与保护自噬溶酶体功能有关,仍需进一步证实。
综上所述,本研究首次明确雷帕霉素可以改善Aβ31-35导致的C57BL/6小鼠跑轮昼夜节律紊乱,并在细胞水平进一步证实,雷帕霉素可以改善Aβ31-35导致的HT22细胞中Per2表达水平异常。这在一定程度上为AD患者昼夜节律紊乱的防治提供了新思路。
