miR-218-5p下调SD大鼠成骨细胞骨硬化蛋白的表达*
2019-04-22方钦正菅永志王维山史晨辉
方钦正, 徐 芳, 叶 林, 菅永志, 王维山, 史晨辉△
(1石河子大学医学院第一附属医院骨科中心, 2石河子市人民医院眼科, 新疆 石河子 832000)
骨硬化蛋白(sclerostin,SOST)是由SOST基因编码的分泌型糖蛋白,通过与细胞表面的低密度脂蛋白相关蛋白复合受体(LRP4/5/6)结合抑制 Wnt 信号通路,进而抑制骨形成[1]。目前,虽然有研究认为骨硬化蛋白的分泌与甲状旁腺激素(parathyroid hormone,PTH)和机械刺激等相关[1-2],然而调控SOST基因表达的机制仍然不清楚。微小RNA(microRNA,miRNA,miR)是一种内源性、非编码的单链小分子RNA,在物种间具有高度保守性,大小约为22个核苷酸,在转录后水平负调控基因表达[3]。文献报道miR-218-5p通过调控Wnt 信号通路影响乳腺癌细胞的骨转移[4]。本研究通过生物信息学方法预测并用实验验证miR-218-5p与SOST的靶向关系,进一步检测miR-218-5p对SD大鼠成骨细胞骨硬化蛋白表达的调控作用。
材 料 和 方 法
1 主要试剂与仪器
293T细胞株(广州莱德尔生物科技有限公司);限制性内切酶、SYBR Green qPCR SuperMix和Lilpofectamine 2000 (Invitrogen);质粒提取试剂盒(广东更顺科技股份有限公司);Phusion DNA聚合酶(Promega);DNA凝胶纯化试剂盒和DNA产物纯化试剂盒(东盛生物科技有限公司);序列测定(上海生工生物公司);miRNA mimc(广州莱德尔生物科技有限公司);BCA法蛋白含量检测试剂盒(南京凯基生物发展有限公司)。ABI 7500荧光PCR仪(ABI);核酸蛋白测定仪(Eppendorf);Dual-Luciferase Assay System和GloMax生物发光检测仪(Promega)。
2 细胞培养及鉴定
293T细胞株购自广州莱德尔生物科技有限公司,于OPTI-MEM培养基5% CO2、37 ℃培养箱中培养。成骨细胞取于 4周龄SD大鼠胫骨平台软骨下骨组织,诱导分离并纯化,茜素红染色鉴定,培养在含10%胎牛血清的DMEM培养基中(培养条件为5% CO2、饱和湿度、37 ℃)。
3 方法
3.1生物信息学预测 采用RNAhybrid和TargetScan数据库预测miR-218-5p靶向SOST基因的作用位点。
3.2细胞总RNA提取及real-time PCR 带XhoI酶切位点的上游引物序列为5’-GATCGCTCGAGAGGAGTGGGAGCTTGAGTCC-3’,带Not I酶切位点的下游引物序列为5’-GCGGCCAGCGGCCGCTCTCCTG CCGGAGTTTCATTG-3’ 。依据 TRIzol 试剂说明书的操作步骤提取目的细胞的总 RNA,按照microRNA 逆转录试剂盒说明书操作进行细胞 cDNA的合成,按照荧光定量 PCR 试剂盒说明书进行 PCR扩增反应。 应用 2-ΔΔCt法进行相对定量分析。
3.3miRNA 寡核苷酸序列的合成 rno-miR-218-5p的 成 熟 体 序 列 (mimic) 、 rno-miR-218-5p抑制物(inhibitor),以及相应的阴性对照(mimic NC和inhibitor NC)均由苏州金唯智生物科技有限公司设计合成。
3.4载体构建 SOST 3’-UTR psiCHECK-2载体:根据PubMed GenBank NC_005109.4确定SOST基因3’-UTR,设计并合成引物(苏州金唯智生物科技有限公司完成),经双酶切、纯化,与psiCHECK-2载体进行酶连接。Mut-SOST 3’-UTR psiCHECK-2载体:突变生物信息学预测miR-218-5p靶向SOST 3’-UTR的作用位点,同上方法构建。送上海生工生物公司测序鉴定载体构建的正确性。
3.5双萤光素酶基因报告活性检测 293T细胞铺板,24 h后用Lipofectamine2000进行转染实验。rno-miR-218-5p mimic、 rno-miR-218-5p inhibitor、rno-miR-218-5p mimic NC和rno-miR-218-5p inhibitor NC的浓度是20 nmol/L,重组双萤光素酶报告基因质粒0.5 μg,共转染293T细胞,转染48 h后处理细胞,用Promega的Dual-Luciferase Reporter Assay System (E1910)进行样品Luciferase活性检测。
3.6核转染 采用阳离子脂质体法分别将rno-miR-218-5p mimic、 rno-miR-218-5p inhibitor、rno-miR-218-5p NC和rno-miR-218-5p inhibitor NC转染入SD大鼠成骨细胞,转染24 h后收集细胞并开始后续实验。
3.7RT-PCR检测SOST mRNA表达水平 用TRIzol试剂从SD大鼠成骨细胞中提取总RNA,取相同质量总RNA 1 μL,用M-MLV逆转录酶反转录为cDNA。以5.0 μL cDNA(1∶20稀释)为模板,在20 μL体系中进行扩增反应。SOST 的上游引物序列为5’-TGCCAAGCCGGTCACCGAGTT-3’,下游引物序列为5’-ACGCGCCCGATGGCGTTGGGC-3’; GAPDH的上游引物序列为5’-TGGCCGTGGGGCTGCCCAG-3’,下游引物序列为5’-GGAAGGCCATGCCAGTGAGC-3’。PCR条件为: 50 ℃ 2 min;95 ℃ 2 min、95 ℃ 15 s、60 ℃ 32 s,40个循环。扩增产物1.2%琼脂凝胶电泳,用凝胶成像系统拍照分析。
3.8Western blot 法检测SD大鼠成骨细胞SOST的蛋白表达 细胞去除培养基,加入适量的蛋白裂解液,提取蛋白, BCA 法进行蛋白定量。 10% SDS-PAGE,80 V恒压电泳至溴酚蓝至分离胶后,120 V恒压电泳至溴酚蓝刚出胶底部止,PVDF膜蛋白质转移,加入抗 SOST的I 抗,4 ℃ 孵育过夜,加入II抗,37 ℃孵育1 h,化学发光法检测分析结果。
4 统计学处理
采用SPSS 19.0软件进行分析,数据以均数±标准差(mean±SD)表示,组间差异采用单因素方差分析和SNK-q检验。以P<0.05为差异有统计学意义。
结 果
1 生物信息学预测miR-218-5p 靶向SOST
生物信息学软件RNAhybrid和TargetScan预测miR-218-5p靶向SOST基因, SOST 3’-UTR的第1 360~1 366个碱基(AAGCACA)与miR-218-5p的第14~20个碱基(UUCGUGUU)互补结合位点,此位点序列在物种间高度保守,见图1。

Figure 1. The putative miR-218-5p binding site in 3’-UTR of SOST.
图1SOST3’-UTR存在miR-218-5p的结合位点
2 miR-218-5p对SOST 3’-UTR的调控
成功构建SOST 3’-UTR psiCHECK-2和Mut-SOST 3’-UTR psiCHECK-2载体,送上海生工生物公司测序进行BLAST 分析证明序列正确。将rno-miR-218-5p mimic、 rno-miR-218-5p inhibitor、rno-miR-218-5p NC和rno-miR-218-5p inhibitor NC与SOST 3’-UTR psiCHECK-2/Mut-SOST 3’-UTR psiCHECK-2分别共转染于293T细胞,结果显示rno-miR-218-5p mimic/SOST 3’-UTR psiCHECK-2共转染细胞的萤光素酶活性显著下调,rno-miR-218-5p inhibitor/ SOST 3’-UTR psiCHECK-2共转染细胞的萤光素酶活性明显上调,而转染Mut-SOST 3’-UTR psi-CHECK-2细胞的萤光素酶活性均未见变化,验证miR-218-5p能特异性作用于SOST的3’UTR,见图2。
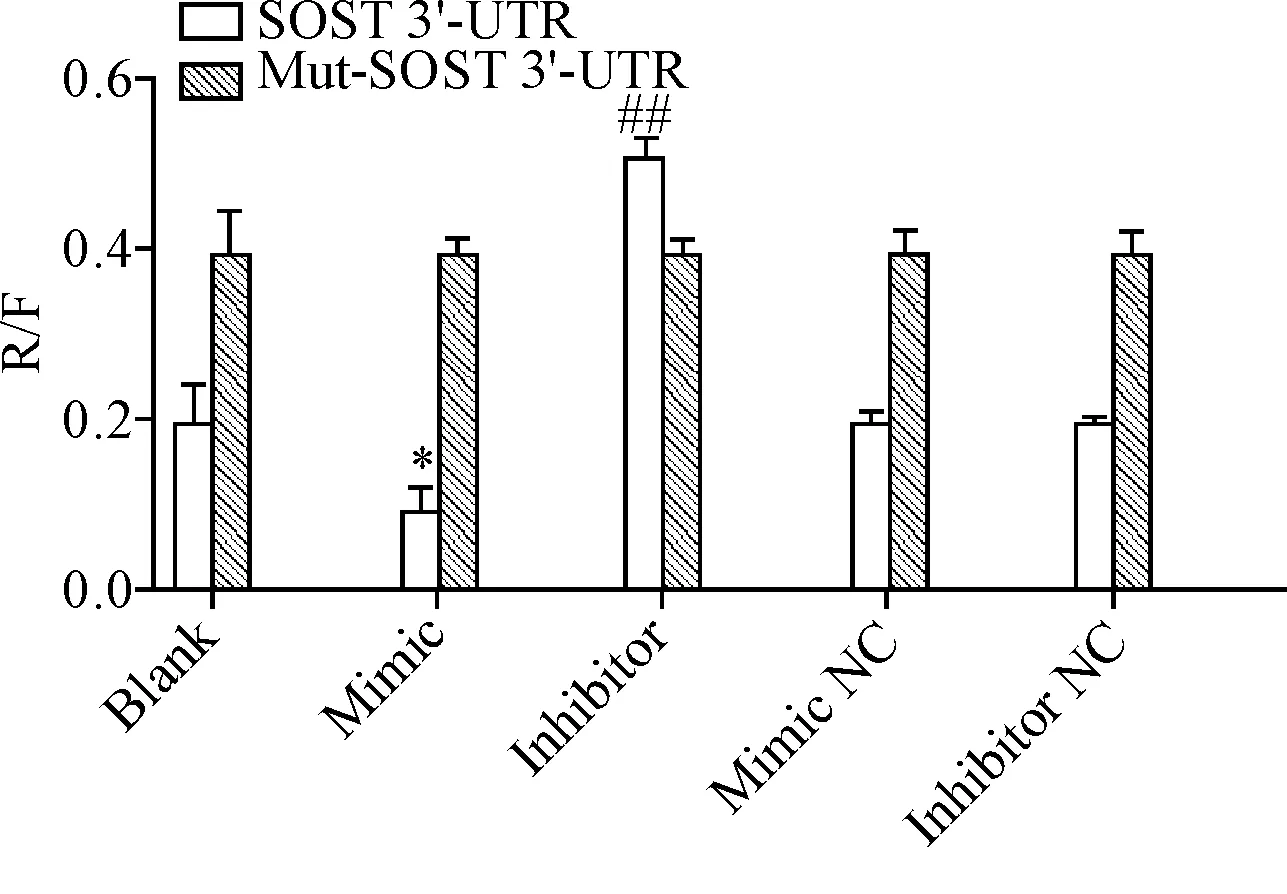
Figure 2.The regulatory effect of miR-218-5p on SOST 3’-UTR detected by dual-luciferase reporter assay. The 293T cells were co-transfected with rno-miR-218-5p mimic, mimic NC, rno-miR-218-5p inhibitor or inhibitor NC, and SOST 3’-UTR psiCHECK-2 or Mut-SOST 3’-UTR psiCHECK-2. R/F: the ratio of the activity ofRenillaluciferase to firefly luciferase. Mean±SD.n=3.*P<0.05vsblank group;##P<0.01vsmimic group.
图2miR-218-5p对SOST3’-UTR的调控
3 miR-218-5p对SD大鼠成骨细胞SOST表达的影响
为了研究miR-218-5p对SD大鼠成骨细胞SOST表达的影响,我们设立了rno-miR-218-5p mimic组、 rno-miR-218-5p inhibitor组及阴性和空白对照,以GAPDH为内参照,检测了SOST在mRNA和蛋白水平的表达差异。结果显示转染rno-miR-218-5p可明显抑制SOST的mRNA和蛋白表达,转染rno-miR-218-5p inhibitor可明显增强SOST的mRNA和蛋白表达(P<0.05),见图3。
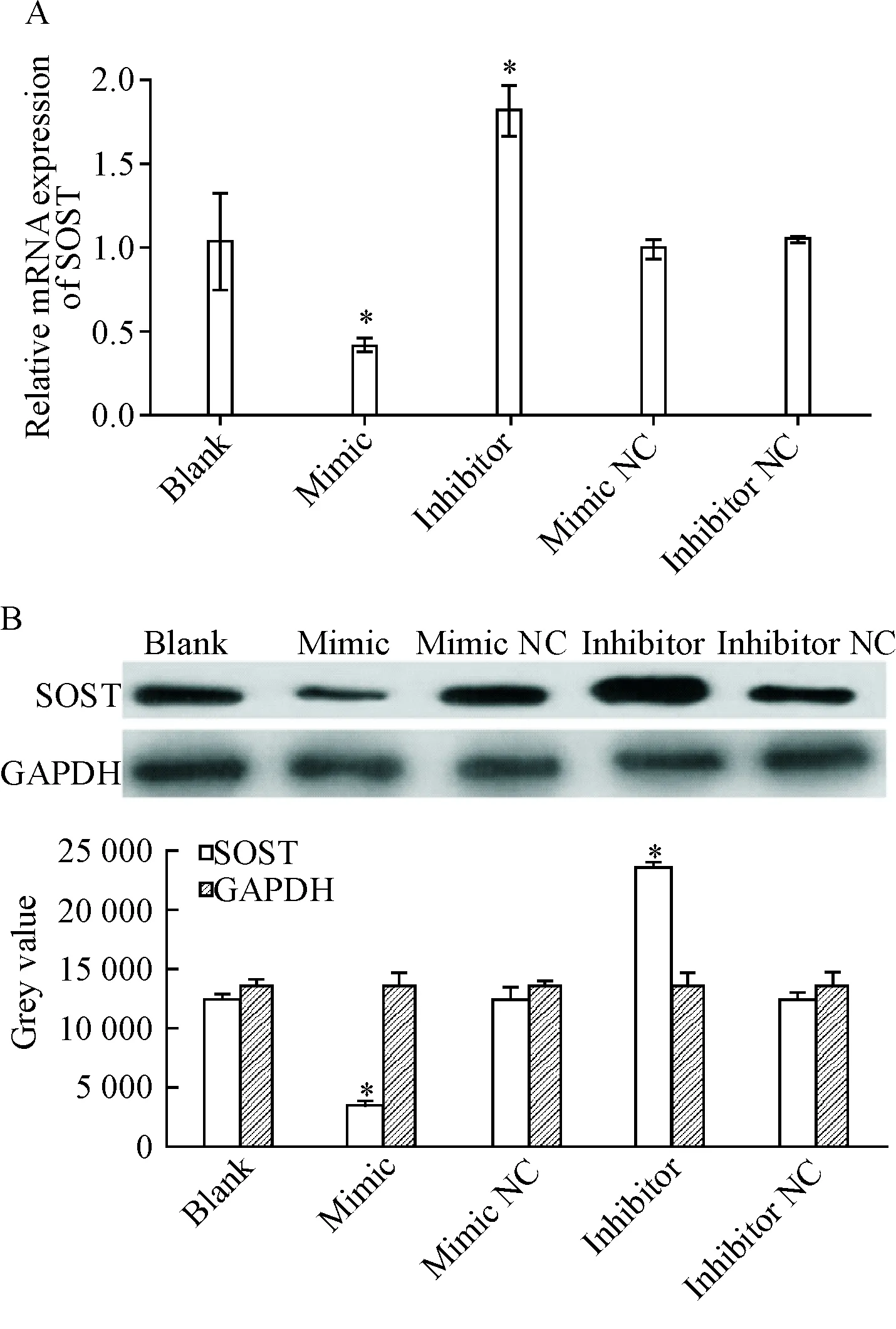
Figure 3.The exogenous miR-218-5p significantly decreased the mRNA (A)and protein (B) expression of SOST. Mean±SD.n=3.*P<0.05vsblank group.
图3miR-218-5p对SD大鼠成骨细胞SOST表达的影响
讨 论
骨硬化蛋白作为经典Wnt信号通路的抑制剂成为近年来骨病研究中的热点之一[5],文献报道骨硬化蛋白在骨质疏松、恶性肿瘤骨转移中起关键作用[5-6],近期也有文献报道骨硬化蛋白可以延缓软骨降解、抑制软骨下骨硬化进而影响骨关节炎的形成和发展[7-9]。本课题组前期研究也表明骨关节炎软骨下骨较正常软骨下骨中骨硬化蛋白表达明显减少。文献报道机械刺激、PTH和sirtuin 1可能是调控骨硬化蛋白表达的因素[1-2, 10],但具体机制尚不明确。miRNA属于小RNA的一种,主要通过直接调控其下游特异性靶基因的表达发挥生物学功能,已有文献报道miRNA可能参与了骨硬化蛋白的调控表达[4, 6]。本研究前期通过靶基因在线预测数据库(TargetScan、miRanda和miRDB)发现,miR-218-5p潜在靶向SOST基因,使用RNAhybrid和TargetScan进行生物信息学分析,SOST 3’-UTR的第1 360~1 366个碱基(AAGCACA)与miR-218-5p的第14~20个碱基(UUCGUGUU)互补,此位点序列在物种间高度保守。由此预测miR-218-5p可能参与了骨硬化蛋白表达的调控。本研究通过构建SOST基因3’-UTR野生型及突变型萤光素酶报告载体,与miR-218-5p质粒共转染293T细胞,检测发现miR-218-5p质粒和SOST 3’-UTR野生型共转染可使细胞萤光素酶活性明显下降,而与SOST 3’-UTR突变型转染对细胞萤光素酶活性没有影响。这说明miR-218-5p可通过与SOST 3’-UTR的互补位点相互作用,调节靶蛋白的表达。
骨硬化蛋白主要由骨细胞和成骨细胞分泌,为了探讨miR-218-5p在成骨细胞中调节骨硬化蛋白表达的作用,我们培养了SD大鼠成骨细胞并通过茜素红染色鉴定,设立了miR-218-5p模拟物、抑制剂和阴性及空白对照,转染SD大鼠细胞后在mRNA和蛋白层面观察蛋白的表达情况,结果显示转染miR-218-5p模拟物可明显下调成骨细胞SOST的mRNA和蛋白表达,而转染miR-218-5p抑制剂可明显上调SOST的mRNA和蛋白表达。
综上所述,本研究表明miR-218-5p可以通过靶向SOST基因,调控SOST蛋白的表达,进而可能会影响骨代谢。此结果为本课题组后期进一步通过动物实验验证miR-218-5p通过调节软骨下骨骨重塑进而延缓骨关炎提供了基础依据,也为骨性关节炎的治疗提供了可能新靶点。
