Cx43在造血调控及重建中的作用*
2019-04-22张阳敏罗筱衍徐燕霞周东明张立莹傅晋翔
张阳敏, 罗筱衍, 徐燕霞, 周东明, 张立莹, 傅晋翔
(苏州大学附二院血液科, 江苏 苏州215004)
间隙连接(gap junction,GJ)是普遍存在的包含细胞内通道的特殊胞膜区域,是细胞间连接方式的一种,由间隙连接蛋白(connexin,Cx)所构成[1]。相邻细胞间通过间隙连接所介导的细胞间隙连接(gap junction intercellular communication,GJIC)进行信息和能量物质交换,参与细胞间物质交换的代谢偶联和电信号传递的电偶联,对细胞的新陈代谢、内环境稳定、增殖和分化等生理过程起着重要的调控作用[2]。完整GJ是由相邻胞膜上2个半通道相互作用而形成的细胞间空间,由不同Cx组成的GJ具有不同的通透特性,目前已证实人类细胞共表达21种Cx,而骨髓中仅表达3种Cx分子,即Cx31、Cx43和Cx45。造血细胞则以表达Cx43为主[3],小鼠敲除Cx43基因后,通常因心脏发育异常在出生后数小时内死亡而不利于进一步研究[4-5]。本研究使用Cx43 loxP/loxP和Lyz-Cre/+转基因小鼠进行杂交,筛选出仅在造血系统条件性敲除Cx43基因(Cx43-/-)的小鼠作为动物模型,并对骨髓和髓外造血器官及外周血进行鉴定,进一步研究Cx43在维持造血细胞自我更新及功能稳定中的作用,为临床用药提供理论依据。
材 料 和 方 法
1 实验动物的饲养及繁殖
Cx43 loxP/loxP 小鼠购自美国Jackson实验室;Lyz-Cre/+小鼠购自江苏省实验动物中心。引种后置苏州大学医学院无特定病原体级动物房中进行饲养,室内温度18~24 ℃,湿度40%~60%。小鼠笼盒每周进行1次消毒处理,垫料、饲料均经过[60Co-γ]照射灭菌处理,饮水经过高温高压灭菌处理。繁殖采用雌雄比例2 ∶1同笼的方式进行,每笼3只小鼠,每胎平均约产6~8只幼鼠,幼鼠出生23~30 d(体重10~12 g)后进行断奶、分笼。
2 实验方法
2.1小鼠的基因型鉴定 小鼠基因型的鉴定参考报道[6]的方法选用小鼠尾部组织,出生7 d编号后剪取尾尖 1 cm,置无菌试管中,液氮保存,备用。按北京天根生化科技有限公司生产的组织基因组DNA提取试剂盒说明书抽提DNA,并测量吸光度(A)值,后采用常规PCR法分析其基因型。检测的引物如下, loxP的上游引物序列为5’-CTTTGACTCTGATTACAGAGCTTAA-3’,下游引物序列为5’-GTCTCACTGTTACTTAACAGCTTGA-3’;Cre的上游引物序列为5’-CCCAGAAATGCCAGATTACG-3’,下游引物序列为5’-CTTGGGCT -GCCAGAATTTCTC-3’。loxP纯合仅有580 bp条带,loxP杂合则有580 bp和490 bp 2条条带,野生型(Cx43+/+,即不含loxP位点)仅有490 bp条带,即loxP/loxP=580 bp,wt/wt=490 bp,wt/loxP=490 bp+580 bp;基因组有Cre插入则出现700 bp的条带,否则没有条带。
2.2小鼠不同组织中Cx43基因表达变化的检测 分别收集Cx43-/-小鼠(KO组)和杂合子小鼠(loxP组)外周血、骨髓、肝脏、脾脏、肾脏和心脏等组织,按RNeasy Mini Kit 试剂盒(Qiagen)操作步骤抽取总MRNA。按SensiScript RT Kit 试剂盒(Qiagen)操作步骤逆转录cDNA第一链。取1 μL 逆转录的cDNA产物,用β-actin引物进行PCR扩增,取扩增产物进行琼脂糖凝胶电泳,紫外灯(GelDoc1000,Bio-Rad)下观测,确定cDNA是否逆转录成功。Cx43的上游引物序列为5’-CCCACCTTTGTGTCTTCCAT-3’,下游引物序列为5’-TTGCCTCCCTGATGCTAACT-3’;GAPDH的上游引物序列为5’-GGTGGTCTCCTCTGACTTCAACA-3’,下游引物序列为5’-GTGGTCGTTGAGGGCAATG-3’。qPCR检测不同组织Cx43的表达。qPCR总反应体系(20 μL):SYBR(GenePharma)10 μL,cDNA 2 μL,上、下游引物各0.4 μL,无核酸酶水7.2 μL。每个样本重复做3次,反应条件为95 ℃ 3 min ;95 ℃ 12 s、62 ℃40 s, 45个循环;以GAPDH作为内参照,由公式2-ΔΔCt计算Cx43 mRNA在KO组和loxP组小鼠中的相对表达量。
2.3小鼠骨髓造血细胞分离及鉴定 6~8周龄Cx43-/-及Cx43+/+小鼠各8只,体重18~20 g,经眼球取血,处死后置于75%乙醇中消毒,无菌条件下分离双侧股骨。股骨经反复冲洗后,所得细胞悬液通过4号针尖,使其成为单个细胞悬液。所得骨髓细胞用PBS液洗涤2次。所得细胞经计数及台盼蓝染色检测细胞存活率后备用。
2.45-氟尿嘧啶(5-fluorouracil,5-FU)处理及骨髓细胞分析 6~8 周龄Cx43-/-及Cx43+/+小鼠各10只,体重18~20 g,取2种小鼠各5只按125 mg/kg分别从尾静脉注入溶于生理盐水的5-FU,另5只为对照组,仅予同等量的生理盐水。在化疗前及化疗后第5和10及15 天经眼球后取血100 μL,测定其白细胞、血小板及血红蛋白。
2.5骨髓移植实验Cx43-/-及Cx43+/+小鼠各10只,体重18~20 g,分别给予7.5 Gy(60Co-γ)的致死量照射,剂量率1 Gy/min,照射后6 h分别予事先准备就序的骨髓细胞,按每只3×106的数量尾静脉注入。2周后处死小鼠检测造血及免疫细胞的重建情况。收集血液,并分离股骨和胫骨,除少量固定后切片外,收集其骨髓细胞,所有细胞经NH4Cl处理溶解红细胞,并与抗Fcg II和III受体(CD16/32,clone 2.4G2,Pharmingen)共同孵育15 min后,经无钙、镁PBS洗涤后,与PE、FITC或APC标记的单抗孵育30 min后,流式细胞术检测。选用单抗如下:CD45R(clone RA3-6B2)、 Gr-1(clone RB6-8C5)、CD4(clone GK1.5)、CD8a(clone 53-6.7)、TCRαβ(clone H57-597)、 Mac-1(clone M1/70)、抗sIgM、TER119(Ly-76)、 Sca-1(clone D7)及CD117(clone 2B8),单抗及对照均购自Pharmingen。
2.6体外造血细胞集落形成实验 分离上述移植小鼠骨髓细胞,采用甲基纤维素半固体培养,简述如下:将预制的2%甲基纤维素、2倍浓度RPMI-1640培养基、30%胎牛血清及2×109/L小鼠骨髓细胞充分混均,使其成终浓度为1%甲基纤维素、15%胎牛血清及2×108/L细胞的混合物,加入细胞因子如下:CFU-GM所用细胞因子为GM-CSF(20 μg/L)、SCF(100 μg/L)、IL-3(20 μg/L);CFU-E 所用细胞因子为EPO、IL-3(20 μg/L) 。接种于6 孔板, 每孔2 mL,置含5 % CO2、饱和湿度、37 ℃培养箱培养,分别于培养第14 天 计数集落数,细胞数≥50为集落。
3 统计学处理
采用GraphPad Prism 5软件进行统计学分析。计量数据用均数±标准差(mean±SD)表示,行Mann-WhitneyU检验和Student’st检验,以P<0.05为差异有统计学意义。
结 果
1 Cx43基因敲除小鼠的繁殖及鉴定
亲代Cx43 loxP/loxP小鼠与Lyz-Cre/+小鼠交配产生的F1代小鼠经PCR共检出2种基因型,即Cx43 loxP/-_Lyz-Cre/+和Cx43 loxP/-,各占约50%。Cx43 loxP/-_Lyz-Cre/+小鼠与Cx43 loxP/loxP小鼠杂交,其子代经PCR鉴定共有4种基因型,即 Cx43 loxP/loxP_Lyz-Cre/+、Cx43 loxP/-_Lyz-Cre/+、Cx43 loxP/loxP和Cx43 loxP/-,各占约25%。子代中Cx43 loxP/loxP_Lyz-Cre/+为纯合子,即Cx43-/-小鼠,见图1,Cx43 loxP/-_Lyz-Cre/+为杂合子小鼠,均可为今后进一步研究骨髓中Cx43基因作用机制提供实验动物模型。
2 Cx43基因敲除对小鼠其它器官的影响
对Cx43-/-小鼠其它组织或器官进行分析显示,本研究采用的条件性基因敲除技术可选择性敲除造血系统中Cx43基因的表达,其中外周血细胞中无Cx43表达,骨髓中仍有极少量的Cx43表达,可能是骨髓中的非造血细胞污染所致,而参与造血的脾脏和肝脏中Cx43的表达也显著下调(P<0.01)。心脏Cx43表达则无影响,肾脏Cx43则有所上调,见图2。
3 Cx43-/-小鼠经5-FU处理后造血恢复缓慢
造血系统Cx43基因敲除的小鼠成年后外周血象分析并无明显异常,但化疗后小鼠的造血恢复显著减缓,受损明显。在药物作用后10 d,野生型小鼠的血象已开始恢复,至15 d时已接近正常水平,而Cx43-/-小鼠则无明显的恢复迹象,其血红蛋白、白细胞及血小板仍处低位,2者差别有统计学显著性(P<0.01),见图3。体外集落实验也证实Cx43-/-小鼠造血干/祖细胞增殖能力下降,其CFU-GM或CFU-E集落数均明显少于野生型小鼠(P<0.01),提示Cx43-/-小鼠骨髓造血细胞增殖受损,造血系统应急能力下降,从而使造血重建延缓,见图4。
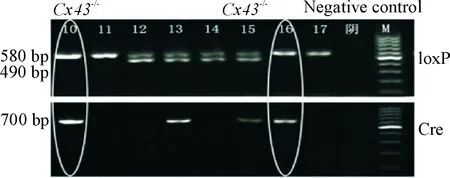
Figure 1. The expression ofCx43 gene in hybrid mice as determined by PCR assay. M: marker; Cre: products ofCregene; loxP: products ofloxPgene. The number represented for the mice screened in this study.n=138.
图1PCR法筛选和鉴定Cx43-/-和Cx43+/+小鼠

Figure 2.The relative mRNA expression of Cx43 from different tissues ofCx43-/-andCx43+/+mice determined by qPCR.Mean±SD.n=6.**P<0.01vsCx43+/+group.
图2qPCR法检测Cx43-/-小鼠不同组织中Cx43表达
4 Cx43-/-小鼠免疫细胞发育异常
Cx43-/-小鼠在骨髓移植后其外周血细胞流式细胞术分析提示其免疫细胞发育异常,外周血中CD4+CD8+双阳性细胞比例较野生型小鼠增多(P<0.05),但CD4+T细胞则显著减少(P<0.01),尤其是TCRαβ亚群细胞减少最为明显(P<0.01)。同样,B细胞发育也受影响,外周血中CD45R+sIgM-细胞亚群比例与野生型小鼠相比显著减少(P<0.01),见图5。

Figure 3.The peripheral blood cell counts ofCx43-/-andCx43+/+mice before and at different time points post 5-FU administration. Mean±SD.n=10.**P<0.01vsCx43-/-group.
图3Cx43-/-和Cx43+/+小鼠经5-FU处理后不同时点的血象变化
5 Cx43-/-小鼠经5-FU处理或骨髓细胞移植后骨髓造血细胞减少
与野生型小鼠对比,Cx43-/-小鼠无论化疗或移植后其骨髓造血功能重建均延迟,14 d时骨髓切片及涂片均证实其骨髓中造血细胞增生程度明显低于野生型小鼠,脂肪组织显著增多,见图6。Cx43-/-小鼠骨髓细胞的流式细胞术检测发现其骨髓中Lin-/c-Kit+/Sca-1+细胞亚群与野生型小鼠相比差异并无统计学显著性,其T、B淋巴细胞与外周血检测结果相似,但B系CD45R+sIgM-细胞亚群和CD4+T细胞亚群则显著减少(P<0.01),提示敲除造血细胞Cx43基因后,尽管造血/干祖细胞数量未见明显减少,但其增殖明显减缓,致使造血重建延迟并使其体液和细胞免疫功能受损。
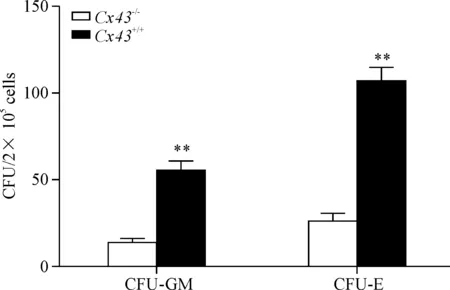
Figure 4.Colony-forming-unit (CFU) content of bone marrow cells inCx43-/-andCx43+/+mice at 14 d post bone marrow transplantation. Mean±SD.n=6.**P<0.01vsCx43-/-group.
图4移植后第14天Cx43-/-和Cx43+/+小鼠骨髓中集落形成变化

Figure 5.The proportion changes of T and B lineage cells subgroups inCx43 knock out/wild type mice. Mean±SD.n=8.*P<0.05,**P<0.01vsCx43-/-group.
图5Cx43-/-和Cx43+/+小鼠外周血中T和B淋巴细胞数量变化
讨 论
已确认人类不同组织中表达数十个不同亚型的Cx,不同基因缺陷可导致不同的疾病[7]。Presley等[8]结果显示Cx43对正常造血的支持尤为重要,是骨髓基质参与调控造血干/祖细胞生长的重要环节。在本研究中,我们采用条件性基因敲除技术选择性敲除造血细胞中Cx43基因表达,经筛选建立获得Cx43基因表达缺失的小鼠模型,采用qPCR证实Cx43-/-小鼠骨髓造血细胞不表达该分子,且参与造血的相关组织如肝脏和脾脏中Cx43基因表达也显著下调,其它部位Cx43表达与对照相似,提示采用本方案所获Cx43-/-小鼠模型是可靠的。
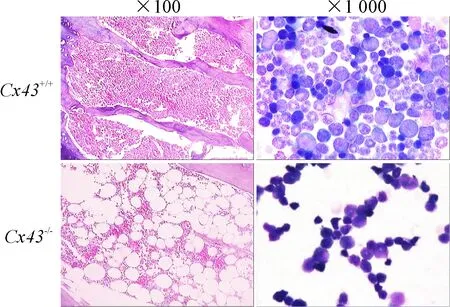
Figure 6.Bone marrow biopsy with HE staining at 14 d post bone marrow transplantation ofCx43-/-andCx43+/+mice.
图6移植后第14天Cx43+/+和Cx43-/-小鼠骨髓切片HE染色的形态学变化
现有的研究[9-11]发现Cx43在多种肿瘤细胞中呈高表达,并与细胞的迁移和药物敏感性相关。我们先前的研究也发现Cx43分子通过与骨髓基质细胞的相互作用影响多发性骨髓瘤细胞迁移、增殖和耐药性[12-14]。尽管有证据[15]表明Cx43表达是维持正常造血所必需,但骨髓中何种细胞表达的Cx43发挥关键作用尚未确定。本研究采用Cx43-/-小鼠模型,在化疗及移植层面分别观察了Cx43基因敲除对骨髓造血重建的影响,结果发现该类小鼠成年后外周血无异常,但经5-FU处理后,其血象恢复缓慢,提示其造血应急能力减弱。移植实验也有相似结果,有趣的是该类小鼠骨髓细胞流式细胞术分析并未发现其造血干/祖细胞亚群即Lin-/ c-Kit+/Sca-1+较野生型小鼠有明显减少。同时,体外集落试验发现Cx43-/-小鼠骨髓细胞CFU-GM或CFU-E集落数均明显少于野生型小鼠,提示Cx43-/-小鼠骨髓造血细胞增殖受损,从而使造血重建延缓。Foss等[16]采用Cx43基因敲除的杂合子小鼠(Cx43-/+)进行研究时也有相似发现。本研究结果证实造血细胞表达的Cx43分子与骨髓微环境中其它细胞形成的GJ在维持造血细胞增殖、分化中具重要作用。
免疫系统发育成熟是机体抵抗外源微生物入侵的重要保障,本研究证实Cx43分子在免疫细胞发育过程中具重要作用,Cx43-/-小鼠经化疗或移植后其外周血免疫细胞异常,与野生型小鼠相比,其CD4+T细胞显著减少,尤其是TCRαβ亚群细胞减少最为明显,但CD4+CD8+双阳性细胞则增多。对B细胞的分析也有类似结果,外周血中CD45R+sIgM-细胞亚群比例与野生型小鼠相比显著减少。研究证实[17-19]骨髓基质细胞表达Cx43,而表达Cx43的造血干/祖细胞可与基质细胞相互作用,通过旁分泌或自分泌的形式调节造血干/祖细胞的增殖与分化,并最终影响免疫细胞的发育与成熟。鉴此,本研究结果证实敲除造血系统中Cx43基因后,尽管造血干/祖细胞数量未见明显减少,但增殖明显减缓,应急能力减弱,致使造血重建延迟的同时尚可使其免疫功能受损。
