miR-219与TGFBR2的调控关系在肾脏纤维化中的作用*
2019-04-22李霜青许旭春
李霜青, 应 俊, 许旭春
(金华市中心医院, 浙江 金华 321000)
肾脏纤维化是各种慢性肾脏疾病进展到终末期肾病的共同途径,其临床病理形态包含肾小球硬化,细胞外基质(extracellular matrix,ECM)异常增多及过度沉积和肾小管间质纤维化,导致肾功能进行性下降等[1]。虽然肾脏纤维化早期所造成的肾脏损伤是可逆的,但在瘢痕形成期纤维化损伤则不可逆转,因此,探寻相关生物学指标在防治和延缓纤维化进展中的作用,对肾脏纤维化治疗策略的制定和预后风险评估具有重要意义。多项研究提示,转化生长因子 β(transforming growth factor-β,TGF-β)在肾脏纤维化过程中是一种关键促纤维化因子,具有促进肾小球硬化、肾间质纤维化和ECM沉积等作用[2]。TGF-β信号传导需要转化生长因子βⅠ型受体(TGF-β receptor type 1,TGFBR1)和TGFBR2共同参与,且TGFBR1需要TGFBR2的参与才能激活并与TGF-β结合从而进一步激活下游通路,引发一系列纤维化效应[3],因此,TGFBR2在TGF-β信号通路中具有重要作用。研究发现多种微小RNA(microRNA,miRNA,miR)与肾脏纤维化密切相关,具有成为肾脏纤维化诊断指标及治疗靶点的潜力[4]。本研究通过分析miR-219靶向调控TGFBR2在肾脏纤维化中发挥的作用,并观察miR-219对单侧输尿管闭塞(unilateral ureteral occlusion,UUO)小鼠肾脏纤维化进程的影响,为诊断及治疗肾脏纤维化提供新的治疗方向和研究靶点。
材 料 和 方 法
1 研究对象
收集2017年9月~2018年3月在我院就诊的70例肾脏纤维化患者,其中男性32例,女性38例;年龄33~65岁,平均年龄(49.36±10.87)岁。选取同期来本院体检的20例健康人设为对照组,其中男性10例,女性10例;年龄32~66岁,平均年龄(48.60±8.85)岁。2组均符合知情同意原则,性别和年龄等一般资料比较差异无统计学显著性,具有可比性。入组标准为肾脏纤维化患者均经穿刺活检证实为肾脏纤维化。排除标准为排除合并泌尿系感染、糖尿病、孕妇和恶性肿瘤的患者。
2 方法
2.1外周血采集 2组均于清晨空腹状况下抽取外周静脉血3 mL(采用一次性血清分离胶管),待血清析出后以1 000 ×g离心10 min,取上层血清保存至-80 ℃冰箱待检测。
2.2建立UUO小鼠模型 选取7周龄雄性SPF级C57BL/6J小鼠20只, 动物合格证号为SYXK(浙)2018-0012,体质量(20±2) g,随机分为UUO组和假手术(sham)组。饲养环境:温度(22±1) ℃,相对湿度(55±5) %。小鼠经腹腔注射10%水合氯醛(4 mL/kg),约2 min小鼠麻醉后,UUO组(n=10)取仰卧位固定小鼠,术前消毒,于无菌条件下,取腹部正中白线为手术切口,寻找左侧输尿管并钝性分离输尿管至肾门,于小鼠肾脏下极和肾门处分别用丝线结扎左侧输尿管,并于两结扎处之间剪断输尿管,右侧输尿管不予任何处理,缝合腹膜,消毒,缝合腹直肌和皮肤,再次消毒。假手术组(n=10)小鼠除不结扎输尿管外,其余操作与UUO组相同。
2.3RT-qPCR实验 采用TRIzol 法提取总RNA,实验按照试剂盒说明书中步骤进行。将提取的总RNA按照反转录试剂盒的说明书进行逆转录,合成cDNA。按照试剂盒说明书进行qPCR反应。miR-219的上游引物序列为 5’-ATCCAGTGCGTGTCGTG-3’,下游引物序列为 5’-TGCTTGATTGTCCAAACG-3’;U6的上游引物序列为 5’-GCAGTGCTTAGCTGGTTGT-3’,下游引物序列为 5’-GCGAGCACAGAATTAATACGAC-3’;TGFBR2的上游引物序列为 5’-CTAACCTGCTGCCTGTGTGA-3’,下游引物序列为 5’-TCTGGAGCCATGTATCTTGC-3’;α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的上游引物序列为 5’-TACTGCCGAGCGTGAGAT-3’,下游引物序列为 5’-GCTTCCTCGTATTCCTGTTT-3’;结缔组织生长因子(connective tissue growth factor, CTGF)的上游引物序列为 5’-CAAAGCAGCTGCAAATACCA-3’,下游引物序列为 5’-GGCCAAATGTGTCTTCCAGT-3’;Ⅰ型胶原α1链(type Ⅰ collagen α1, COL1A1)的上游引物序列为 5’-AACATAATCCGCAGTGGCCT-3’,下游引物序列为 5’-CTCCTGTTGCGTTGCTCCTT-3’;COL3A1的上游引物序列为 5’-CCCAGAACATCACATATCAC-3’,下游引物序列为 5’-CAAGAGGAACACATATGGAG-3’;GAPDH的上游引物序列为 5’-CAAGGTCATCCATGACAACTTTG-3’,下游引物序列为 5’-GTCCACCACCCTGTTGCTGTAG-3’。PCR反应程序为: 95 ℃ 5 min; 95 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 60 s, 35个循环; 72 ℃ 7 min。每个检测指标设3个平行样,每次检测结果均重复3次。
2.4细胞培养和转染 大鼠肾成纤维细胞NRK49F在37 ℃、5% CO2条件下,置于含10%胎牛血清、100 mg/L青霉素和100 mg/L链霉素的DMEM培养基中培养,每3 d换液1次,3~5 d传代1次。按照说明书分别将miR-219模拟物(miR-219 mimics)和阴性对照(negative control) miRNA mimics (NC)转染进NRK49F细胞。
2.5萤光素酶报告分析 构建TGFBR2野生型3’-UTR萤光素酶报告基因质粒pMIR-WT,并以pMIR-WT质粒为模板,利用PCR搭桥法(overlapping PCR)构建其潜在结合位点突变型报告基因质粒pMIR-Mut。将miR-219mimics、内参照海肾萤光素酶以及pMIR-WT和pMIR-Mut报告基因质粒共转染进NRF49F细胞中,在细胞培养箱中培养36 h后,用Passive Lysis Buffer裂解细胞后分析双萤光素酶活性。
2.6Western blot实验 采用含50 mmol/L Tris-HCl(pH 7.4)、150 mmol/L NaCl、0.5%脱氧胆酸钠、0.1% SDS和蛋白酶抑制剂及1 mmol/L苯甲基磺酰氟的RIPA裂解液分离蛋白质。通过SDS-PAGE进行分离,按说明书进行Western blot实验检测TGFBR2和α-SMA的蛋白表达。实验重复3次。
2.7HE和Masson’s trichrome染色 切取UUO小鼠肾脏标本并用固定液固定,浸蜡包埋,固定于切片机上切片成3~5 μm薄片,按照说明书分别采用HE染色和Masson’s trichrome染色对假手术组小鼠、UUO组小鼠和UUO+miR-219组小鼠肾脏进行纤维化分析。
3 统计学方法
采用SPSS 22.0统计软件进行数据分析,计量资料用均数±标准差(mean±SD)表示,两组独立样本均数比较采用t检验,多组独立样本比较采用单因素方差分析(one-way ANOVA),多组组间多重比较采用SNK法,以P<0.05为差异有统计学意义。
结 果
1 miR-219在肾纤维化患者血清及UUO小鼠肾脏中的水平
RT-qPCR检测结果显示,miR-219在肾纤维化患者血清中的水平明显低于对照组(P<0.01),见图1A。与假手术组小鼠相比,miR-219在UUO小鼠肾脏组织内表达水平显著降低(P<0.01), 见图1B。以上结果均提示miR-219可能与肾脏纤维化存在相关性。

Figure 1.The miR-219 expression in the serum of patients with renal fibrosis (A) and the renal tissue of UUO mice (B). Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vssham group.
图1miR-219在肾纤维化患者及UUO小鼠中表达的变化
2 miR-219抑制NRK49F细胞α-SMA的表达
使用AngII(10-7mol/L)刺激NRK49F细胞24 h后,RT-qPCR检测结果显示,相比对照组,AngII处理组中miR-219的表达水平明显降低(P<0.01),见图2A。将miR-219 mimics和NC分别转染进NRK49F细胞中并采用AngII(10-7mol/L)进行刺激24 h,Western blot检测结果显示,相比对照组,AngII处理组中的α-SMA蛋白表达升高,但AngII+miR-219 mimics组中的α-SMA蛋白表达水平明显低于AngII处理组(P<0.01),见图2B,这表明AngII刺激NRK49F细胞对α-SMA表达的促进效果会被miR-219 mimics抑制,提示miR-219可下调α-SMA的表达并抑制AngII诱导的肾脏细胞纤维化。
3 miR-219通过结合NRK49F细胞TGFBR2的 3’-UTR来抑制TGFBR2的表达
通过microRNA靶基因数据库TargetScan进行筛选预测,确定miR-219的潜在靶基因为TGFBR2,见图3A。通过构建TGFBR2野生型3’-UTR萤光素酶报告基因质粒pMIR-WT及突变型报告基因质粒pMIR-Mut,验证TGFBR2为miR-219的靶基因。
Figure 2.The expression of α-SMA at mRNA and protein levels was inhibited by miR-219. A: the miR-219 expression in the NRK49F cells treated with AngII; B:the protein expression of α-SMA in the NRK49F cell treated with AngII and/or miR-219 mimics was determined by Western blot. Mean±SD.n=3.**P<0.01vsNC group;##P<0.01vsAngII group.
图2miR-219抑制α-SMA的表达
将miR-219 mimics和NC miRNA mimics以及pMIR-WT和pMIR-Mut报告基因质粒共转染进NRF49F细胞中,双萤光素酶检测结果显示,miR-219 mimics可明显抑制pMIR-WT质粒萤光素酶的活性(P<0.01);而对pMIR-Mut萤光素酶的活性无明显影响,见图3B。该结果显示miR-219可结合TGFBR2的3’-UTR并抑制TGFBR2的表达。
4 miR-219抑制TGFBR2的mRNA及蛋白表达水平
为进一步证明miR-219对NRK49F细胞TGFBR2的调控作用,采用RT-qPCR检测发现,相比NC组,miR-219 mimics转染组TGFBR2的 mRNA表达明显下降(P<0.01),见图4A。同时Western blot检测结果显示,相比NC组,miR-219 mimics转染组TGFBR2蛋白的表达量明显下降(P<0.01),见图4B。以上结果表明miRNA-219可以抑制TGFBR2的mRNA及蛋白表达。
5 miR-219抑制α-SMA、CTGF、COL1A1和COL3A1的mRNA表达水平
RT-qPCR检测对照组和miR-219 mimics转染组中肾脏纤维化因子α-SMA、CTGF、COL1A1和COL3A1的mRNA表达水平,结果显示,相比对照组,miR-219 mimics转染组中上述纤维化因子的mRNA表达水平均明显降低(P<0.01),见图5。这些结果表明,miR-219能够抑制肾脏纤维化的进程。
6 miR-219对UUO小鼠肾脏纤维化的影响
HE染色显示,假手术组小鼠肾小管和肾小球结构清晰,上皮细胞排列整齐,小管基底膜较完整,间质中未见明显炎症细胞浸润;UUO小鼠肾小球扩张,上皮细胞变性萎缩坏死;但UUO小鼠在注射miR-219(30 mg/kg,每隔3天注射1次)后,肾纤维化进程则明显受到抑制。Masson’s trichrome染色检测发现,相比UUO小鼠,UUO+ miRNA-219组小鼠肾脏纤维化区域减小,细胞外基质沉积变少,见图6A。同时我们还观察到UUO+ miR-219组小鼠肾脏组织中COL1A1和COL3A1的mRNA表达水平均明显低于UUO小鼠(P<0.05),见图6B。上述结果表明miR-219在UUO小鼠的肾纤维化进程中发挥抑制作用。

Figure 3.TGFBR2 was the target gene of miR-219 in the NRK49F cells. A: the predicted consequential of target region; B: the dual-luciferase reporter analysis of target gene and miR-219. Mean±SD.n=3.**P<0.01vspMIR group and pMIR-Mut group.
图3NRK49F细胞的TGFBR2是miR-219的靶基因
Figure 4.The expression of TGFBR2 at mRNA and protein le-vels was inhibited by miR-219 in the NRK49F cells. A:the mRNA expression of TGFBR2 in the NRK49F cells treated with miR-219 was determined by RT-qPCR; B:the protein expression of TGFBR2 in the NRK49F cells treated with miR-219 mimics was determined by Western blot. Mean±SD.n=3.**P<0.01vsNC group.
图4miR-219抑制NRK49F细胞TGFBR2的mRNA及蛋白表达水平
讨 论
肾脏纤维化的主要临床表现为肾小球硬化,肾小管萎缩,ECM异常增多及过度沉积和肾间质纤维化等,其病理过程有多种因子的参与。当前研究发现,TGF-β/Smad信号通路、MAPK信号通路和腺苷信号通路等多种信号通路激活与肾脏纤维化紧密相关[5],且随着对miRNAs研究的不断深入,越来越多的miRNAs被发现与肾纤维化具有相关性。
miRNA是一类具有高度保守性的长度约为19~25 nt的非编码单链小分子RNA,其通过与靶基因mRNA的3’-UTR完全或不完全配对,在转录后水平抑制基因表达。研究报道,miR-200a可通过靶向调控TGF-β2抑制肾脏纤维化的发展[6];miR-29b在大鼠肾脏髓质上皮细胞中可通过调控COL1A1,COL3A1和COL4A1等胶原基因表达,从而具备抗纤维化功能[7];有学者检测到miR-21在肾纤维化患者肾组织中表达升高。虽已有多种miRNA与肾脏纤维化的密切关系被报道,但miR-219在肾脏纤维化中的作用及影响尚鲜有报道。本研究首先通过RT-qPCR检测到肾纤维化患者血清中miR-219的表达水平明显低于健康检查者,并且在构建的UUO小鼠模型中也发现miR-219在肾脏组织内表达水平显著降低,这表明miR-219可能与肾脏纤维化存在相关性。
在肾损伤时,AngII及其受体在成纤维细胞和系膜细胞中表达上调,刺激成纤维细胞增殖,促使ECM生成,促进TGF-β血小板衍生生长因子(platelet derived growth factor, PDGF)等生长因子分泌而发挥促纤维化作用。肾损伤同时,α-SMA表达升高,标志着上皮细胞向肌成纤维细胞表型转化,促使肾间质中肌成纤维细胞聚集,导致ECM合成和分泌增多,促进纤维化的形成。研究显示,在体外培养的肾小管上皮细胞中,α-SMA表达可被TGF-β1上调且肾小管上皮细胞表型转化[3]。本研究采用AngII刺激NRK49F细胞后发现miR-219表达明显降低,且Western blot结果显示α-SMA蛋白表达升高;进一步用AngII刺激转染了miR-219 mimics的NRK49F细胞,观察到α-SMA蛋白表达水平明显低于AngII刺激的NRK49F细胞,上述结果表明miR-219可抑制α-SMA的表达及AngII诱导的肾脏细胞纤维化,提示miR-219可能在肾脏纤维化的过程中发挥抑制作用。
TGFBR2是TGF-β II型受体编码基因,其胞内含丝氨酸/苏氨酸激酶结构域,在肝脏和肾小球中密度最高。TGF-β必须通过与细胞膜上包括TGFBR2在内的特异性受体结合,才能发挥生物学作用。研究显示,TGF-β是一种强烈的促纤维化因子,是促进肾纤维化发生发展的关键因子[8],TGF-β1是TGF-β家族中最重要的成员之一,可促进肾小球硬化和肾间质纤维化。在纤维化进程中,TGF-β1可增加ECM的合成,上调纤溶酶原激活物抑制剂(plasminogen activator inhibitor, PAI)和组织金属蛋白酶抑制剂(tissue inhibitor of matrix metalloproteinases, TIMPs)表达并减少基质金属蛋白酶(matrix metalloproteinases, MMPs)生成,抑制ECM降解,趋化并促进成纤维细胞增殖,刺激多种细胞因子合成和分泌,引起ECM过度沉积,并在肾小管上皮细胞向肌成纤维细胞转分化中发挥重要作用[9]。TGF-β信号转导时,TGFBR2可以与TGF-β直接结合,TGFBR2自身磷酸化后被激活,与TGFBR1结合形成复合物并使TGFBR1的GS结构域磷酸化,激活TGFBR1;激活的受体复合物再通过Smads依赖性和MAPK等非Smads依赖性的途径发挥其促纤维化作用。因此TGFBR2在TGF-β介导的信号转导通路及促进肾脏纤维化中具有重要作用。研究发现,UUO诱导的肾脏纤维化中检测到TGFBR1和TGFBR2增加[10]。miR-219可以抑制TGFBR2的表达并对TGF-β介导的信号通路造成干扰,从而抑制皮肤纤维化。
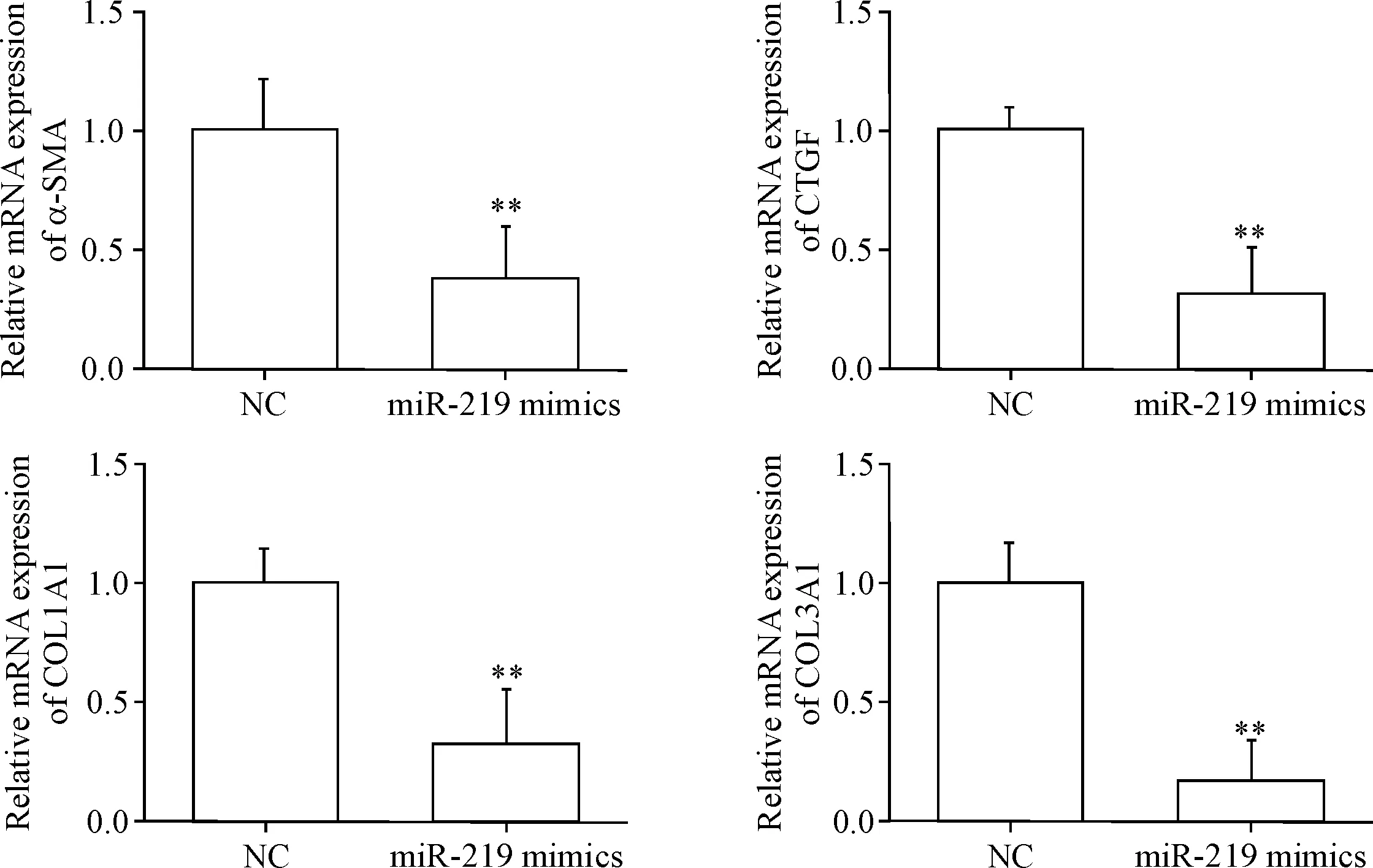
Figure 5.The mRNA levels of renal fibrosis factors were decreased in the NRK49F cells treated with miR-219. Mean±SD.n=3.**P<0.01vsNC group.
图5miR-219抑制NRK49F细胞肾脏纤维化因子的mRNA表达

Figure 6.The renal fibrosis process was inhibited by miR-219 in the UUO mice. A: the morphology of renal fibrosis in UUO mice treated with miR-219 was detected by HE and Masson staining (×40); B: the mRNA level of fibrosis markers in the renal tissues of UUO mice treated with miR-219. Mean±SD.n=3.**P<0.01vssham group;##P<0.01vsUUO group.
图6miR-219抑制UUO小鼠的纤维化进程
本研究通过miRNA靶基因数据库预测TGFBR2是miR-219的潜在靶基因,并通过双萤光素酶检测发现miR-219可通过结合TGFBR2的3’-UTR进而抑制TGFBR2的表达。同时通过RT-qPCR和Western blot确定了miR-219可以抑制TGFBR2的mRNA和蛋白的表达水平,进一步验证了miR-219对TGFBR2的靶向调控作用。
CTGF与肾脏、皮肤、肺和肝脏等多种组织器官纤维化的进程有关,在肾脏中含量最高。CTGF是TGF-β促纤维化信号通路的下游因子之一,刺激细胞增殖及ECM的形成,促进肾脏纤维化[11]。ECM的主要成分包括I型胶原和III型胶原,COL1A1和COL3A1分别是I型胶原和III型胶原的组成部分,与肾脏间质纤维化密切相关。本研究中我们发现NRK49F细胞转染miR-219 mimics后,α-SMA、CTGF、COL1A1和COL3A1这些肾脏纤维化相关因子mRNA的表达均显著下降,这预示miR-219能够通过抑制TGFBR2的表达,干扰TGF-β信号通路,从而抑制肾脏纤维化的发展。
本研究通过构建了UUO小鼠模型以进一步观察miR-219对肾脏纤维化的影响。HE染色和Masson’s trichrome染色均显示,UUO小鼠在注射miR-219后,纤维化进程明显受到抑制。同时本研究还检测到COL1A1和COL3A1的mRNA表达水平也明显低于UUO小鼠。这些结果均表明miR-219可以抑制UUO小鼠肾脏纤维化的发展。
综上所述,miR-219可抑制AngII诱导的肾脏细胞纤维化并下调肾脏纤维化因子α-SMA、CTGF、COL1A1和COL3A1的表达,对UUO小鼠肾脏纤维化产生抑制效果。本研究结果显示,miR-219可以结合TGFBR2的3’-UTR并抑制TGFBR2的表达,进而干扰TGF-β信号通路,抑制肾脏纤维化的发展。因此,miR-219可能成为肾脏纤维化诊断及治疗的新靶点。
