芪参益气滴丸通过TRPC1/STIM1通路调节Ca2+稳态发挥抗动脉粥样硬化作用
2019-04-22胡武明施振华叶士勇向贻佳曾春来
胡武明, 施振华, 叶士勇, 向贻佳, 曾春来
(丽水市中心医院心血管内科, 浙江 丽水 323000)
动脉粥样硬化(atherosclerosis,AS)作为全球主要致死性心脑血管疾病,其发病率逐年上升[1]。大量临床研究以及动物实验证实,AS的发生与脂质代谢异常密切相关,如血液中甘油三酯(triglyceride,TG)和总胆固醇(total cholesterol,TC)异常增加引起的脂质沉积是AS发生的重要环节[2]。不健康的生活方式,大量摄入高脂食物,生活压力过大以及运动减少等是诱导体内脂质代谢紊乱,诱发炎症反应,导致AS形成的主要原因[3]。血管内皮具有调节血管壁收缩和血栓形成的作用,血管内皮功能障碍也是AS和其它心脑血管疾病发生的预测指标之一[4]。因此,减轻高血脂诱导的血管内皮损伤对于AS的防治具有重要意义。
钙离子(Ca2+)是细胞中重要的信号转导离子,参与胞内Ca2+释放及胞外Ca2+内流的细胞信号传递[5]。血管内皮细胞Ca2+内流可以通过刺激舒张因子一氧化氮(nitric oxide,NO)的释放维持血管内环境的稳定,参与抵御血管疾病的作用[6]。钙库操纵性钙通道(store-operated calcium channel,SOCC)可通过调控其结构蛋白瞬时受体电位通道蛋白1(tran-sient receptor potential channel protein 1,TRPC1)和基质交互分子1(stromal interaction molecule 1,STIM1)维持细胞内Ca2+稳态,在血管疾病发生发展过程中发挥作用[7]。本项工作以AS模型大鼠为研究对象,通过检测TRPC1/STIM1介导的SOCC探讨芪参益气滴丸(Qishen-Yiqi dripping pills,QS)在治疗AS中的作用机制。
材 料 和 方 法
1 药品与试剂
芪参益气滴丸购自天津天力士制药股份有限公司(Z20030139);阿托伐他汀购自辉瑞制药有限公司(H20051408);抗TRPC1(ab51255)、STIM1(ab108994)、内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)(ab76198)和GAPDH(ab8245)抗体购自Abcam;NO测定试剂盒(硝酸还原酶法)、白细胞介素 1β(interleukin-1β,IL-1β)、IL-6和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)ELISA试剂盒购自南京建成生物研究所。
2 实验动物与分组
雄性SPF级SD大鼠36只,8周,体重(230±20) g,由浙江省实验动物中心提供,许可证号:SYXK(浙)2014-008。采用数字随机法将实验动物随机分为正常对照(control,Con)组 (n=6)和AS模型组(n=30);AS模型建立后随机分为:模型(model)组(n=6),芪参益气滴丸低(low-dose QS)、中(middle-dose QS)、高剂量(high-dose QS)组(均n=6),阳性对照(positive control,PC)组(n=6)。芪参益气滴丸使用蒸馏水配制成135 kg/L(低剂量)、270 kg/L(中剂量)和300 kg/L(高剂量),按1 mL/kg的体积灌胃,每天1次;阳性对照组每天灌胃1次阿托伐他汀,2.5 mg/kg。
3 主要方法
3.1AS模型建立 AS模型组动物给予高脂饲料(2%胆固醇、10%蛋黄粉、10%猪油、0.5%胆酸钠、8%全脂奶粉和69.5%基础饲料)喂养,每天30~40 g,自由饮水,定期观察体重、饮水以及活动情况,正常对照组给予基础饲料喂养,饲养6周。从第7周开始处理组采用灌胃法分别给予芪参益气滴丸处理,阳性对照组给予氟伐他汀处理,正常组和模型组灌胃同等体积蒸馏水。实验12周后使用戊巴比妥钠(40 mg/kg)腹腔注射麻醉,心脏采血,取动脉组织保存于-80 ℃或固定于4%的多聚甲醛中备用。
3.2HE染色观察大鼠主动脉病理变化 将固定于多聚甲醛中的动脉组织取出,使用浓度梯度乙醇脱水后使用二甲苯透明,然后经石蜡包埋后切片。将切片使用二甲苯进行脱蜡,蒸馏冲洗后使用苏木精染色,1%盐酸分色20 s,流水冲洗后0.5%伊红染色,乙醇脱水透明,封片,光学显微镜下观察组织病理变化。
3.3血清中血脂、Ca2+浓度和炎症因子水平检测 血液收集后,静置30 min,然后1 500×g离心10 min,分离血清后分装保存于-20 ℃备用。使用全自动生化分析仪检测TG、TC、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)、Ca2+水平;使用ELISA试剂盒检测大鼠血清炎症因子IL-1β、IL-6和TNF-α水平。
3.4硝酸还原酶法检测动脉组织中NO含量 根据试剂盒说明书,准确称取大鼠动脉组织,根据重量体积1∶9加入生理盐水制备10%的组织匀浆液,离心取上清根据试剂盒说明书加样,于550 nm波长下检测吸光度(A)值,并根据标准品计算NO浓度。
3.5Western blot检测动脉组织中TRPC1、STIM1和eNOS蛋白表达水平 取大鼠动脉组织50 mg于1.5 mL EP管中并加入含蛋白酶抑制剂的RIPA裂解液1 mL,每管加入2粒玻璃珠,匀浆器匀浆后,4 ℃、12 000 r/min离心15 min,取上清保存备用。使用BCA试剂盒进行蛋白定量。每组取30 μg蛋白进行SDS-PAGE,检测TRPC1、STIM1和eNOS蛋白表达情况;以GAPDH作为内参照,使用BandScan 5.0软件进行图像分析。
4 统计学分析
使用SPSS 19.0软件进行所有结果的统计学分析,所有数据均采用均数±标准差(mean±SD)表示,组间比较采用单因素方差分析(one-way ANOVA)及SNK-q检验,以P<0.05表示差异有统计学意义。
结 果
1 芪参益气滴丸对大鼠动脉组织结构的影响
对照组大鼠动脉组织血管壁光滑完整,无脂质沉积和斑块引起的血管狭窄现象;与对照组相比,AS模型大鼠血管内膜明显增厚,血管狭窄,粥样硬化斑块形成;芪参益气滴丸处理后AS大鼠血管内膜增厚和血管狭窄明显减轻,见图1。
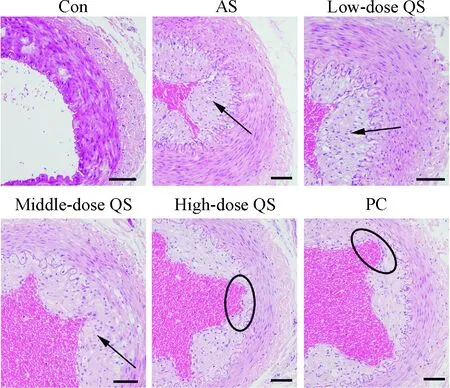
Figure 1.The histopathological changes of rat arterial (HE staining, scale bar=50 μm). Arrow: atherosclerotic plaque and intimal thickening; oval: reducing the formation of plaque.
图1大鼠动脉组织病理学变化
2 芪参益气滴丸对AS大鼠血脂水平的影响
使用全自动生化分析仪检测大鼠血液TC、TG、LDL-C和HDL-C的水平,结果显示,与对照组相比,AS模型组大鼠血清TC、TG和LDL-C显著升高,HDL-C的水平显著减低(P<0.05);与AS组相比,高剂量芪参益气滴丸处理后大鼠TC、TG和LDL-C水平显著降低,HDL-C的水平显著升高(P<0.05),见图2。
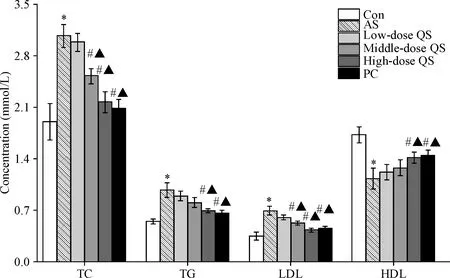
Figure 2.The serum lipid levels of rats in each group. Mean±SD.n=3.*P<0.05vsCon group;#P<0.05vsAS group;▲P<0.05vslow-dose QS group.
图2各组大鼠血脂水平变化
3 芪参益气滴丸对AS大鼠血清炎症因子水平的影响
与对照组相比,AS组大鼠血清中促炎因子IL-1β、IL-6和TNF-α的水平显著升高(P<0.05);与AS组相比,芪参益气滴丸处理以后大鼠血清中促炎因子IL-1β、IL-6和TNF-α的水平显著降低(P<0.05),见图3。
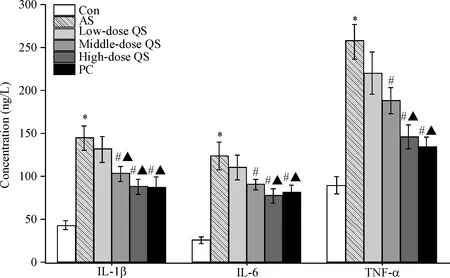
Figure 3.The serum levels of inflammatory factors IL-1β, IL-6 and TNF-α of rats in each group. Mean±SD.n=3.*P<0.05vsCon group;#P<0.05vsAS group;▲P<0.05vslow-dose QS group.
图3各组大鼠血清炎症因子IL-1β、IL-6和TNF-α水平变化
4 芪参益气滴丸对AS大鼠血清Ca2+和动脉组织中NO水平影响
与对照组相比AS大鼠血清中Ca2+显著升高和动脉组织中NO水平显著降低(P<0.05);与AS大鼠相比芪参益气滴丸处理后大鼠血清中Ca2+显著降低和动脉组织中NO水平显著升高(P<0.05),且芪参益气滴丸高剂量组和中剂量组Ca2+显著低于低剂量组,NO水平显著高于低剂量组(P<0.05),见图4。
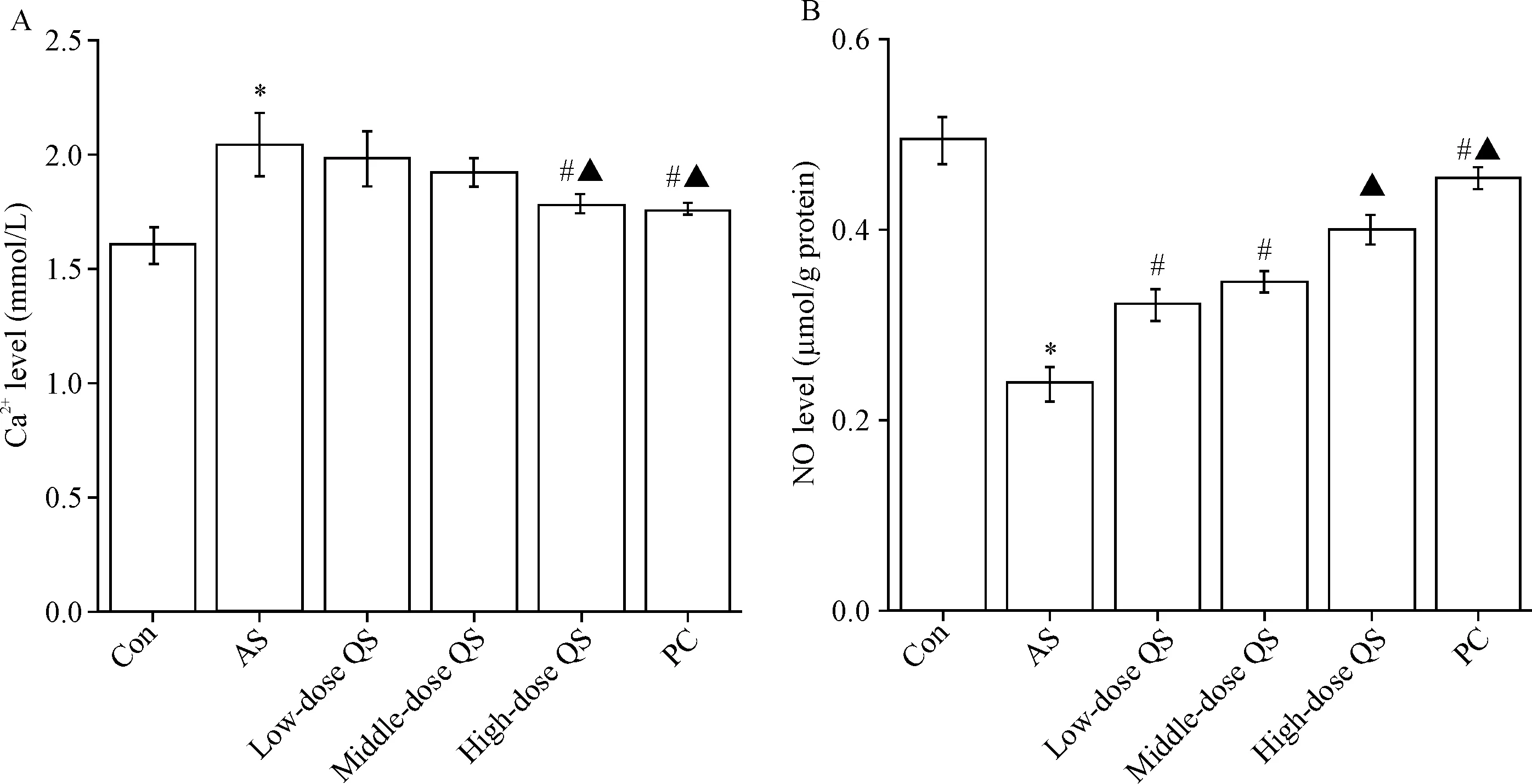
Figure 4.The serum Ca2+level (A) and arterial tissue NO level (B) of rat in each group. Mean±SD.n=3.*P<0.05vsCon group;#P<0.05vsAS group;▲P<0.05vslow-dose QS group.
图4大鼠血清Ca2+水平和动脉组织中NO水平变化
5 芪参益气滴丸处理对AS大鼠动脉组织中TRPC1、STIM1和eNOS蛋白表达的影响
与对照组相比,AS大鼠动脉组织中TRPC1和STIM1蛋白表达显著升高,eNOS蛋白表达显著降低(P<0.05);与AS大鼠相比,芪参益气滴丸处理后TRPC1和STIM1蛋白表达显著降低,eNOS蛋白表达水平显著升高(P<0.05),且芪参益气滴丸高剂量组对TRPC1、STIM1和eNOS蛋白表达的调节作用显著优于低剂量组(P<0.05),见图5。
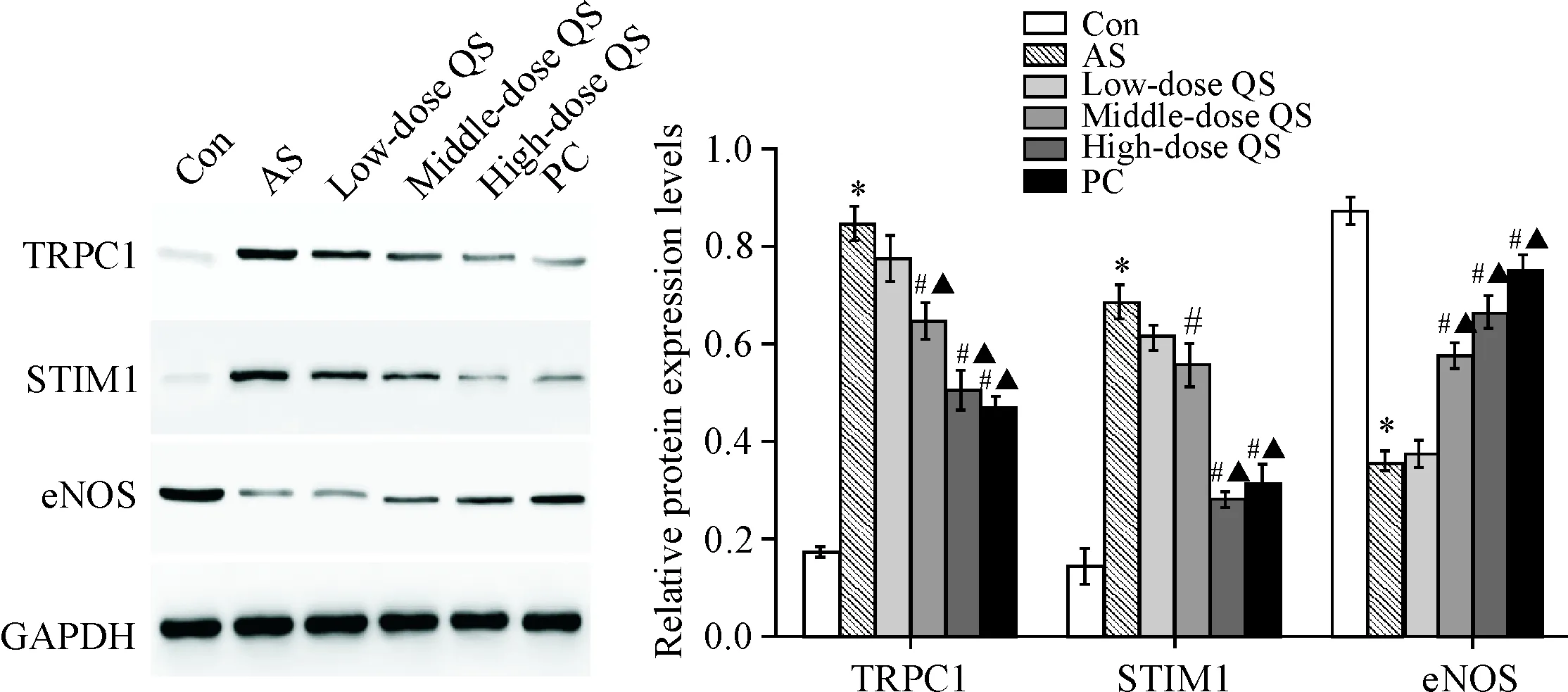
Figure 5.Western blot analysis of TRPC1, STIM1 and eNOS protein expression levels in rat arterial tissues. Mean±SD. n=3.*P<0.05vsCon group;#P<0.05vsAS group;▲P<0.05vslow-dose QS group.
图5大鼠动脉组织中TRPC1、STIM1和eNOS蛋白表达水平变化
讨 论
AS是一种慢性免疫疾病,其病理过程表现为巨噬细胞吞噬脂质形成泡沫细胞并聚集在血管壁,诱发炎性细胞因子的释放,从而导致脂质堆积形成斑块,堵塞血管[8]。AS的发生是多种致病因素综合作用的结果,包括血管内皮细胞和平滑肌细胞损伤、血脂代谢异常、血小板聚集、氧化应激及炎症反应等。在高血脂等因素作用下,低密度脂蛋白能够通过诱导内皮细胞损伤,降低血管舒张因子NO的合成释放,引起血管舒张障碍以及平滑肌细胞损伤,是AS形成的关键[9]。
芪参益气滴丸主要由黄芪、丹参、三七和降香等中药组成。黄芪中含有的黄芪多糖和黄酮类化合物具有温补心气、活血化瘀、改变血管通透性的作用;丹参和三七具有通经活络的作用。因此,芪参益气滴丸具有益气活血、通经活络、扩张血管的作用。研究显示芪参益气滴丸对冠心病患者血脂代谢紊乱具有良好的调节作用,可以通过降低TC、LDL以及提高HDL延缓冠状动脉粥样硬化的发展[10]。本研究结果表明芪参益气滴丸能够显著降低AS大鼠血清中TC、TG、LDL-C同时提高HDL-C的水平,提示芪参益气滴丸可以通过调节脂质代谢减缓AS的发展。宋郁珍等[11]也证实芪参益气滴丸可以调节高胆固醇血症家兔脂质代谢紊乱。
炎症反应在AS病变起始、斑块破裂以及血栓形成过程中发挥重要作用。临床研究表明,AS患者血清中的炎症因子水平如IL-1β、IL-6和TNFα水平显著提高[12-13]。IL-1β和IL-6具有广泛的炎症诱导和免疫调节作用,可以通过炎症反应以及脂质代谢促进AS的发展[14]。TNF-α可以通过促进LDL的生成和降低HDL的合成,诱导脂类代谢异常。此外,TNF-α还可以通过抑制eNOS的合成,诱导血管内皮细胞损伤以及刺激内皮细胞表达黏附分子,导致内皮功能障碍,从而加速AS的形成和发展[15-16]。本研究中芪参益气滴丸可通过降低AS大鼠血清炎症因子IL-1β、IL-6和TNF-α的水平,减轻AS大鼠炎症反应,发挥抗AS作用。
Ca2+作为细胞内重要的第二信使,可以通过调节细胞线粒体功能,介导AS的发展。已有研究证实动脉粥样硬化斑块中的Ca2+浓度显著高于正常组织[17]。血管组织中Ca2+稳态与SOCC密切相关。当血管平滑肌细胞中Ca2+过度消耗以后,会引起STIM1激活并转移到细胞膜上,与TRPC1结合形成SOCC,介导钙库操纵性钙内流,提高胞内Ca2+浓度[18]。Wang等[19]表明诱导Ca2+内流可以通过降低冠状动脉血管平滑肌细胞活性,促进AS的发展,但沉默TRPC1或阻断钙库操纵性钙内流后AS发展受到抑制。本研究中芪参益气滴丸处理后大鼠动脉组织中TRPC1和STIM1的蛋白表达显著降低,说明芪参益气滴丸可以通过降低TRPC1/STIM1诱导的Ca2+升高,减轻动脉粥样硬化引起的血管内皮损伤。目前研究发现Ca2+稳态是激活eNOS合成NO的关键因素。生理条件下eNOS可以通过合成NO,舒张血管,发挥血管保护作用。研究表明,血管紧张素可以诱导猪主动脉内皮细胞Ca2+浓度升高,同时eNOS和NO的表达下降[20]。本研究中AS大鼠动脉组织中eNOS水平显著降低,芪参益气滴丸处理后AS大鼠动脉组织中eNOS水平显著升高,表明芪参益气滴丸可以通过诱导eNOS分泌,促进NO的合成释放,降低血管内皮损伤,从而发挥对AS的保护作用。
综上所述,芪参益气滴丸可用通过调节脂质代谢以及抑制炎症反应,抑制AS的发展。此外,芪参益气滴丸可以通过下调TRPC1和STIM1的表达,降低SOCC介导的Ca2+内流,增加动脉组织eNOS表达,促进NO的合成释放,发挥AS保护作用。本研究结果明确了SOCC介导的Ca2+稳态在芪参益气滴丸抗AS中的作用机制,为揭示芪参益气滴丸在心血管疾病中的保护作用提供参考资料。
