CD163/TWEAK通路对动脉粥样硬化的作用*
2019-04-22苏柳杭陈炳秀李兆恺张翠侠梅万春江宏飞戴翠莲
苏柳杭, 陈炳秀, 李兆恺, 吴 尧, 张翠侠, 梅万春, 江宏飞, 王 焱, 戴翠莲
(厦门大学附属心血管病医院心内科, 福建 厦门 361004)
巨噬细胞在动脉粥样硬化的发生中起重要作用[1]。动脉粥样硬化的微环境促使巨噬细胞向不同亚型分化从而影响斑块的进展,但其中机制尚不完全清楚[2]。既往研究表明,动脉粥样硬化是辅助性T细胞(help T cells, Th)驱动的疾病,是由于脂质刺激所致1型巨噬细胞(type 1 macrophage,M1)产生的炎症反应[3];选择性激活的2型巨噬细胞(type 2 macrophage,M2)可通过促进炎症吸收和组织修复来平衡M1的致炎作用[4-5]。
CD163是特异表达于M2巨噬细胞的膜表面蛋白[6]。研究表明,CD163阳性M2可通过吞噬血红蛋白-触珠蛋白复合体(hemoglobin-haptoglobin complex,Hb-Hp)发挥抗炎作用[7];也有不同的研究结果发现CD163阳性巨噬细胞通过Hb-Hp/CD163/缺氧诱导因子1α(hypoxia-inducible factor-1α,HIF1α)途径,促进血管壁通透性增加和白细胞浸润[8],故目前CD163阳性巨噬细胞在动脉粥样硬化中的作用认识还不尽一致[9]。除Hb-Hp外,CD163还可与其选择性配体——肿瘤坏死因子样凋亡弱诱导因子(tumor necrosis factor-like weak inducer of apoptosis,TWEAK)结合,但CD163是否可通过调控TWEAK而发挥抗动脉粥样硬化作用还不清楚。本课题将对此问题进行探讨。
材 料 和 方 法
1 动物
8~10周的载脂蛋白E基因敲除(apolipoprotein E gene knockout,APOE-/-)及野生型(wild-type,WT)C57BL/6小鼠,雌雄各半,体重20~25 g,购于北京维通利华动物实验中心,许可证号SCXK(京)2011-0011,厦门大学实验动物中心提供SPF级饲养场所。所有动物实验程序符合美国国立卫生研究院(National Institutes of Health,NIH)实验动物治疗指南,并经厦门大学实验动物伦理委员会批准。
2 主要试剂及仪器
重组小鼠CD163蛋白(recombinant mouse CD163, rmCD163)购自R&D;氧化型低密度脂蛋白(oxidized low- density lipoprotein,ox-LDL)购自广州奕源生物科技有限公司;兔抗鼠TWEAK抗体、大鼠抗鼠CD68抗体、兔抗鼠CD163抗体、兔抗鼠诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)抗体和兔抗鼠核因子κB(nuclear factor-κB, NF-κB)抗体购自Abcam;油红O购自Sigma-Aldrich;VECTASTAIN®ABC试剂购自Vector;BCA蛋白浓度检测试剂盒购自北京索莱宝公司;高脂饲料购自Research Diet。激光共聚焦显微镜购自Leica;冰冻切片机购自Leica;蛋白转膜系统购自Bio-Rad。
3 主要方法
3.1动物实验分组 实验动物分为以下4组(n=10):APOE-/-+普食(normal diet, ND)组、APOE-/-+高脂饮食(western diet, WD)组、WT+ND组和WT+WD组。
3.2建立动脉粥样硬化模型 各组小鼠分别进行高脂或普食喂养,16周后测量血脂水平及进行主动脉油红O染色以确定动脉粥样硬化模型建立成功。具体如下:分别于实验前及喂养16周后眼球取血,甘油磷酸氧化酶-过氧化物酶法测总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)的水平,实验方法按照说明书操作。
3.3主动脉油红O染色 分离主动脉,4%多聚甲醛固定24 h后,置于100% 1,2-丙二醇溶液中平衡1 min,将主动脉置于新鲜配置的油红O中染色4 h,85% 1,2-丙二醇溶液中平衡后照相。使用ImageJ软件测量主动脉斑块面积与主动脉面积的比值。
3.4Western blot检测相关靶蛋白水平 分离小鼠主动脉并置入玻璃匀浆器中,加入RIPA蛋白裂解液+蛋白酶抑制剂+磷酸酶抑制剂配制的组织裂解液,在冰上研磨后离心取上清,-80 ℃保存用于进一步实验。将蛋白质用SDS-PAGE并转膜后,5%脱脂奶封闭液封闭1 h,加入兔抗鼠CD163抗体(1 ∶1 000)和兔抗鼠TWEAK抗体(1 ∶2 000)并4 ℃过夜,磷酸盐吐温缓冲液(phosphate-buffered saline+Tween 20,PBST)洗3次,每次5 min;予辣根过氧化物酶标记的山羊抗兔 II 抗(1 ∶10 000)孵育1 h,显影后成像并拍照,条带灰度分析由ImageJ软件进行,以β-actin作为内参照,计算目标条带灰度/β-actin条带灰度值。
3.5免疫组化染色 取APOE-/-小鼠主动脉瓣膜冰冻切片37 ℃过夜干燥;预冷丙酮处理后,Bioxall孵育10 min;加入Biotin后阻断血清封闭20 min;PBS洗3次,每次5 min,4 ℃湿盒中孵育兔抗鼠单克隆CD163(1 ∶ 200)或兔抗鼠多克隆TWEAK抗体(1∶ 200)过夜;PBS洗5次,每次5 min;稀释的生物素化 II 抗孵育30 min,VECTASTAIN®ABC孵育30 min;加入过氧化物酶底物,苏木精染核60 s,自来水冲洗后置于1%盐酸乙醇中分化至核呈蓝色;使用奥林巴斯倒置显微镜下200倍和400倍高倍照相。
3.6巨噬细胞的分离与培养 于APOE-/-小鼠腹腔注射3%巯基乙醇酸溶液,72 h后于腹腔注射10 mL PBS,收集腹腔细胞,800 r/min离心10 min后弃上清;加入1 mL DMEM重悬细胞沉淀(5%胎牛血清+1%青、链霉素),计数后以1.5×109/L(细胞培养)或5×108/L(激光共聚焦显微镜)的细胞密度铺12孔板,2 h后更换培养基,继续稳定24 h后进行以下实验。
3.7rmCD163诱导巨噬细胞并行Western blot检测相关靶蛋白水平 稳定24 h后的巨噬细胞分为2组,一组加入rmCD163蛋白(0.5 mg/L)刺激细胞,另一组则加入CD163 siRNA、同型对照(isotype control)或空白对照(medium)刺激巨噬细胞作为对照,刺激48 h 后弃上清,以RIPA+苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF)+磷酸酶抑制剂配制裂解液加入细胞培养板中,充分裂解后移入离心管中,细胞超声仪充分裂解后离心取上清,-80 ℃保存蛋白质。将蛋白质SDS-PAGE分离并转膜后,5%脱脂奶封闭液封闭1 h,加入兔抗鼠TWEAK抗体(1 ∶1 000)、兔抗鼠CD163抗体(1∶1 000)、兔抗鼠NF-κB抗体(1∶1 000)和鼠抗鼠β-actin抗体(1∶1 000)4 ℃过夜,PBST洗3次,每次5 min;予辣根过氧化物酶标记的兔及鼠 II 抗(1∶10 000)孵育1 h,显影后成像并拍照,条带灰度分析由ImageJ软件进行,以β-actin作为内参照,计算目标条带灰度与β-actin条带灰度比值。
3.8诱导并使用rmCD163蛋白刺激泡沫细胞,Western blot检测相关靶蛋白 在稳定24 h后的腹腔巨噬细胞中加入无血清DMEM配制的ox-LDL(100 mg/L),刺激48 h后成为泡沫细胞,并分别用rmCD163蛋白及其对照刺激后弃上清,收集细胞并提取蛋白质行Western blot,方法同3.7。
3.9激光共聚焦显微镜观察 将腹腔细胞用多聚甲醛固定 30 min后,用含10%山羊血清的PBS封闭1 h 后, 兔抗鼠CD163抗体(1∶100)、大鼠抗鼠CD68抗体(1∶100)和兔抗鼠iNOS抗体(1∶200)4 ℃孵育过夜;PBS洗涤3次,每次5 min;室温孵育山羊抗大鼠荧光 II 抗(1∶200)和山羊抗兔荧光 II 抗(1∶200)1 h;二脒基苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)1 μL+5 mL PBS染核15 min;PBS洗涤3次,每次10 min;激光共聚焦显微镜拍照。
4 统计学处理
数据均采用GraphPad Prism 6软件进行统计分析。所有实验重复3次。两组间数据统计采用t检验,多组间数据统计采用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 动脉粥样硬化模型构建成功
与WT+ND和WT+WD小鼠相比,APOE-/-+ND和APOE-/-+WD小鼠的总胆固醇水平、甘油三酯水平及低密度脂蛋白胆固醇水平均显著增高(P<0.01),高密度脂蛋白胆固醇显著降低(P<0.01),但上述指标在APOE-/-+ND组和APOE-/-+WD组之间无显著差异,见图1A~D。与WT+ND组和WT+WD组相比,无论是主动脉斑块面积/主动脉面积还是主动脉弓斑块面积/主动脉弓面积,APOE-/-+ND 组和APOE-/-+WD组均显著增加(P<0.01),见图1E~G。上述结果说明动脉粥样硬化模型构建成功。
2 各组主动脉相关蛋白表达
与野生型小鼠相比,无论是高脂喂养还是普食喂养,APOE-/-小鼠主动脉CD163的表达水平显著增加(P<0.05),与之相对应的是,APOE-/-小鼠其主动脉中TWEAK表达水平较野生型小鼠亦显著升高(P<0.05),见图2。
3 小鼠主动脉斑块CD163与TWEAK的免疫组化染色
取主动脉斑块进行免疫组化染色,结果显示,在动脉粥样硬化斑块的肩部及远离脂质核心的部位可见CD163阳性表达巨噬细胞,而在动脉粥样硬化斑块的脂质核心部位,CD163阳性巨噬细胞数量显著减少。TWEAK染色结果显示,在动脉粥样硬化斑块的所有部位,包括肩部和脂质核心部位均可见TWEAK阳性细胞,见图3。
4 激光共聚焦扫描显微镜证明从腹腔获得的细胞为巨噬细胞
以CD68作为巨噬细胞标志物,将从腹腔提取的巨噬细胞进行激光共聚焦显微镜检测,结果显示CD68阳性表达,iNOS阳性表达,CD163阴性表达,说明提取细胞均为巨噬细胞,且均为M1,见图4。
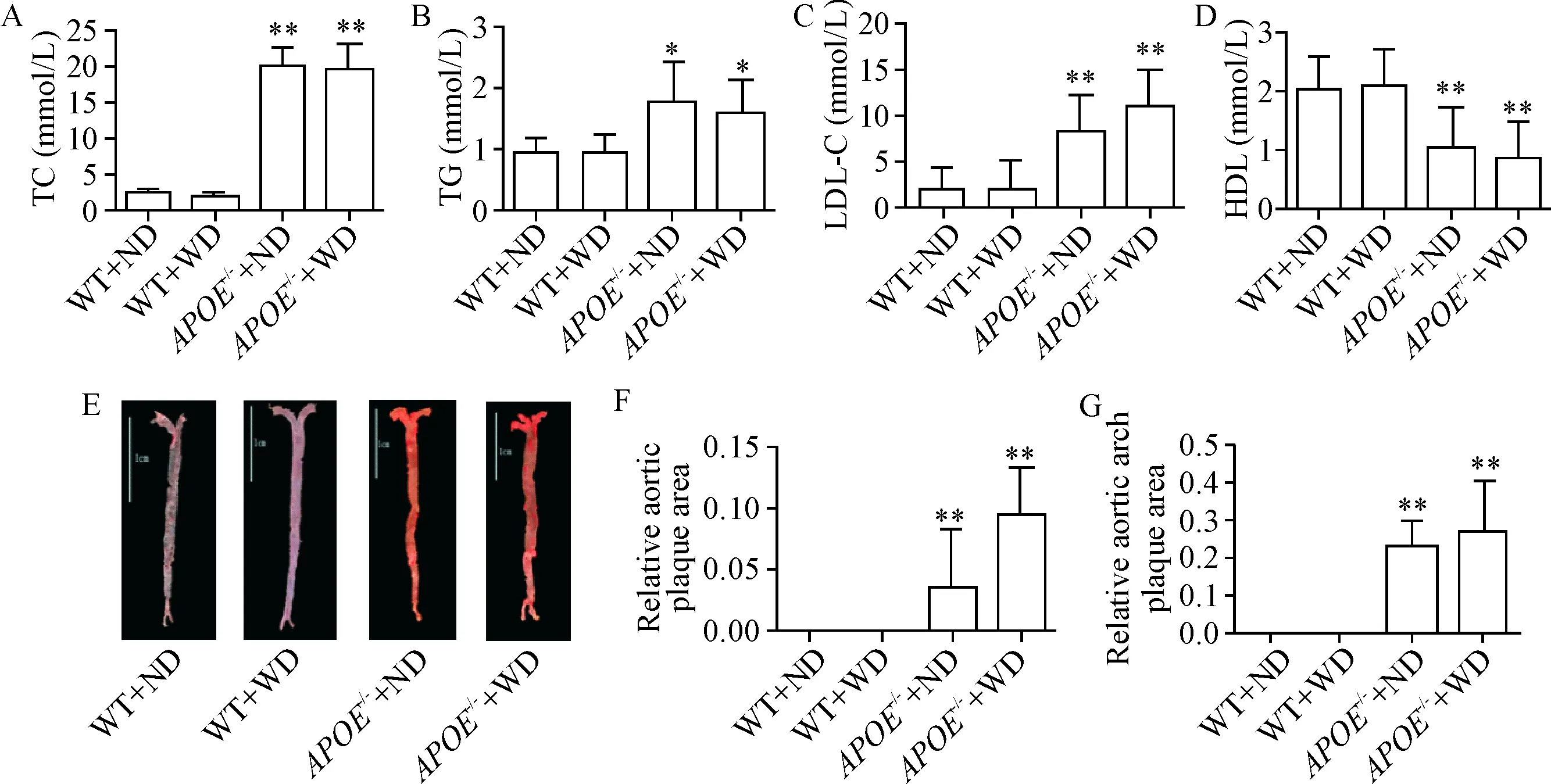
Figure 1.The plasma lipid levels and atherosclerotic plaque size in the mouse aorta. A: TC level; B: TG level; C: LDL-C level; D: HDL-C level; E: oil red O staining in each group (scale bar=1 cm); F: aortic plaque size; G: aortic arch plaque area. Mean±SD.n=10.*P<0.05,**P<0.01vsWT+WD group.
图1各组小鼠血脂水平及动脉粥样硬化斑块面积
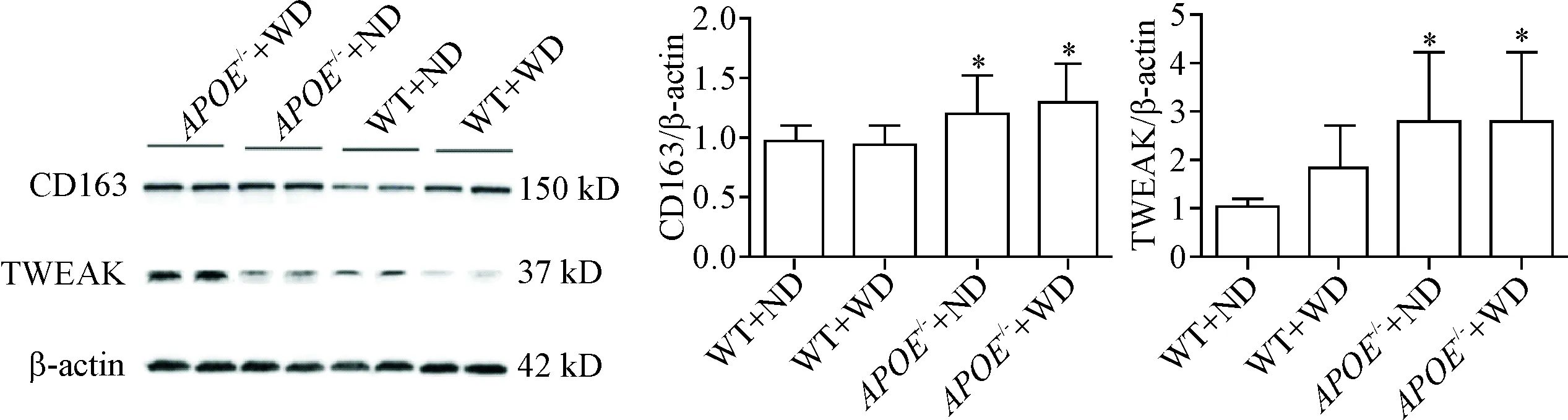
Figure 2.CD163 and TWEAK protein expression in the aorta of each group. Mean±SD.n=10.*P<0.05vsWT+ND group.
图2主动脉CD163及TWEAK的表达水平
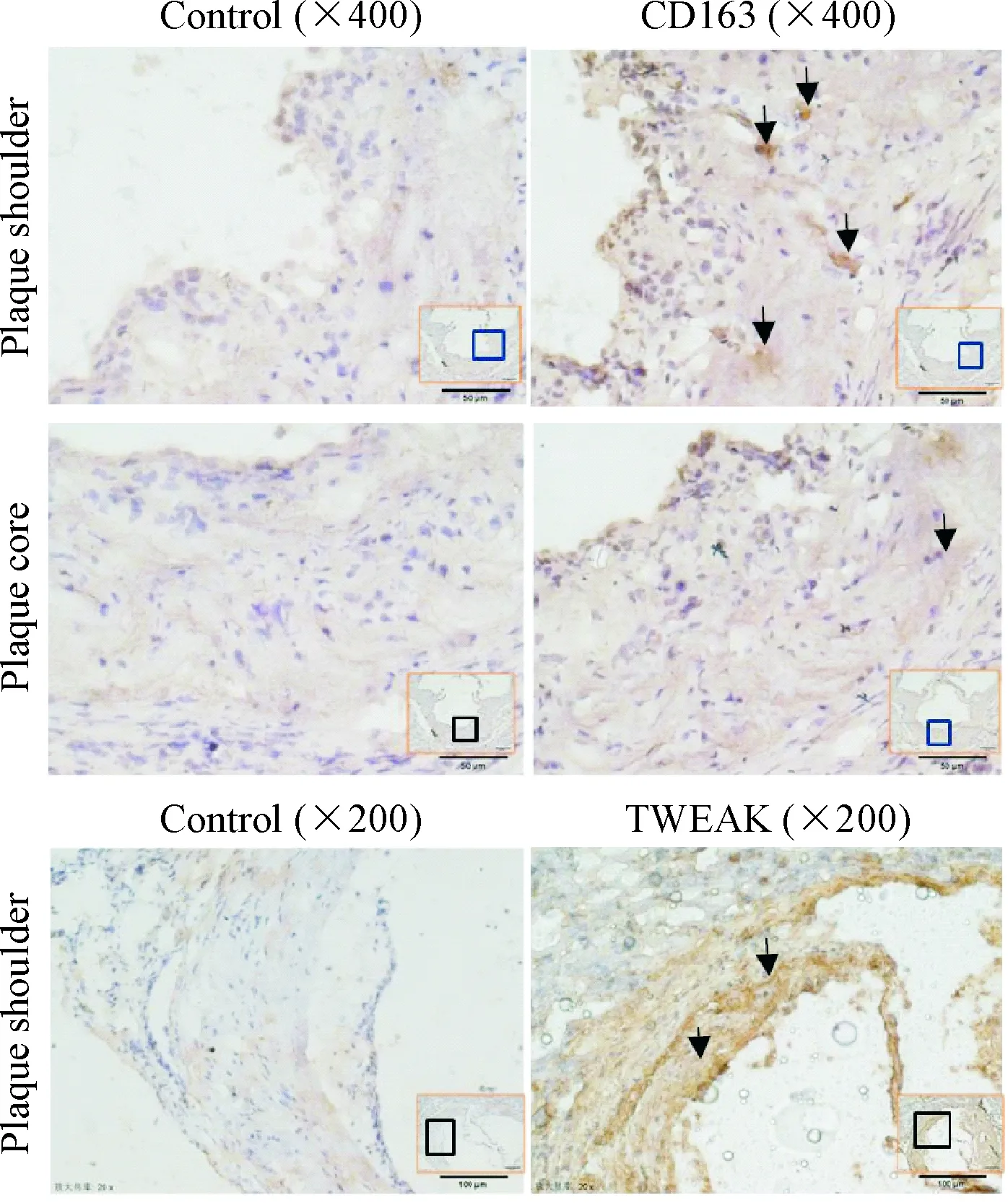
Figure 3.Immunohistochemical staining of aortic atherosclerotic plaques. The arrows indicate positive cells.
图3各组小鼠主动脉免疫组化结果
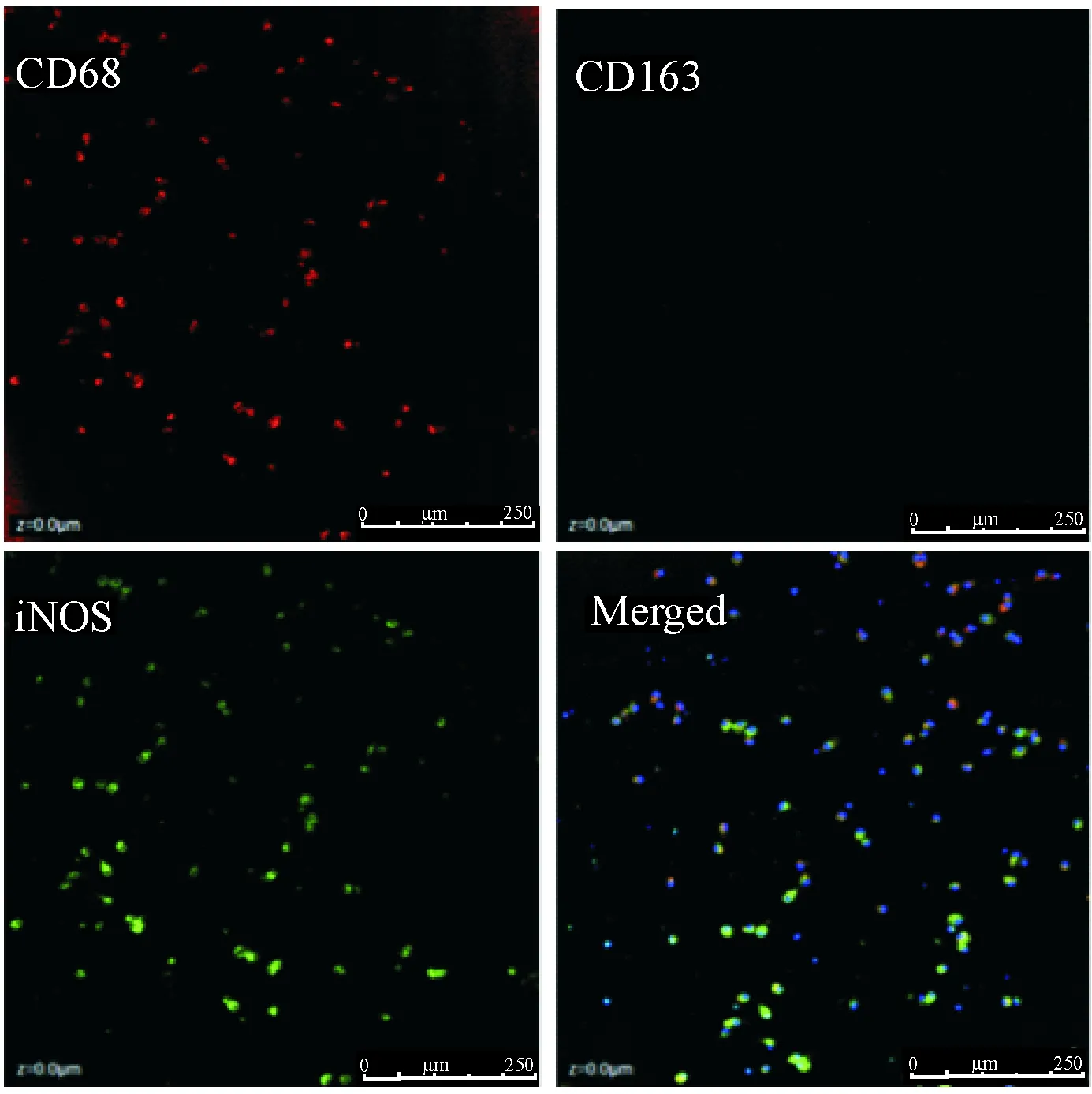
Figure 4.Confocal microscopic observation of mercaptoethanol- induced macrophages fromAPOE-/-mice. CD68 was macrophage marker, CD163 was M2 macrophage marker, and iNOS was M1 macrophage marker.The scale bar=250 μm.
图4腹腔细胞免疫荧光标志的激光共聚焦显微镜观察
5 腹腔巨噬细胞CD163及TWEAK的蛋白表达水平
Western blot结果显示,腹腔巨噬细胞不表达CD163,即为M1,但可见TWEAK条带,说明M1表达TWEAK;当用外源性重组CD163刺激M1,则TWEAK的蛋白表达水平显著降低(P<0.05),见图5A。
6 CD163通过下调TWEAK水平抑制NF-κB表达
为研究CD163/TWEAK的下游作用途径,我们进一步检测了M1巨噬细胞及泡沫细胞中CD163、TWEAK及TWEAK的下游作用靶点NF-κB的蛋白质表达水平,结果显示在CD163刺激组,无论是M1巨噬细胞还是泡沫细胞,TWEAK及NF-κB蛋白质表达显著受到抑制(P<0.05,P<0.01),见图5B。
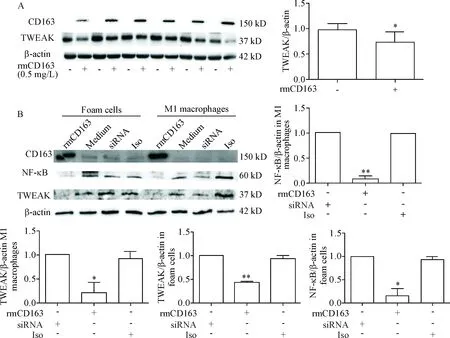
Figure 5. The protein levels of TWEAK and NF-κB in M1 macrophages and foam cells were detected by Western blot.A: the protein level of TWEAK in the M1 macrophages induced by rmCD163; B: the TWEAK and NF-κB protein levels in M1 macrophage and foam cells induced by rmCD163,CD163 siRNA and isotype (Iso). Mean±SD.n=6.*P<0.05,**P<0.01vssiRNA and Iso groups.
图5CD163对M1型巨噬细胞及泡沫细胞TWEAK及NF-κB的调节作用检测
讨 论
现有的研究已证明,炎症参与冠心病事件链的全程,在冠心病标准治疗的基础上,用IL-1β单克隆抗体抗炎治疗,可将心肌梗死患者一年后心血管事件的残余风险[10]进一步降低15%[11],5年心血管事件的风险进一步下降20%[12],故炎症损伤对心血管预后具有重要作用。本研究着重于巨噬细胞相关的炎症调节通路在动脉粥样硬化发生中的作用探讨。
1 CD163及TWEAK在小鼠动脉粥样硬化中的表达变化
CD163特异表达于单核-巨噬细胞表面,作为血红蛋白清道夫受体而被认识[13-14],被认为具有抗炎及抗动脉粥样硬化作用。新近研究发现TWEAK具有致动脉粥样硬化作用,下调TWEAK水平,动脉粥样硬化斑块面积显著减少[15]。由于TWEAK与Hb-Hp在分子结构上存在相似区域,且与CD163之间存在多个相同的作用位点[16-17],故本实验首先在动脉粥样硬化模型上研究CD163及TWEAK的表达水平及其空间分布特征。结果发现,与野生型小鼠相比,无论是高脂饮食还是普食喂养的APOE-/-小鼠,其主动脉CD163及TWEAK的蛋白表达水平均显著增加,即动脉粥样硬化的微环境可能同时刺激了组织巨噬细胞CD163及TWEAK的表达。但二者在动脉粥样硬化斑块中共存的意义何在,是发挥抗炎还是致动脉粥样硬化作用目前还不清楚。已有研究表明,一方面TWEAK可通过增加基质金属蛋白酶水平以降解细胞外基质降解酶,减少斑块的稳定性[18],另一方面在APOE-/-小鼠中,TWEAK参与了血管重塑、血管的炎症反应并增加动脉粥样硬化损伤面积[19],现有多项研究证明CD163具有抗动脉粥样硬化作用,但作为TWEAK的选择性配体[20],CD163表达水平增高可否下调TWEAK表达,发挥抗动脉粥样硬化作用[21]尚需进一步证明。
为了探究此问题,我们对动脉粥样硬化斑块进行了免疫组化染色,结果发现在动脉粥样硬化斑块内均可见CD163与TWEAK阳性表达,这与Western blot结果一致,另外CD163阳性巨噬细胞多存在于动脉粥样硬化斑块远离脂质核心的部位,而无论在脂质核心还是肩部均可见TWEAK的强阳性表达,TWEAK表达于整个动脉粥样硬化斑块中,故猜测,动脉粥样硬化的微环境可刺激巨噬细胞上调CD163及TWEAK的水平。由于CD163多表达于斑块稳定部位,故二者的上调可能具有不同的意义,例如预示着通过上调CD163来下调TWEAK的表达或内吞TWEAK,发挥稳定斑块的作用。
2 CD163下调巨噬细胞及泡沫细胞TWEAK的蛋白表达
为进一步研究CD163可否调节TWEAK的表达,课题组收集APOE-/-小鼠腹腔巨噬细胞,经激光共聚焦显微镜证实为M1(M1标志物iNOS的表达阳性),并诱导成为泡沫细胞后,我们同时检测了M1和泡沫细胞CD163和TWEAK的蛋白表达水平,结果显示M1及泡沫细胞不表达CD163,但表达TWEAK;在加入外源性重组CD163后,TWEAK的蛋白水平在二者中均显著受到抑制。本细胞实验证明CD163可显著下调M1和泡沫细胞中TWEAK的蛋白水平,且首次证明泡沫细胞为M1源性,推测CD163下调TWEAK水平可能与抑制M1介导的炎症反应[22]有关。
3 CD163通过抑制TWEAK表达下调NF-κB水平
既往研究显示,TWEAK可能通过激活经典NF-κB途径[23]、激活MAKP途径[24]、上调血管细胞黏附分子1(vascular adhesion molecule 1, VCAM-1)和细胞间黏附分子1(intercellular adhesion molecule-1,ICAM-1)[25]及增加基质金属蛋白酶9(matrix metalloprotein, MMP-9)的表达和活性[15]而促进炎症反应。为了研究CD163/TWEAK的下游作用途径,我们检测了M1及泡沫细胞中NF-κB的表达情况,结果再次显示,无论是M1还是泡沫细胞,CD163能够显著抑制TWEAK的表达,而且,也显著下调了TWEAK下游的炎症因子NF-κB的蛋白水平,故证明在动脉粥样硬化的微环境中,CD163可通过作用于TWEAK而抑制NF-κB的水平,可能发挥抗动脉粥样硬化作用。
本研究结果发现,在动脉粥样硬化的微环境中,CD163及其配体TWEAK的蛋白水平显著增加。CD163阳性巨噬细胞主要存在于斑块中远离脂质核心的部位,并可能通过抑制TWEAK/NF-κB信号途径发挥抗动脉粥样硬化作用。
