CB1受体通过钾离子通道介导外周镇痛作用*
2019-04-22李永丰刘一辉
李永丰, 任 维, 刘一辉
(陕西师范大学现代教学技术教育部重点实验室, 陕西 西安 710062)
神经病理性疼痛是由躯体感觉神经系统的损伤或疾病直接造成的病理性疼痛[1],机械触诱发痛和痛觉过敏是主要的临床特征性表现[2]。神经病理性疼痛在普通人群中发病率为3.3%~8.2%,且病痛时期长,给患者带来严重的经济负担和心理应激[3]。近年来研究者对疼痛做了深入的研究,但外周损伤引起的神经病理性疼痛研究较少,尤其是外周神经系统和运动功能密切相关,疼痛经常使患者丧失劳动力,因此对外周镇痛系统的研究非常重要。
大麻素(cannabinoids,CB)具有强烈的镇痛作用,主要通过激活CB1或CB2受体等发挥作用,其中CB1受体广泛表达在中枢神经系统(central nervous system,CNS)和外周神经系统(peripheral nervous system,PNS),尤其是感觉神经纤维上[4],同时CB1受体也表达于外周的组织中[5]。临床研究证明激活CB1受体具有显著镇痛作用[6],但由于大麻是精神类成瘾药物,所以其使用受限[7]。不跨越血脑屏障而在外周损伤区局部注射CB1受体的激动剂也表现出强烈的镇痛作用[8]。然而关于CB1受体在外周损伤区的镇痛机制,目前还未见相关报道。
坐骨神经慢性压迫损伤(chronic constriction injury,CCI)模型[9]是一个经典的神经病理性疼痛模型。该模型产生疼痛的主要原因是物质的运输及代谢途径受到影响,损伤区近端的终球处聚集多种离子通道,形成神经瘤(起步点),使得终球膜结构异于正常的神经纤维膜而表现出超常的兴奋性,产生节律丰富的自发放电,表现出痛觉过敏、痛觉异常、持续性疼痛等症状。这些症状的出现与损伤区自发放电密切相关。初级感觉神经元产生自发放电即异位冲动,不仅是早期急性痛的重要原因,并且这些异位放电不断轰击脊髓背角等中枢部位,诱发产生脊髓背角长时程增强(long-term potentiation,LTP)等中枢敏化现象[10]。中枢敏化和下行易化系统的激活在神经病理疼痛后期维持中起到重要作用[11],因此对起步点的研究十分重要。钾离子通道在调节细胞(尤其是末梢神经细胞)的膜电位和兴奋性中起着重要作用,其结构或功能状态与起步点的形成以及疼痛的发生和发展有密切的关系[12]。在背根神经节(dorsal root ganglia,DRG)中CB1受体和KV1.4在伤害性感受器神经元上几乎完全重叠,表明CB1受体和KV1.4的功能之间存在紧密的联系。内源性大麻素直接参与钾离子活动的调节[13],内源性大麻素发挥作用与钾离子之间存在密切的关系[14],均说明CB1受体发挥作用与钾离子通道密切相关。本研究探讨CB1受体激活在外周发挥的镇痛作用是否与钾通道有关,以便进一步了解CB1受体在外周损伤区的镇痛机制。
材 料 和 方 法
1 实验材料及主要仪器
成年C57BL/6J 小鼠(8~16周,体重约23~30 g)由陕西师范大学现代教学技术教育部重点实验室SPF级清洁动物房提供,购自西安交通大学动物中心,许可证编号为SCXK(陕)2012-003。CB1受体特异性激动剂HU-210和CB1受体特异性拮抗剂AM281(USA);抗CB1抗体(ab23703,0.5 mg/L;Abcam);钾通道非特异性阻断剂四乙铵(tetraethylammonium,TEA;Sigma)。人工脑脊液(artificial cerebrospinal fluid,ACSF):NaCl 150 mmol/L、KCl 5 mmol/L、MgCl21 mmol/L、CaCl21.2 mmol/L和HEPES 10 mmol/L,以上药品溶于三蒸水后,用1 mol/L的NaOH或HCl调节pH至7.35~7.45。局部注射HU210或AM281均按照2 (dimethyl sulfoxide, DMSO) ∶1(Tween-80)∶37(0.9%saline)进行稀释;TEA用0.9%的生理盐水进行稀释;灌流HU210或AM281溶于DMSO中配成母液,用ACSF稀释成HU210(1 mmol/L)和AM281(10 mmol/L)最终灌流液;TEA用ACSF稀释成TEA(10 mmol/L)最终灌流液。
2 方法
2.1慢性神经病理性疼痛模型的建立 参照文献报道的方法[9],建立慢性神经病理性疼痛模型:用戊巴比妥钠(40 mg/kg)腹腔注射C57BL/6J小鼠进行麻醉后,暴露左侧坐骨神经主干,用鼠尾胶原纤维(约同5#羊肠线直径)从坐骨神经中枢端到外周端依次轻度结扎打3个结,结扎环间0.1 mm,结扎松紧程度以左后肢出现轻微收缩为宜,对坐骨神经形成区段性损伤。假手术:只暴露出坐骨神经不结扎,其余步骤和建模完全一致。
2.2机械痛阈值(mechanical withdrawal threshold,MWT)的测定 术后3、5、7、9、11、13、15、17、19和21 d以及给药前后进行测试,将小鼠放入底为铁丝网的不透明有机玻璃箱(45 cm×20 cm×25 cm)内,让小鼠在此环境适应 30 min ,待小鼠的梳理和探究活动基本消失后,用von Frey垂直刺激小鼠左后肢足底中部,持续加力,记录能引起左后肢产生缩足反应的力,重复2~3次。
2.3热缩腿反射潜伏期(thermal withdrawal latency,TWL)的测定 术后3、5、7、9、11、13、15、17、19和21 d以及给药前后进行测试,将小鼠置于底为3 mm厚玻璃板的不透明有机玻璃箱 (45 cm×20 cm×25 cm) 中,使其适应30 min,待小鼠的梳理和探究活动基本消失后,热刺激痛觉测试仪照射小鼠左后肢足底中部(落在足底的光斑直径约为3 mm),记录从照射开始至小鼠出现抬腿回避时间即为TWL,照射时间不超过 30 s,以防小鼠足底灼伤。每只小鼠测量3 次,对侧间隔 5 min,去掉最大和最小值,计算3 次 TWL 的平均值。
2.4Western blot测定小鼠坐骨神经中CB1受体(CB1 receptor,CB1R)蛋白的表达 小鼠完成痛阈测定后处死,取损伤区坐骨神经,提取总蛋白溶液,进行SDS-PAGE将蛋白半干转至PVDF膜上(电压13 V,1.5 h),5%牛奶封闭1 h后加入抗CB1 R抗体(1∶500),4 ℃过夜,洗膜后再用HRP标记的山羊抗兔IgG杂交, 室温2 h。最后加入ECL试剂反应1~2 min显像,用扫描仪行蛋白条带扫描并进行蛋白条带半定量分析。以CB1R和β-actin的比值作为表达强度。
2.5单纤维放电频率变化的检测 手术后7~16 d,乌拉坦腹腔注射麻醉小鼠,再次将损伤区域暴露,去除结扎线、游离损伤区段的坐骨神经,用34~35 ℃正常灌流液浸浴损伤区域。在距离损伤区域约8 mm的中枢端处另行切口,暴露出一段正常未受损伤的坐骨神经,再用34~35 ℃温热石蜡油浸浴正常区段的神经,在显微镜下分离出中枢端神经细束,切断它与外周感觉输入的联系,使其仅与损伤区域相连。将分离出的神经细束放于铂金丝引导电极上,用Chart 5.5软件观察并记录神经细束的自发放电情况[15],计算神经传导速度以对神经纤维进行分类。速度大于2 m/s为A类神经元,小于2 m/s为C类神经元[15]。若出现了单个A纤维放电则进行记录保存。神经电活动信号经Power Lab系统放大、采集之后输入计算机系统,采样频率是10 kHz。顺序记录相邻动作电位峰峰间期时间间隔,获得神经自发放电峰峰间期(inter-spike interval)序列,所得数据用Origin软件分析并作相应的时间序列图等。实验中利用HU210、AM281和TEA替换正常灌流液灌流损伤区,分别记录放电的频率变化。
3 统计学处理
采用SPSS 20.0处理。实验数据以均数±标准差(mean±SD)或均数±标准误(means±SEM)表示。组间差异检验用单因素方差分析(one-way ANOVA)或重复测量方差分析(repeated measure ANOVA),组间多重比较行LSD-t检验。以P<0.05为差异具有统计学意义。
结 果
1 坐骨神经损伤区CB1受体伴随疼痛阈值的降低而升高
与假手术(sham)组相比,CCI组小鼠痛阈显著降低,术后14 d MWT和TWL均降至最低(P<0.01),见图1A、B。Western blot结果表明,损伤区CB1受体的表达水平于术后4 d显著升高(P<0.01),并于7、11和14 d保持较高水平,与手术前(0 d)相比较差异有统计学意义(P<0.05),见图1C。
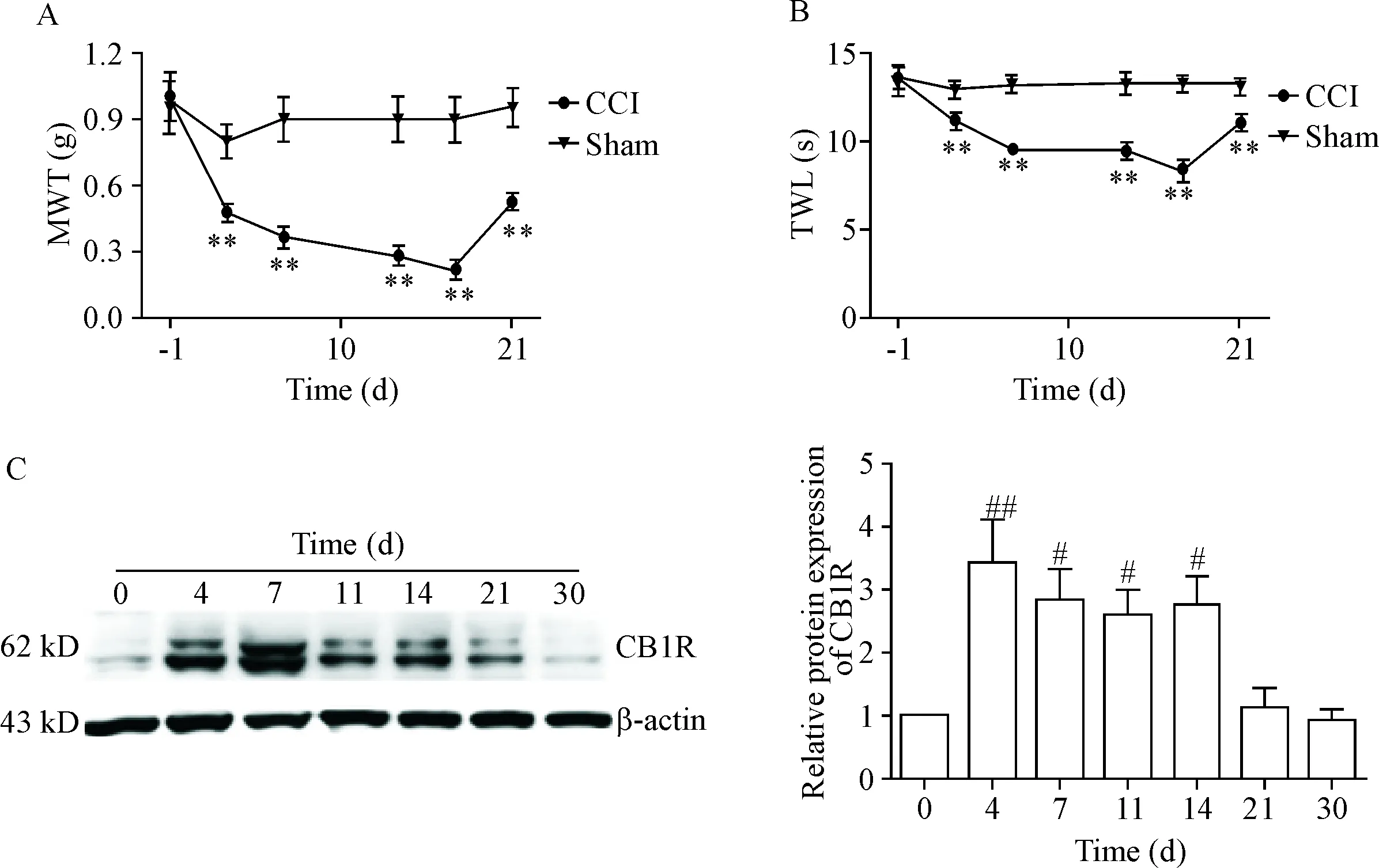
Figure 1.The changes of pain threshold and CB1 receptor (CB1R) expression in the injured area of the mice with chronic constriction injury (CCI). A: the mechanical withdrawal threshold (MWT) after von Frey test; B: the thermal withdrawal latency (TWL) after plantar test (Hargreaves method); C: the protein levels of CB1R detected by Western blot. Mean±SD.n=8 in A and B;n=4 in C.**P<0.01vssham group;#P<0.05,##P<0.01vs0 d.
图1CCI小鼠疼痛阈值和损伤区CB1受体蛋白表达水平的变化
2 坐骨神经损伤区定位注射TEA显著地抑制CB1受体的镇痛作用
在术后11~14 d之间分别给损伤区定位注射HU210(5 μg/kg)后,MWT在30和60 min,TWL在30、60 和130 min均显著升高,见图2A~D;与HU210组相比,定位注射AM281(1 mg/kg)能够抑制HU210的镇痛作用,见图2A、B;与HU210组相比,损伤区预先注射TEA(10 ng)亦能够显著抑制HU210的镇痛作用,见图2C、D。

Figure 2.The analgesic effect CB1 receptor agonist HU210 was inhibited by CB1 receptor antagonist AM281 (A, B) or potassium channel non-specific blocker TEA (C, D). A, C: the mechanical withdrawal threshold (MWT) after von Frey test; B, D: the thermal withdrawal latency (TWL) after plantar test (Hargreaves method). Mean±SEM.n=6.*P<0.05,**P<0.01vsvehicle group.
图2外周损伤区CB1受体激活具有镇痛作用,AM281或TEA能阻断这种作用
3 HU210能够显著降低起步点自发放电的频率,AM281抑制其作用
记录到自发放电的A类纤维后选取100 s稳定状态,在灌流槽中先后灌入vehicle,记录HU210对自发放电频数变化的影响,观察到HU210(100 nmol/L)能显著降低每秒自发放电的个数(P<0.01),见图3A。在灌流槽中先灌入AM281(9 nmol/L) 之后灌入HU210 能显著抑制HU210使放电频率降低的作用,见图3B。

Figure 3.Perfusion of HU210 in the injured area reduced the spontaneous ectopic discharge frequency of the injured nerve fibers (A), but AM281 (perfused about 20 min before HU210 administration) blocked this effect (B). Mean±SD.n=8 in A;n=6 in B.**P<0.01vsvehicle group.
图3损伤区CB1受体激活抑制起步点自发放电活动,AM281能阻断这种作用
4 TEA抑制HU210使起步点自发放电频率降低的作用
同上述实验方法,在损伤区灌流槽中分别灌入vehicle,观察起步点放电频率不变;之后灌入TEA阻断钾通道,观察到与溶剂组相比放电频率增加(P<0.01);之后灌入TEA+HU210,与TEA组相比无显著性差异,放电频率没有降低,但与vehicle组相比放电频率显著降低(P<0.01),见图4。这表明当钾通道被阻断之后,HU210激活CB1受体而抑制起步点自发放电的作用被抑制。

Figure 4.Perfusion of TEA increased the spontaneous discharge frequency in the injured area, and suppressed the inhibitory effect of HU210 on the spontaneous discharge frequency. A: statistical analysis of the firing frequency; B: the spike patterns of ectopic neuronal discharge; C: the representative spontaneous discharge state in a single nerve fiber. Mean±SD.n=8.**P<0.01vsvehicle group.
图4TEA抑制CB1受体激活引起的起步点自发放电频率降低的作用
讨 论
阿片类被广泛应用于慢性疼痛症的临床治疗,但长期使用会伴随副作用,严重影响患者的生活质量,导致使用量减少,甚至拒绝使用;近年来,大麻素已成为阿片类药物治疗慢性疼痛的替代品[16],其镇痛机制也成为研究的热点。本研究发现手术后第4天的疼痛阈值与假手术组相比出现了差异,且随着疼痛阈值的降低损伤区的CB1受体至第21天均显示出表达增加;损伤区定位注射CB1受体激动剂HU210具有显著的镇痛作用,CB1受体的特异性拮抗剂AM281能够阻断其作用,同时预先注射TEA也能阻断HU210的镇痛作用;单纤维自发放电的记录中发现HU210能够使放电的频率降低,而AM281能够抑制这种作用,同时TEA也阻断了此作用。上述结果提示钾通道介导了HU210的镇痛作用,且其效应部位在外周损伤区。
CB1受体是7次跨膜的G蛋白偶联受体[17],广泛表达于外周神经系统。在CCI大鼠模型中,同侧脊髓后角浅层CB1受体表达上调,激活CB1受体能够抑制热痛敏和机械触诱发痛[18]。外周初级感觉神经元轴突上CB1受体激活,能够对躯体、内脏疼痛以及炎症性和神经性疼痛产生镇痛作用[8]。本研究观察到小鼠CCI手术后,损伤区CB1受体的表达上调与脊髓后角浅层CB1受体表达上调结果相呼应,并且观察到随着疼痛阈值的降低,坐骨神经损伤区CB1受体表达升高呈现动态变化的趋势。在外周损伤区由于可使用技术有限,因此CB1受体的镇痛机制还未完全清楚,但在本研究中利用分离小鼠坐骨神经单纤维,可对起步点进行深入的研究,观察到CB1受体激活能够显著抑制损伤区的自发放电频率,CB1受体特异性的拮抗剂可阻止这种抑制作用。CB1受体激活后,促进G蛋白门控型内向钾通道开放,产生外向钾离子电流,使细胞超极化[19],同时当神经冲动再次达到突触前神经元后,钙离子内流减少,钾离子外流增加,突触前神经元去极化幅度降低,对突触前神经元释放兴奋性抑制性神经递质产生抑制作用[20],对其它离子通道也具有调节作用[21]。起步点是形成疼痛的主要原因,提示CB1受体的镇痛作用可能是参与抑制起步点的自发放电,与本文研究结果一致。
钾离子通道依据其性质主要分为以下几种。(1)电压门控性钾离子通道(voltage-gated K+channels,KV)[22]。KV1.1功能丧失会降低机械和热痛敏的反应[22];KV1.2的活动抑制会降低机械和冷痛敏阈值[23]。(2)钙激活钾离子通道(Ca2+-activated K+channels,KCa;一种特殊离子通道,受胞内游离钙离子调控)。钙离子进入胞内引起级联反应,增加胞内钙离子浓度,而钾离子外流,细胞膜电位复极化,影响放电产生、维持及其频率变化。根据电导的大小可以分为小电导钾离子通道(small conductance,SK)、中电导钾离子通道(intermediate conductance,IK)和大电导钾离子通道(big conductance,BK)。BK主要参与快速后超极化电流的形成,抑制了神经元冲动的发放[24],并且在痛感受器上TRPV1与BK共存[25]。SK通道调节中等后超极化电流和慢速后超极化电流,降低神经元兴奋性,限制神经元的放电频率,产生放电频率适应[26],在疼痛的缓解中发挥重要的作用。(3)初级感觉神经元表达的双孔域钾离子通道(two-pore-domain K+channels,K2P)多达15种亚型,并且与缓解疼痛有关[27],其中敲除TWIK1(two-pore weak inwardly-rectifying K+channel 1)能够显著增加机械和热痛的阈值[28]。(4)G蛋白偶联的内向性整流型钾离子通道2(G protein-coupled inwardly-rectifying K+channel 2,GIRK2)表达在感觉神经元上参与阿片类的镇痛调节;ATP 敏感的钾离子通道(ATP-sensitive K+channels,KATP)对炎症反应引起的疼痛具有显著的镇痛作用[29]。多种亚型的钾离子通道均参与外周疼痛的形成或镇痛。坐骨神经损伤诱发起步点放电异常,CB1受体激活显著抑制放电活动水平,阻断钾离子通道能够阻断这种抑制作用,提示钾离子通道介导了CB1受体激活在外周的镇痛作用,但具体是那种类型还需要进一步探究。
本研究在小鼠慢性压迫损伤模型基础上,外周损伤区定位给药,并用在体单纤维技术观察CB1受体激活对A类神经元自发放电的影响,探讨CB1受体在外周的镇痛作用,可能是通过钾离子通道起作用,为进一步深入研究CB1受体的外周镇痛作用提供依据,为新型大麻类镇痛剂的研发提供参考。
