抗结核药物及其耐药相关突变位点的研究进展
2019-04-22陈昕昶陈嘉臻张文宏
陈昕昶,陈嘉臻,张文宏
复旦大学附属华山医院感染科,上海 200040
结核病是由结核分枝杆菌复合物引起的传染性疾病,其致死率、致残率高,在全球传染病中居第2位,仅次于艾滋病。2015年,全球估计新发结核病约 1 040 万例,其中新发耐多药结核病(multidrug-resistant tuberculosis,MDR-TB)48万例,但不足20%的患者登记接受诊疗[1],这不仅会导致治疗失败,还可能引起耐药菌株传播。因此,耐药结核病的诊断仍面临巨大挑战,目前不仅需完成结核病的早期诊断,更需快速、全面的耐药诊断。
传统的结核病诊断方法包括镜检、培养等,而耐药诊断必须基于培养,受限于技术、人员、基础设施,且周期长,极易延误治疗时机。此外,很多药物的表型药敏试验(drug susceptibility testing,DST)重复性差,部分二线药物缺乏标准化的DST[2]。
目前,世界卫生组织(World Health Organization,WHO)认可的MDR-TB商业分子检测试剂盒有Xpert MTB/RIF(Cepheid,USA)、GenoType MTBDRplus和GenoType MTBDRsI (Hain Lifescience GmbH,Germany),分别可检测利福平(rifampicin,RFP)、异烟肼(isoniazid,INH)、氟喹诺酮类(fluoroquinolones)及二线注射类抗结核药物的耐药。这些方法简单易行,不依赖培养,且灵敏度、特异度较高,已得到较广泛的应用[3-4]。但现有分子检测方法仅能检测小部分抗结核药物的耐药情况,且尚无其他二线药物的耐药信息,导致DST结果出来前无法给予最佳治疗,或出现不良反应后无法根据药敏结果调整方案,从而无法满足临床需求。
确定抗结核药物耐药基因及突变位点是耐药诊断、临床用药指导、新药研发及耐药机制进一步研究的基础,本文对多种抗结核药物及其耐药相关基因、突变位点的研究进展进行了总结,详见表1。
表1抗结核药物常见耐药相关基因及其功能
Tab.1Resistance-relatedgenesandtheirfunctionsinanti-tuberculosisdrugs
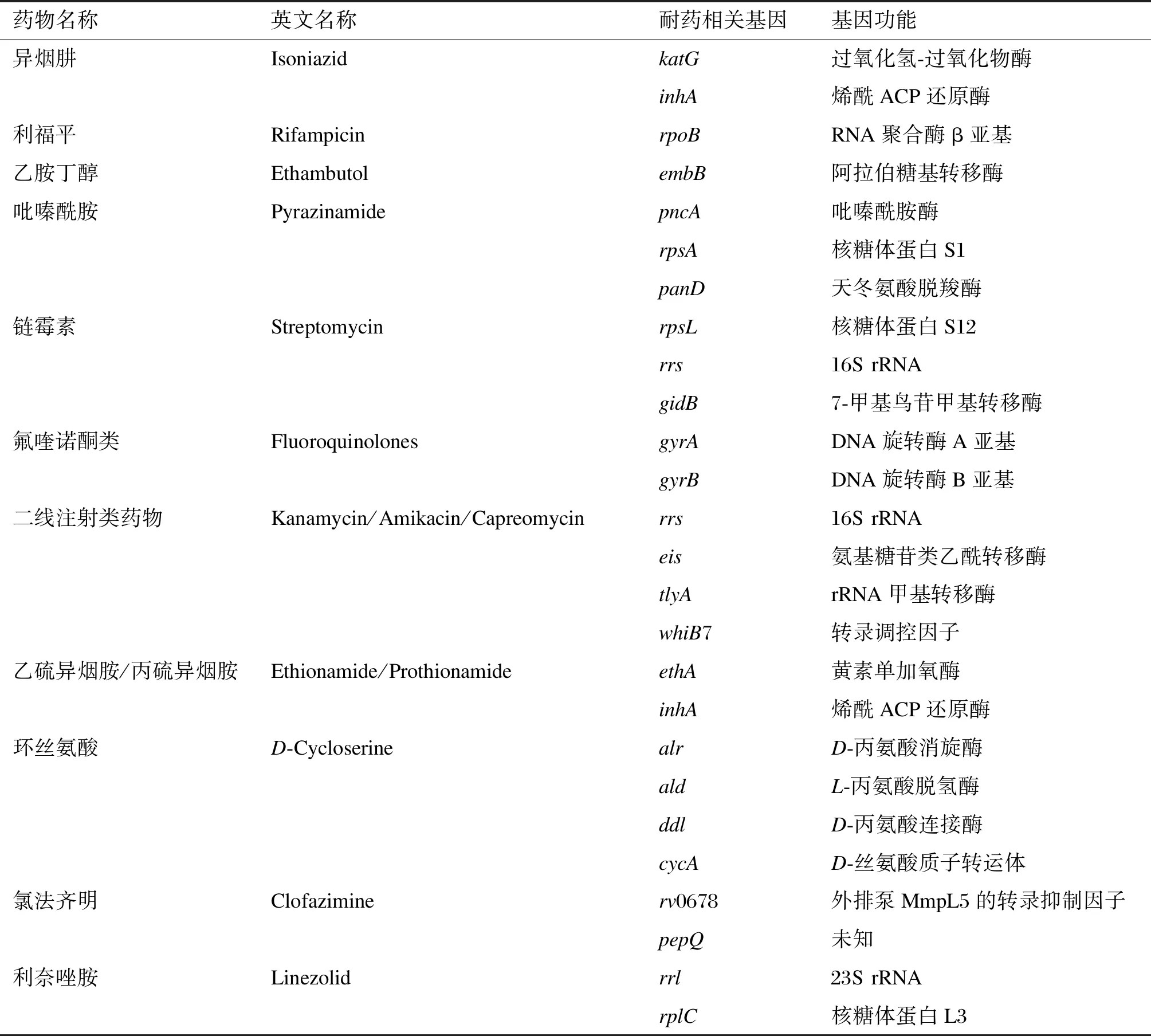
药物名称英文名称耐药相关基因基因功能异烟肼IsoniazidkatG过氧化氢-过氧化物酶inhA烯酰ACP还原酶利福平RifampicinrpoBRNA聚合酶β亚基乙胺丁醇EthambutolembB阿拉伯糖基转移酶吡嗪酰胺PyrazinamidepncA吡嗪酰胺酶rpsA核糖体蛋白S1panD天冬氨酸脱羧酶链霉素StreptomycinrpsL核糖体蛋白S12rrs16S rRNAgidB7-甲基鸟苷甲基转移酶氟喹诺酮类FluoroquinolonesgyrADNA旋转酶A亚基gyrBDNA旋转酶B亚基二线注射类药物Kanamycin/Amikacin/Capreomycinrrs16S rRNAeis氨基糖苷类乙酰转移酶tlyArRNA甲基转移酶whiB7转录调控因子乙硫异烟胺/丙硫异烟胺Ethionamide/ProthionamideethA黄素单加氧酶inhA烯酰ACP还原酶环丝氨酸D-CycloserinealrD-丙氨酸消旋酶aldL-丙氨酸脱氢酶ddlD-丙氨酸连接酶cycAD-丝氨酸质子转运体氯法齐明Clofaziminerv0678外排泵MmpL5的转录抑制因子pepQ未知利奈唑胺Linezolidrrl23S rRNArplC核糖体蛋白L3
1 一线药物
1.1 INH
INH是一种前体药,由过氧化氢-过氧化物酶(KatG)激活,产生的阴离子或游离自由基与NAD+结合,形成NADH化合物,并与NADH依赖的烯酰ACP还原酶(InhA)结合,抑制InhA的活性,破坏细胞壁分枝菌酸的合成,从而达到杀菌目的。
目前公认的与INH耐药相关的突变主要发生于katG和inhA启动子区域,最常见的是katG315。一项系统性综述研究了5 505株INH耐药临床菌株,发现katGSer315Thr(AGC→ACC)和Ser315Asn(AGC→AAC)突变分别占全部INH耐药菌株的 93.4% 和 3.6%[5]。其次常见的是inhA启动子区域C15N、T8N、G17T突变,据报道C15N突变占INH耐药临床菌株的10%~34%[6-7]。
有多篇文献报道过fabG1、kasA、iniA、iniB、iniC、ndh、aphC及其启动子区域等与INH耐药相关的基因,但这些突变与katG、inhA中的突变同时发生,或在INH敏感菌株中不罕见,因此不能将其作为耐药诊断的标记[8]。
1.2 RFP
RFP通过与RNA聚合酶β亚基结合,抑制mRNA合成。结核分枝杆菌RNA聚合酶β亚基由rpoB编码,其发生突变会导致β亚基的构象发生改变,导致RFP无法与之结合。
绝大多数rpoB耐药相关突变发生于RFP耐药决定区(rifampicin resistance-determining region,RRDR),即密码子507~533这一81 bp区域,占全部rpoB耐药相关突变的95%~97%,其中最常见的是密码子516、526、531[9-10]。也有文献报道了RRDR以外的耐药相关突变,且耐药的产生不仅与突变位点有关,不同碱基突变类型导致的耐药水平也不同。
前期研究显示,利福布汀、利福喷汀和RFP三者之间交叉耐药性很高。据报道,12%~36%RFP耐药临床菌株对利福喷汀敏感,随后有研究证实,只有对RFP高度耐药的菌株才对利福喷汀耐药[11]。rpoC、rpoA基因作为补偿突变不直接导致耐药,但可用作预测耐药的标记[12]。
1.3 乙胺丁醇(ethambutol,EMB)
EMB能抑制阿拉伯糖基转移酶对阿拉伯半乳聚糖的聚合作用,从而影响分枝杆菌细胞壁形成。阿拉伯糖基转移酶由embB基因编码,embB及其操纵子embCAB中的突变与EMB耐药有关。
突变最常发生于EMB耐药决定区(EMB resistance-determining region,ERDR),其中密码子306、406、497最常见[13],具有灵敏度低但特异度较高的特点。据报道,embB306突变占EMB耐药临床菌株的50%~70%,embBMet306Val和Met306Leu与EMB高度耐药相关。用embB306作为耐药检测标记的灵敏度为 57.8%,特异度为 78.8%[14]。
在约30%的EMB耐药菌株中找不到上述3个最常见的突变位点。据报道,embC与embA突变共占EMB耐药菌株的10%~15%[14-15]。过表达ubiA基因的野生型菌株对EMB耐药,且已在临床菌株中得到验证[16-17]。ubiA产物聚十异戊二磷酰-β-D-5-磷酸核糖(decaprenyl phosphoryl-β-D-5-phosphoribose,DPPR)合成酶的作用是催化聚十异戊二磷酰-β-D-阿拉伯糖(decaprenyl phosphoryl-β-D-arabinose,DPA)生成,ubiA发生突变时DPA水平升高,而DPA能竞争性抑制 EMB与其靶点 EmbB 结合,从而导致耐药[18]。
1.4 吡嗪酰胺(pyrazinamide,PZA)
PZA的最大特点是可在酸性环境中作用于巨噬细胞及炎性组织内的休眠期或半休眠期结核分枝杆菌。PZA需经过吡嗪酰胺酶(pyrazinamidase, PZAase)处理为吡嗪酸(pyrazinoic acid,POA)后才能发挥杀菌作用。目前普遍认为,PZAase的编码基因pncA及其周围区域的突变是导致PZA耐药的主要原因。
pncA的突变具有多样性[19-20],全长561 bp的突变多态性达54%,表现为不同程度的最低抑菌浓度(minimum inhibitory concentration,MIC)升高,基本无规律可循,且突变类型多变。据报道,pncA突变具有地域性,在中国、南非、日本等国某些地区其基因型耐药与表型耐药的一致性较高,可达90%以上;在某些地区达40%~80%[21-23]。
rpsA的产物为核糖体蛋白S1。目前认为,rpsA的C端突变会导致蛋白结构改变,使其无法与POA结合,导致PZA耐药。panD突变导致耐药的机制可能是panD编码的天冬氨酸脱羧酶是PZA或POA的作用靶点[24]。以上两个基因突变的发生率较低,且多与低度耐药相关,研究尚不完全[25]。
2 二线药物
2.1 氟喹诺酮类
常见氟喹诺酮类药物包括左氧氟沙星、加替沙星、莫西沙星。其作用位点是DNA旋转酶,该酶由两个亚基组成,分别由gyrA和gyrB编码。
喹诺酮耐药决定区(quinolone resistance-determining region,QRDR)主要由gyrA及gyrB的保守区组成[26],即gyrA密码子74~113及gyrB密码子500~540。2012年有系统性综述共纳入 1 220 株耐喹诺酮类临床菌株,发现gyrA中QRDR的突变率为780/1 220(64%),gyrB中QRDR的突变率为17/534(3%)。gyrA最常见的突变在密码子90、91、94,占54%(654/1 220)[27]。也有研究报道了QRDR以外的突变位点。
有研究发现,gyrA和gyrB的突变位点与耐药程度有关,通常认为gyrA88、90、91、94等密码子的突变与高度耐药相关,而gyrB的突变与低度耐药相关;且不同位点的突变、同一位点不同突变类型对各药物的耐药程度不同。约30%耐喹诺酮类临床菌株未找到QRDR中的耐药突变,提示还有其他未发现的耐药相关突变。
2.2 卡那霉素、阿米卡星、卷曲霉素(kanamycin/amikacin/capreomycin,KAN/AMK/CAP)
氨基糖苷类药物(AMK、KAN)通过与16S rRNA及核糖体30S小亚基结合,干扰蛋白质合成。CAP是一种环多肽类药物,抗菌机制与氨基糖苷类药物类似,主要是抑制肽基-tRNA的转移和蛋白质合成。
rrs基因中有3个常见耐药相关位点,即1401、1402和1484,其中rrsA1401G最常见(占30%~90%)。A1401N和G1484N导致3种药物交叉耐药,对KAN和AMK高度耐药,对CAP的MIC影响不定[28]。rrsC1402N主要引起CAP耐药,对KAN耐药的阳性预测值为50%,与AMK耐药基本无关[29]。总体来说,rrs对预测AMK耐药的一致性较强,但对KAN和CAP灵敏度不够。
tlyA(rRNA甲基转移酶)、eis(氨基糖苷类乙酰转移酶)及whiB7(转录调控因子)也与上述药物耐药有关。其中tlyA与CAP低度耐药相关[30]。eis启动子区域10、14、37位点突变与KAN耐药相关,还可导致CAP低度耐药[31]。whiB7中非翻译区(untranslated region,UTR)突变及eis基因启动子区域突变占结核分枝杆菌KAN耐药菌株的 26%~80%[32]。这些基因导致耐药的机制尚不明确。
2.3 链霉素(streptomycin,SM)
SM通过附着于细菌核糖体30S亚基的16S rRNA(rrs)和核糖体蛋白S12(rpsL),干扰甲氨酰tRNA与核糖体小亚基的结合,抑制翻译启动,还可干扰校正过程,影响蛋白质的合成而发挥抗菌作用。因此,编码核糖体蛋白S12的rpsL基因和编码16S rRNA的rrs基因突变是产生对SM耐药的主要机制。
大多数SM耐药突变发生于rpsL基因的密码子43和88,以及rrs基因的530和912环,其中rpsL基因突变占SM耐药菌株的 13.2%~80%,rrs突变占0%~28%[33-34],所占比例因地理位置、结核分枝杆菌分型不同而异。
gidB基因全长675 bp,全长均可发生突变。已在至少173个位点发现过突变,多态性达26%。目前认为gidBL16R、E92D为多态性,与耐药无关,是种系发展的标记,其中gidBL16R与LAM型相关,E92D与北京型相关[35]。
2.4 乙硫异烟胺(ethionamide,Eto)和丙硫异烟胺(prothionamide,Pto)
Eto和Pto是碳硫胺类药物,为异烟酸衍生物。其作用机制与INH相似,通过抑制结核分枝杆菌分枝菌酸合成而杀菌。Eto需被ethA编码的包含FAD的NADPH特异性单氧化酶激活,随后通过抑制InhA的活性破坏细胞壁分枝菌酸的合成,从而达到杀菌目的。因此,ethA突变占Eto耐药菌株的47%,inhA及其启动子区域突变占55%[36]。ethA基因中的耐药突变具有多样性,散布于基因全长,尚未发现分布规律。这两种药物与INH有部分交叉耐药。据报道,inhA及其启动子区域同时发生突变会导致INH高度耐药及INH与Eto交叉耐药,交叉耐药率达 95.12%[37-38]。
2.5 环丝氨酸(D-cycloserine,DCS)
DCS是D-丙氨酸的环状类似物。其作用机制是通过阻断D-丙氨酸消旋酶(alanine racemase,Alr),使L-丙氨酸无法变构为D-丙氨酸,无法在D-丙氨酸连接酶(D-alanine∶D-alanine ligase, Ddl)的作用下形成肽聚糖合成的重要原料D-丙氨酸五肽,从而抑制结核分枝杆菌细胞壁肽聚糖的合成。
目前已发现4个与DCS耐药相关的基因alr、ddl、ald和cycA[39]。ald突变产生的耐药程度较alr高[40]。cycA编码的转运蛋白转运D-丙氨酸、D-丝氨酸和甘氨酸等[40-41]。ald(Rv2780)编码L-丙氨酸脱氢酶,已在耐DCS临床菌株中发现了其突变。
然而,DCS的耐药率低,对无DCS耐药表型的MDR菌株并不常规检测其alr和ddl等基因突变情况。因此,DCS耐药的临床情况及分子机制有待进一步探索。
2.6 氯法齐明(clofazimine,Cfz)
Cfz最初是一种用于治疗麻风病的药物,2016年WHO年度结核报道中首次将其列入核心药物,但作用机制尚不明确。
目前发现的Cfz耐药基因有rv0678、rv1979c和rv2535c。其中rv0678是一种转录抑制因子,其突变会导致外排泵MmpL5表达升高,使多种药物交叉耐药[42-43]。rv0678耐药相关突变具有多样性,散布于基因全长,未找到分布规律。有体外实验发现pepQ缺失会导致结核分枝杆菌对Cfz的灵敏度下降,还会导致Cfz与贝达喹啉(bedaquiline)交叉耐药。
其他耐药相关基因仍在陆续发现中,需进一步进行临床验证和机制研究。
2.7 利奈唑胺(linezolid,LNZ)
目前发现的LNZ耐药基因主要有23S rRNA的rrl和rplC基因。rrl的主要耐药突变是G2576T和G2061T[44],rplC最常见的耐药突变是Cys154Arg[45]。其中,rplC与较高的MIC相关。这两个基因突变只涵盖不到30%的耐药菌株[46]。
结核分枝杆菌的耐药机制非常复杂,过去常将表型耐药与基因型耐药的不一致归因于机制研究的不足。但事实上,导致这一现象的原因有很多,如临界浓度、原发或获得性耐药、检出限度、随机误差、基因型与表型之间的错误关联等。此外,现有研究仅专注于耐药菌株,甚至仅关注MDR及广泛耐药(extensively drug resistance,XDR)菌株,而忽视了敏感菌株这一大背景,这种偏移导致耐药位点的预测价值有限。
耐药结核病是全球结核病防控工作的主要威胁之一,急需开发和应用新工具进行快速、准确、全面的耐药诊断。随着测序技术的成熟、测序成本的降低及生物信息学的发展,对结核病耐药机制的研究不断深入,临床应用全基因组测序检测结核分枝杆菌耐药性成为可能。这与近年来一直提倡的精准医疗思路一脉相承,都强调了针对菌株耐药情况进行抗结核方案调整,使患者最大程度受益。同时,还应在临床菌株中证实现有耐药相关突变位点的诊断作用,以解决当前结核病耐药性问题为导向而开发抗结核新药。
