靶向3D基因shRNA慢病毒载体的构建及功能鉴定
2019-04-22闫碧莹徐维祯钟照华
闫碧莹,徐维祯,钟照华
哈尔滨医科大学微生物学教研室,黑龙江 哈尔滨 150081
B组柯萨奇病毒(coxsackievirus B,CVB)属小RNA病毒科肠道病毒属,是人类病毒性心肌炎的主要病原[1]。根据美国疾病预防控制中心统计数据,CVB每年可导致大约500万人患肠道系统疾病,其中20%患有CVB3感染引起的急性心肌炎[2],在我国也有相应疾病的流行报道[3]。但目前尚无特异性有效抑制CVB感染的药物[4]。
CVB为无包膜单正链RNA病毒,全长 7.4 kb。基因组只有1个开放读码框架和2个非编码区。开放读码框架可编码4个结构蛋白(VP1~VP4)和7个非结构蛋白(2A~2C和3A~3D)[5]。其中3D基因编码RNA依赖的RNA聚合酶,负责病毒基因组RNA的转录,合成子代病毒基因组,在CVB感染和复制过程中发挥关键作用[6]。黄病毒属的寨卡病毒[7]、丙型肝炎病毒[8]均为单正链RNA病毒。研究表明[7-8],以病毒RNA聚合酶为靶点的抑制剂抗病毒效果显著。
RNA干扰(RNA interference,RNAi)是指在进化过程中高度保守的双链RNA(double stranded RNA,dsRNA)诱发的基因沉默现象[9],能特异性剔除或关闭靶基因的表达[10],已广泛用于探索基因功能和基因治疗领域[11]。慢病毒载体能稳定介导基因沉默,不仅转染效率高,还可持续稳定地表达[12-13]。本研究旨在筛选作用于CVB 3D基因的短发夹RNA(short hairpin RNA,shRNA),并构建慢病毒Lenti-sh3D,为后续抗CVB致病机制的研究奠定基础。
表1siRNA靶向序列
Tab.1siRNAtargetingsequences

siRNATarget sequenceSitesiRNA-1043GCAAGGACTATGGATTAATCA1 043-1 063siRNA-1218GGAACCAAAGAATACCCAAGA1 218-1 238siRNA-1281GCACGAATATGAGGAGTTTAT1 281-1 301siRNA-NCTCAGGAGGTCTCGCTAAGTCA—
1 材料与方法
1.1 材料
HeLa细胞、293T细胞、CVB3 Woodruff株由本教研室保存,抗CVB3 3D抗体由本教研室制备。pLVTHM、pMD2.G、psPAX2载体(Addgene #12247、#12259、#12260)和StbI3感受态购自上海唯地生物技术有限公司。小干扰RNA(small interfering RNA,siRNA)由苏州吉玛基因股份有限公司合成,单链shRNA由苏州金维智生物科技有限公司合成。Annealing buffer for DNA oligos(5×)购自Beyotime公司,限制性内切酶ClaⅠ、限制性内切酶MluⅠ购自纽英伦生物技术有限公司,质粒DNA小量提取试剂盒、DNA凝胶回收试剂盒购自康宁生命科学有限公司,T4连接酶、DL15000 DNA Marker、6×Loading Buffer购自大连TaKaRa公司,聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)凝胶快速制备试剂盒购自EpiZyme公司,PageRuler预染蛋白Marker购自Thermo Fisher公司,6×SDS-PAGE蛋白上样缓冲液购自上海碧云天生物技术有限公司,辣根过氧化物酶(horseradish peroxidase,HRP)标记山羊抗兔IgG购自万类生物科技有限公司,GAPDH兔多克隆抗体购自美国Proteintech公司,超敏增强化学发光(enhanced chemiluminescence,ECL)即用型底物购自武汉博士德生物工程有限公司。1周龄BALB/c小鼠购自哈尔滨医科大学附属第二医院动物实验中心。
1.2 方法
1.2.1细胞培养HeLa、293T细胞均于含10%胎牛血清的高糖DMEM培养基中培养,培养条件为37 ℃、5% CO2。
1.2.2CVB33DsiRNA靶向序列的设计根据美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)中CVB3 3D基因(2157045)的核酸序列,利用BLOCK-iTTMRNAi Designer公用设计软件(http://rnaidesigner.thermofisher.com/rnaiexpress/insert.do)设计并合成3对siRNA靶向序列及1对阴性对照序列(表1)。
1.2.3CVB33DshRNA的筛选及合成分别将合成的3条siRNA经Lipofectamine 2000转染至已培养24 h的HeLa细胞(24孔板:5×104个),同时设置阴性对照组。转染48 h后,收集细胞沉淀并提取RNA和蛋白,通过定量反转录-聚合酶链反应(quantitative reverse transcription-polymerase chain reaction,RT-qPCR)和蛋白免疫印迹法筛选抑制效率最佳的siRNA序列用于设计并合成shRNA。合成的shRNA中,loop茎环结构为TTCAAGAGA,3′ 端加入TTTTT终止信号,5′ 端及3′ 端分别引入ClaⅠ和MluⅠ酶切位点(表2)。
表2构建慢病毒载体的shRNA序列
Tab.2TheshRNAsequencesusedforconstructinglentiviralvectors

shRNAPrimershRNA-1043CGCGTCCCCGCAAGGACTATGGATTAATCATTCAAGAGATGATTAATCCATAGTCCTT-GCTTTTTGGAAATshRNA-1218CGCGTCCCCGGATCCAAAGAATACCCAAGATTCAAGAGATCTTGGGTATTCTTTGGAT-CCTTTTTGGAAATScrambled shRNACGCGTCCCCTCAGGAGGTCTCGCTAAGTCATTCAAGAGATGACTTAGCGAGACCTCCT-GATTTTTGGAAAT
1.2.4pLVTHM-3DshRNA重组质粒的构建及鉴定将合成的单链shRNA配对退火,并将退火产物进行200倍稀释后备用。pLVTHM载体质粒经ClaⅠ/MluⅠ双酶切并凝胶电泳,回收酶切产物。将退火产物与获得的线性化pLVTHM经T4连接酶于16 ℃ 连接过夜(不超过12 h),转化大肠埃希菌StbI3感受态,然后涂布于氨苄西林(ampicillin,Amp)抗性LB固体培养基平板,37 ℃过夜培养;随机挑取单克隆菌落,接种于Amp抗性LB液体培养基中,37 ℃过夜培养;提取质粒,酶切,行DNA测序鉴定(测序引物序列:TCGATATGTGTTCT-GGGAAA)。
将酶切及序列比对正确的pLVTHM-3DshRNA 重组质粒经Lipofectamine 2000转染于已培养24 h的HeLa细胞(细胞数:5×104),转染48 h后观察荧光。收集细胞沉淀并提取RNA和蛋白,通过RT-qPCR和蛋白免疫印迹法筛选抑制效率最佳的pLVTHM-3DshRNA进行慢病毒包装。
1.2.5慢病毒Lenti-sh3D表达载体的包装及干扰效果鉴定将1×106个293T细胞接种于6孔板,于37 ℃、5% CO2培养箱中常规培养24 h。细胞生长融合度达70%~80%时,将pLVTHM-3DshRNA质粒与慢病毒包装质粒(psPAX2和pMD2.G)利用Lipofectamine 2000共转染293T细胞进行病毒包装。慢病毒包装所需的3个质粒pLVTHM-3DshRNA、psPAX2 和pMD2.G的比例为 4∶2∶1。转染6 h后换新鲜完全培养液,继续培养48 h,并观察荧光。转染后48 h收取病毒上清液,用 0.45 μm微孔滤器过滤,收集过滤液,即得病毒原液Lenti-sh3D。
将慢病毒Lenti-sh3D感染已培养24 h的HeLa细胞(24孔板:5×104个),48 h后用CVB3感染(TCID50=10-4.75/mL)24 h,同时设对照组。收集细胞沉淀并提取蛋白,用蛋白免疫印迹法检测抑制效果。
慢病毒Lenti-sh3D经腹腔注射感染1周龄BALB/c小鼠,再用CVB3感染,同时设对照组。5 d后取小鼠心脏组织,用蛋白免疫印迹法检测抑制效果。
1.2.6慢病毒Lenti-sh3D滴度测定将1×104个293T细胞接种于96孔板,感染时细胞融合度为70%。将病毒原液用opti-MEM进行梯度稀释(1∶10、1∶100、1∶1 000、1∶10 000、1∶100 000),吸去96孔板中的培养液,每孔加入100 μL各梯度稀释液,培养过夜,24 h后更换为完全培养基,培养3 d。荧光显微镜下观察,根据公式计算病毒滴度(滴度=荧光细胞个数×相应的稀释倍数)。
1.3 统计学方法
2 结果
2.1 CVB 3D基因 siRNA有效靶点的筛选
根据NCBI中3D序列和在线公共设计软件,筛选出3条评分较高的靶向序列,合成siRNA后转染293T细胞,采用蛋白免疫印迹和RT-qPCR检测3D聚合酶的表达和病毒复制情况。蛋白免疫印迹结果显示,与对照组相比,siRNA-1043的干扰效果显著(P<0.001),3D聚合酶表达的抑制率约为50%(图1A、1B)。RT-qPCR结果表明,与对照组相比,3条靶向序列均可有效降低CVB3 RNA,其中siRNA-1043抑制效果较好(P<0.001),抑制率为 43.7%(图1C)。综合以上结果, siRNA-1043抑制效果显著,筛选为shRNA候选序列,合成后用于制备慢病毒。
2.2 pLVTHM-3DshRNA重组质粒的构建及鉴定
将干扰效率较高的siRNA-1043和siRNA-1218的寡核苷酸序列合成shRNA,退火后与经ClaⅠ和MluⅠ双酶切的慢病毒骨架质粒pLVTHM连接,构建pLVTHM-3DshRNA重组质粒。ClaⅠ单酶切鉴定结果显示,酶切产物大小为 11 085 bp,与预期结果相符。DNA测序结果显示,基因序列正确,无突变与缺失(图2)。由此可见,pLVTHM-3DshRNA重组质粒构建成功。
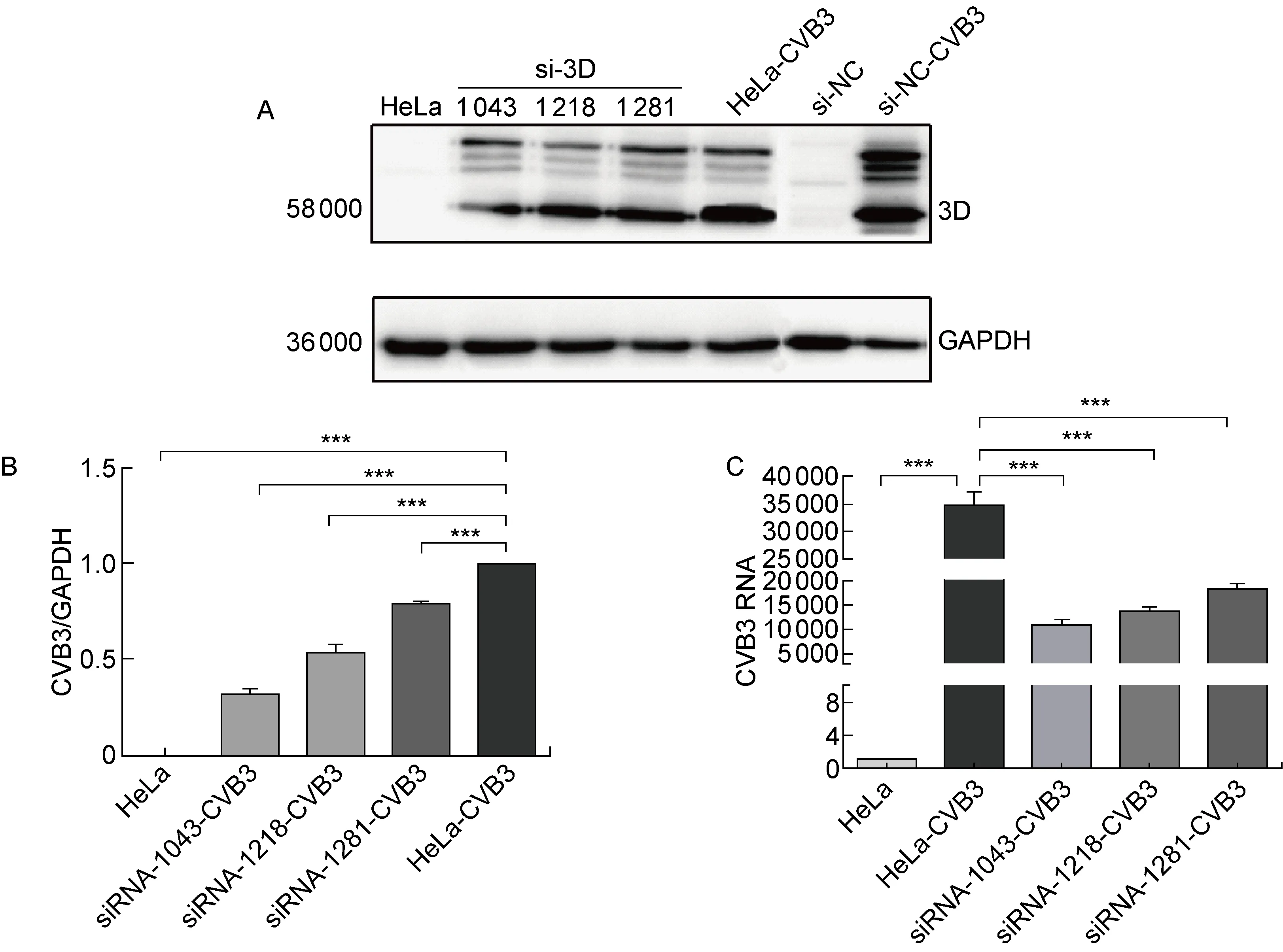
A: Expression of 3D in CVB3-induced cells after siRNA interference by Western blotting. B: Quantitative analysis of protein expression.n=3,***P<0.001. C: Expression of CVB3 RNA in CVB3-induced cells after siRNA interference by RT-qPCR.
图1CVB3D基因siRNA有效靶点的筛选
Fig.1ScreeningofeffectivetargetsofCVB3DsiRNA
Sequence of recombinant plasmid.
图2pLVTHM-3DshRNA重组质粒的鉴定
Fig.2IdentificationofpLVTHM-3DshRNAexpressionvector
将所得正确的重组质粒转染HeLa细胞,48 h后观察荧光表达。结果显示,转染48 h后,镜下可见绿色荧光,表达量约为60%。
2.3 慢病毒Lenti-sh3D包装及滴度测试
将pLVTHM-3DshRNA 重组质粒与慢病毒包装质粒共转染293T细胞,转染48 h后,镜下可观察到绿色荧光,收集细胞上清液并过滤,即为含有慢病毒颗粒Lenti-sh3D的病毒液。取1×104个293T细胞接种于96孔板,感染时细胞融合度为70%~80%,梯度稀释病毒原液,以感染单位TU/mL表示病毒滴度。3 d后观测荧光,在10-4稀释度下可观测到5个细胞(图3),经计算,制备的慢病毒原液滴度为5×107TU。
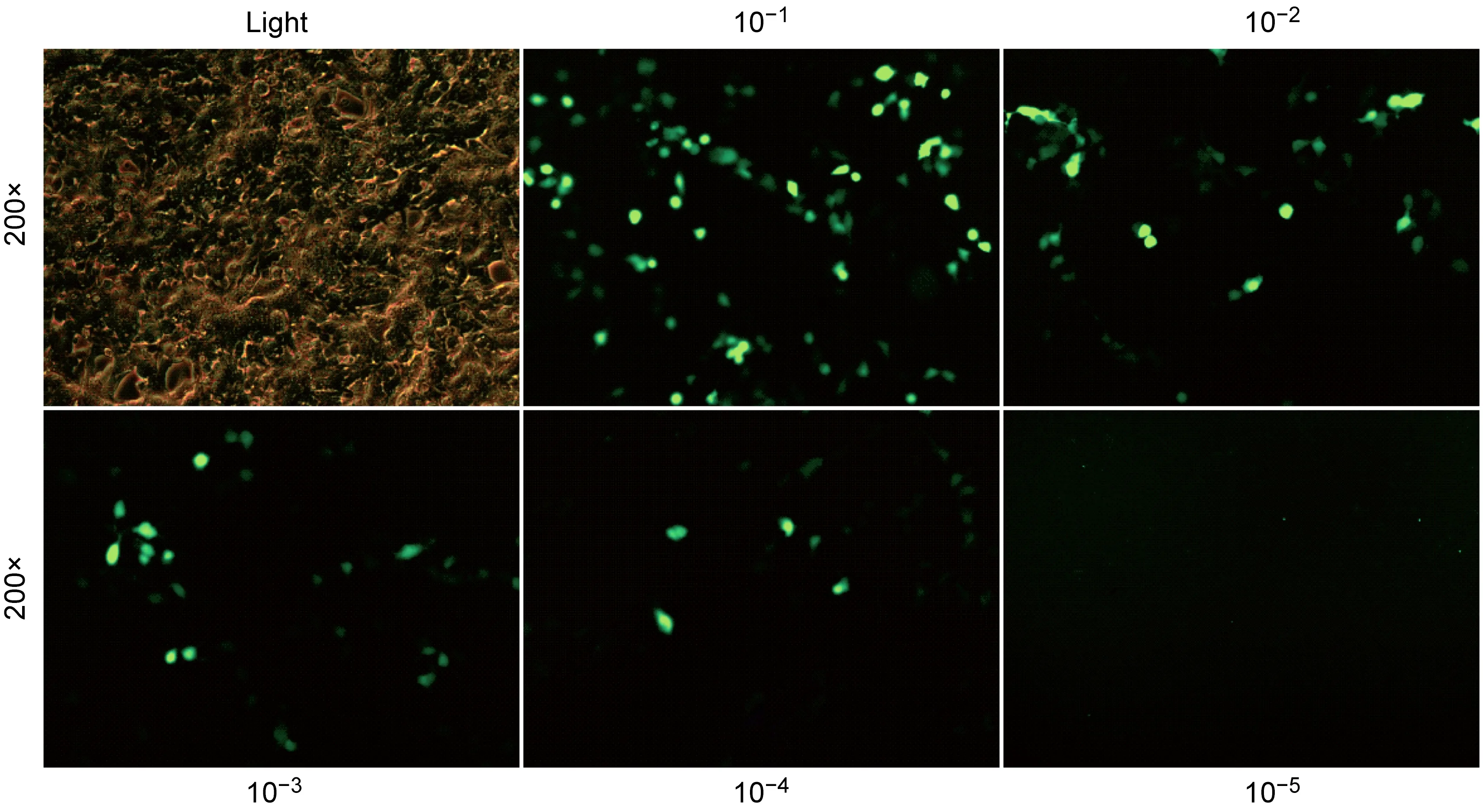
Green fluorescence expression at each dilution.
图3慢病毒Lenti-sh3D滴度的测定
Fig.3DeterminationofLenti-sh3Dtiter
2.4 慢病毒Lenti-sh3D干扰效果
将病毒液加入HeLa细胞中,48 h后观察荧光(图4C)。再用CVB3感染24 h,收集各组细胞沉淀,提取蛋白。蛋白免疫印迹结果显示(图4A、4B),与对照组Lenti-mock相比,Lenti-sh3D感染组3D聚合酶表达水平明显降低(P<0.001),抑制率约为52%,表明慢病毒包装成功,且能显著抑制CVB3 3D聚合酶的表达水平。
将病毒液经腹腔注入小鼠体内,5 d后收集心脏组织,提取蛋白。蛋白免疫印迹结果显示(图4D、4E),与对照组Lenti-mock相比,Lenti-sh3D感染组3D聚合酶表达水平降低(P<0.001),抑制率约为44%。
3 讨论
CVB是病毒性心肌炎的主要病原,但致病机制尚未明确。3D基因编码RNA依赖的RNA聚合酶,负责病毒基因组RNA的转录,合成子代病毒基因组,在CVB感染和复制中发挥重要作用,选择3D作为靶基因可为CVB基因治疗奠定基础。目前,干扰靶点设计的网站有GeneLink、IDT、siRNA Wizard等。本研究利用BLOCK-iTTMRNAi Designer公用软件设计出3条siRNA,评分均较高。因此,首先进行靶点筛选。依据实验结果,虽然评分较高的几条siRNA均可有效抑制病毒3D聚合酶的表达及病毒的复制,但siRNA-1043抑制效果最显著,可抑制约50%的3D聚合酶表达和 43.7% 的病毒复制,被确定为后续shRNA的候选序列。由此提示,靶点序列的筛选很重要[14-15]。此外,相对shRNA,siRNA具有易筛选、价格低的优势,且两者在靶序列的选择上具有一致性。因此,本研究针对设计软件提供的多条靶序列首先采用siRNA进行筛选,确定最终干扰效率最佳的序列合成shRNA,然后用于慢病毒的制备,既降低了shRNA合成的消耗,又保障了慢病毒的高效性。
慢病毒载体是源于反转录病毒的载体,其转染效率高,可感染分裂期和非分裂期的细胞,还可容纳较大的基因片段,有良好的科研应用价值。近20年来,RNAi技术发展迅速,被广泛用于一些疾病治疗[16-17]。将慢病毒载体用于RNAi技术,成为基因功能研究和基因治疗领域的一种有力手段[18]。
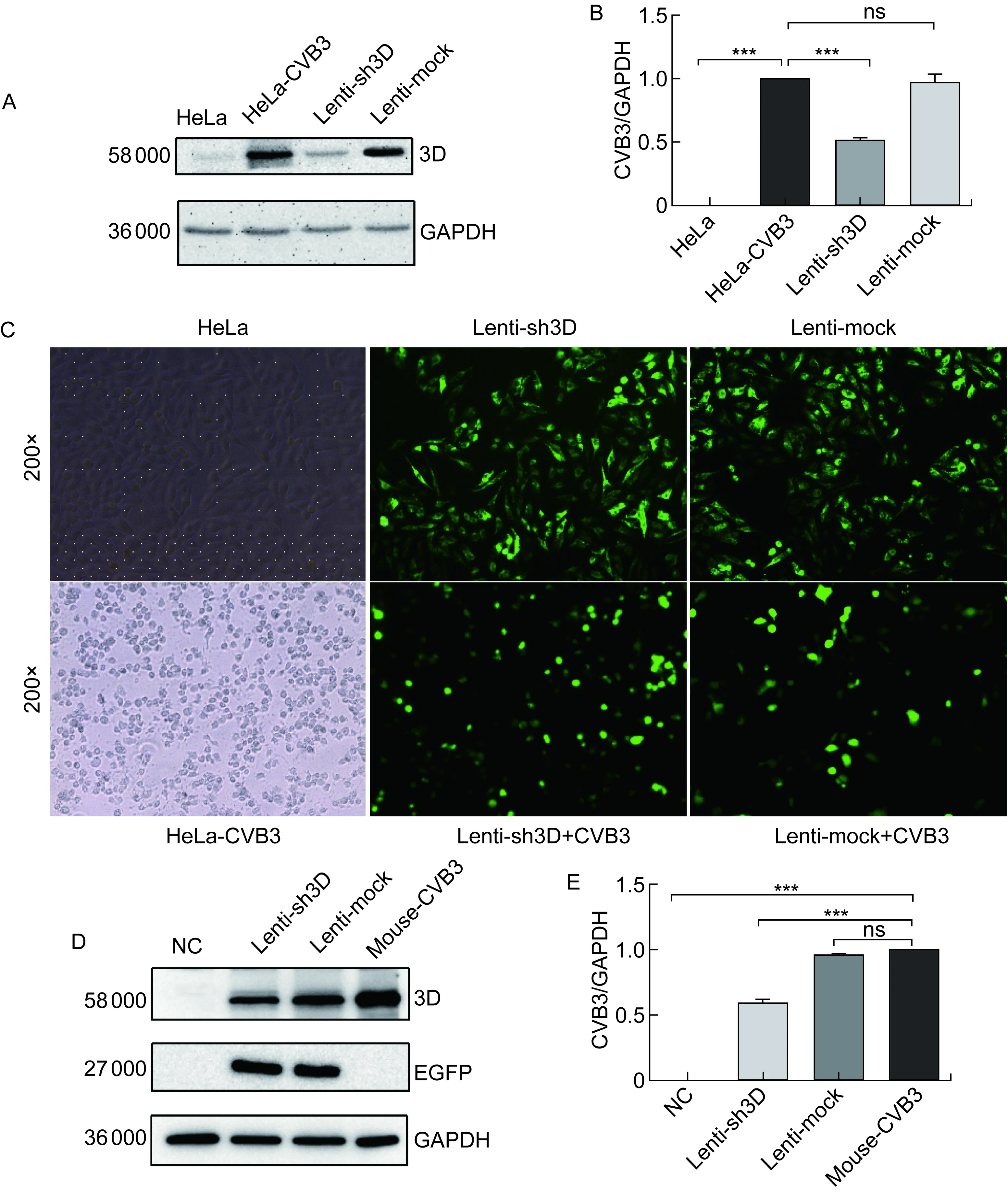
A: Expression of 3D in CVB3-induced HeLa cells after lentiviral infection by Western blotting. B: Quantitative analysis of protein expression.n=3,***P<0.001. C: Expression of green fluorescent protein was observed under fluorescence microscope (200×). D: Expression of 3D in CVB3-induced BALB/c mice after lentiviral infection by Western blotting. E: Quantitative analysis of protein expression.n=3,***P<0.001.
图4慢病毒Lenti-sh3D干扰效果鉴定
Fig.4InterferenceeffectofLenti-sh3D
本研究成功构建了pLVTHM-3DshRNA 重组质粒,采用第二代慢病毒包装系统包装,成功获得15 mL慢病毒Lenti-sh3D,收获的病毒可显著抑制3D基因的表达,抑制率约为52%,病毒滴度为5×107TU。
通过相关实验,发现慢病毒载体法还存在很多缺点:①实验对细胞状态有很严格的要求。转染慢病毒重组质粒时,需进行48~72 h的长期培养,这对细胞密度和状态要求很高。②病毒包装表达率不是很高。采用三质粒包装系统进行慢病毒包装,细胞状态、转染效率等因素可能导致病毒滴度不是很高,在10-5稀释度就观测不到荧光,需对病毒进行纯化和浓缩以提高滴度。③保存的病毒在反复冻融后滴度下降。经 -80 ℃反复冻融时病毒滴度降低很快,建议分装收集到的上清液。④实验操作繁琐,时间较长。
