CEUS鉴别诊断涎腺良恶性病变
2019-04-19蒋丽萍周爱云余美琴
蒋丽萍,周爱云,余美琴
(南昌大学第一附属医院超声医学科,江西 南昌 330006)
涎腺肿瘤占头颈部肿瘤的3%,肿瘤的组织类型复杂,其中恶性肿瘤约占20%,即使良性肿瘤也有恶变的可能[1]。目前对涎腺肿瘤的主要治疗手段为手术切除,恶性肿瘤还需辅助放化疗。良恶性肿瘤的手术方式及手术范围不同,恶性肿瘤切除范围较大,且须将面神经一起切除,可导致患者同侧面瘫,严重影响患者的生活质量。因此术前鉴别诊断涎腺良恶性肿瘤对临床术式的选择非常重要。本研究探讨CEUS对涎腺良恶性病变的鉴别诊断价值。
1 资料与方法
1.1 一般资料 收集2016年6月—2018年9月于我院就诊并经手术病理证实的87例涎腺实性或囊实性病变患者,男53例,女34例,年龄19~88岁,平均(51.0±16.9)岁。所有患者均于CEUS检查后1周内接受手术治疗。排除心肺功能异常、患有干燥综合征等涎腺弥漫性疾病及曾接受放化疗的患者。
1.2 仪器与方法 采用Philips iU22或Elite超声诊断仪,探头L12-5(频率5~12 MHz)、L9-3(频率3~9 MHz)。造影剂采用声诺维,将其注射于5 ml生理盐水中振荡配置成悬浮液备用。嘱患者仰卧,充分伸展患侧颈部,平静呼吸、禁言、制动。首先将L12-5探头轻放于皮肤表面,选定肿块血流丰富、边界清晰且能显示部分正常涎腺组织的切面,切换至L9-3探头,并启动CEUS模式(机械指数0.06)。经肘静脉团注造影剂2.4 ml,存储90 s以上动态图像以备后续分析。对于单侧腺体多个肿块者尽量选择可以同时显示多个肿块的切面,对于不能同时显示者及双侧涎腺肿块者则进行多次CEUS检查。以上检查均由同1名从事CEUS工作5年以上的主治医师完成。
1.3 图像分析 由1名主治医师和1名主任医师共同协商分析动态声像图,观察肿块增强均匀程度(均匀增强或不均匀增强)、增强模式(向心性增强或非向心性增强)、增强边界(清晰或不清晰)、增强环(肿块周边可见完整增强环或未见完整增强环)和增强后肿块范围。然后启动QLAB分析软件,于肿块内及周边涎腺组织内各选择1个ROI,面积约0.5 cm2,肿块ROI放置于增强最明显区域,并避开钙化、囊变及大血管区,软件自动绘制时间-强度曲线,分析肿块的增强程度、达峰方式和消退方式。增强程度分为高增强和非高增强,肿块的峰值强度高于周边正常涎腺组织的峰值强度为高增强,等于或低于周边正常涎腺组织的峰值强度为非高增强;达峰方式包括快进、等或慢进,分别指肿块达峰时间快于、等于或慢于周边涎腺组织;消退方式包括快退、等或慢退,分别指肿块造影剂消退时间快于、等于或慢于周边涎腺组织。
1.4 统计学分析 采用SPSS 23.0统计分析软件。计量资料以±s表示,良恶性病变间比较采用独立样本t检验。计数资料采用频数或百分率表示,良恶性病变间比较采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
87例患者中,80例单发病变,7例多发,多发病变者取其中单切面可完整显示肿块全貌、增强强度最强的肿块纳入研究,共纳入87个病变。本组良性病变74例,包括37例混合瘤(pleomorphic adenomoa,PA),24例腺淋巴瘤,5例基底细胞腺瘤,3例慢性炎性包块,3例神经源性肿瘤,1例孤立性纤维性肿瘤,1例淋巴上皮囊肿;恶性病变13例,包括4例黏液表皮样癌,4例非特异性腺癌,2例转移性肿瘤,腺泡细胞癌、淋巴细胞瘤和肌上皮癌各1例。良性病变中,位于腮腺65例,颌下腺9例;恶性病变中,位于腮腺11例,颌下腺2例;差异无统计学意义(P=0.67)。良性和恶性病变患者年龄分别为(51.9±16.3)岁和(53.77±13.4)岁,肿块最大径分别为(24.47±9.79)mm和(22.08±9.74)mm,差异均无统计学意义(t=-0.39、0.81,P=0.70、0.42)。
涎腺良恶性病变间增强边界、增强环及增强后肿块范围差异均有统计学意义(P均<0.01),而增强程度、增强均匀程度、增强模式、达峰方式及消退方式的差异均无统计学意义(P均≥0.05),见表1、图1~3。在29例呈向心性增强的患者中,25例(25/29,86.21%)为PA患者。以增强边界不清晰鉴别诊断涎腺良恶性病变的敏感度、特异度及准确率分别为69.23%(9/13)、87.84%(65/74)、85.06%(74/87);以无增强环及以增强后肿块范围增大鉴别诊断涎腺良恶性病变的敏感度、特异度及准确率分别为84.62%(11/13)、71.62%(53/74)、73.56%(64/87)和69.23%(9/13)、95.95%(71/74)、91.95%(80/87);将三者联合应用,其敏感度、特异度及准确率分别为84.62%(11/13)、95.95%(71/74)、94.25%(82/87)。
3 讨论
涎腺病变虽以良性多见,但术前仍需对病变良恶性进行鉴别诊断。常规高频超声作为涎腺病变首选的影像学检查方法,可以显示肿瘤部位、内部回声、是否囊变、边界等情况,但良恶性病变常规超声征象重叠较多,其鉴别能力有限[2]。超声造影剂声诺维的出现,使CEUS被广泛应用于临床,在病变的良恶性鉴别诊断中发挥了巨大的作用。
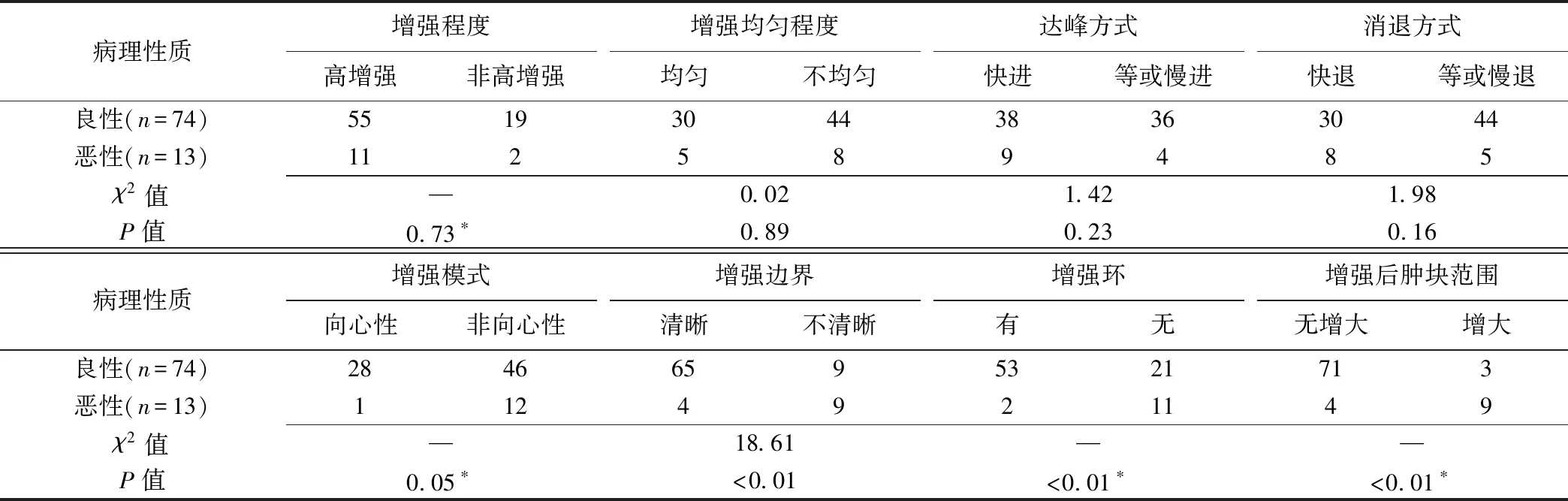
表1 涎腺良恶性病变的超声特征(例)
注:*:采用Fisher确切概率法
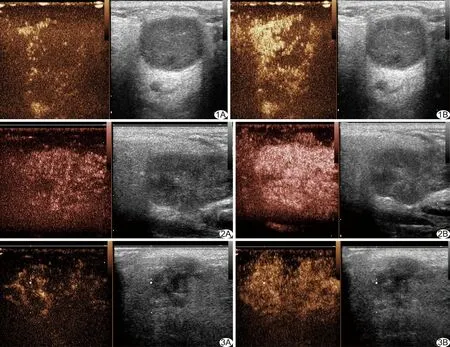
图1 患者女,36岁,左腮腺PA 肿块于注射造影剂后4 s(A)、6 s(B)呈不均匀性向心性增强,边界清晰,周边可见增强环,增强后肿块范围未增大 图2 患者男,70岁,右腮腺腺淋巴瘤 肿块于注射造影剂后9 s(A)、12 s(B)均呈均匀性弥散性增强,边界清晰 图3 患者男,55岁,右腮腺黏液表皮样癌 肿块于注射造影剂后10 s(A)、26 s(B)均表现为不均匀性弥散性增强,边界不清,增强后肿块范围增大
本研究中涎腺良恶性病变在增强边界、增强环及增强后肿块范围方面差异均有统计学意义(P均<0.01),与Gou等[3]研究结果一致。恶性病变呈侵袭性生长,破环肿瘤周边的包膜及周边正常涎腺组织[4],导致肿块的边界不清、增强范围增大。有研究[2]认为常规高频超声中仅约30%的恶性病变表现为边界不清,而本研究中69.23%(9/13)恶性病变造影后表现为边界不清晰和造影后病变范围增大。陈丽羽等[5]认为CEUS后肿块与周围组织分界不清可作为良恶性PA的鉴别要点。增强环的形成可能与肿瘤自身具有包膜或肿瘤膨胀性生长压迫周围组织形成假包膜有关[6],大部分涎腺良性病变具有包膜结构、呈膨胀性生长,因此增强后边界清晰、周边可见完整增强环。本研究良性病变中21例未见完整增强环,3例注射造影剂后肿块范围可见增大,其原因可能为:①部分PA具有侵袭性生物学行为;②炎性肿块中炎性细胞浸润,在CEUS上可表现为无增强环形成,且肿块范围可见增大;③部分肿块体积较大且位于涎腺浅叶,由于侧边声影及近场无法聚焦等原因无法显示增强环,甚至影响对肿块增强范围的观察;④部分肿块较小,对周围涎腺组织未形成压迫而无增强环形成;⑤部分肿块囊变区较大,影响了增强环、边界及范围的观察。联合应用以上三项指标,其鉴别诊断涎腺良恶性的敏感度、特异度及准确率达84.62%(11/13)、95.95%(71/74)、94.25%(82/87),具有较高的诊断价值。
本研究结果显示,涎腺良恶性病变的增强程度均以高增强为主(P=0.73),提示两者在血供方面无明显差异,但李锐等[7]研究认为涎腺良恶性病变的血流分级不同,可能是因为其良性病灶中包含14例(14/32,43.75%)乏血供炎症、结核等良性非肿瘤性病变,而本研究的良性非肿瘤性病变仅3例(3/74,4.05%)。另外本研究中对病变增强程度是根据时间-强度曲线的定量判断,与苟加梅等[8]的半定量方法不同,因此结果与之不一致。本研究中涎腺良恶性病变增强均匀程度均以不均匀性增强为主(P=0.89),恶性病变因生长较快,内部常出现液化坏死,注射造影剂后表现为不均匀性增强;良性病变中的PA主要由上皮组织、黏液液组织和软骨样间质组成[9],因其病理组织成分比例不同,在CEUS中亦表现为不均匀性增强[3,10-11];而腺淋巴瘤也因内部常出现感染、液化等使影像学表现差异性较大,内部常见囊变区。
有关涎腺病变的达峰和消退时间的研究[3,5,10-11]较多,但结果并不一致。本研究将病灶与周边腺体的达峰和消退时间相比较,以确定病灶的达峰和消退方式,较达峰和消退时间更直观、便捷,有利于临床应用,但结果发现涎腺良恶性病变间达峰方式和消退方式的差异均无统计学意义(P均>0.05),可能与病变均血供较丰富有关。本研究中涎腺良恶性病变均以非向心性增强为主(P=0.05),但在29例呈向心性强化的患者中,25例(25/29,86.21%)为PA患者,与PA边缘区和中央区微血管分布的差异密切相关[8],提示向心性增强是PA的特征性CEUS表现。
戴俊臣等[11]研究结果显示因腮腺和颌下腺的血供来源不同,使颌下腺PA的增强强度大于腮腺PA。本研究中良性肿瘤大部分来源于腮腺,9例位于颌下腺,未对不同腺体间同类病变的差异以及该差异是否影响研究结果进行对比分析,但本研究中涎腺良恶性病变的分布部位差异无统计学意义(P=0.67),推测可在一定程度上排除病变来源部位不同对结果造成的影响。另外本研究中恶性病变样本数较少,与良性病变相差较多,在今后的研究中需增加样本量进一步研究。
综上所述,涎腺恶性病变的CEUS主要特征为增强后肿块无完整增强环、增强边界不清和增强后肿块范围增大,三者联合应用对涎腺良恶性病变具有较高的诊断效能。
