一株产红色素内生真菌色素的稳定性研究
2019-04-18廖月姣蒙南村蒋青玲
廖月姣 蒙南村 蒋青玲
摘 要:以艾草根块分离得到的内生真菌WS-221为研究对象,以色素提取液吸光度为重要指标,对该菌所产的色素进行了稳定性研究。结果表明:该菌所产色素提取液在490nm处出现最大吸收峰。紫外光对色素稳定性影响较小,色素溶液中添加适量Na+、K+、Al3+具有一定的增色作用,并且食盐浓度在0.2g/mL时增色效果明显。综合评价,该菌所产色素稳定性良好,具有广泛的工业价值。
关键词:内生真菌;色素提取;色素稳定性
中图分类号 TS201.2 文献标识码 A 文章编号 1007-7731(2019)05-0023-03
Abstract:The endophytic fungus WS-221 isolated from the wormwood root block was used as the research object,and the stability of the pigment produced by the fungus was studied by using the absorbance of the pigment extract as an important index.The results showed that the pigment extract produced by this strain showed the maximum absorption peak at490 nm.Ultraviolet light has little effect on pigment stability.Adding proper amount of Na+,K+ and Al3+ to the pigment solution has certain color enhancement effect on the pigment and the pigment coloration effect is obvious when the salt concentration is 0.2g/mL.Considering comprehensively,the pigment produced by this strain has good stability and has wide industrial value.
Key words:Endophytic fungi;Pigment extraction;Pigment stability
内生真菌是生活或在其生活史的某一个阶段生活在健康植物体内[1-2],与植物协同进化,在进化过程中逐渐演变为共生关系的一种真菌,具有多样性,广泛分布于植物体内[3]。由于植物种类、环境条件、生长阶段等因素的不同,导致植物组织中内生真菌的数量和种类存在较大差异[4]。植物部位的不同,内生菌的种类及多样性也存在显著差异[5],内生真菌在植物体内对宿主暂时没有致病性[6],同时内生真菌之间也有着从拮抗到互利的多种共生关系[7]。
艾草又名香艾、艾萧、艾蒿等,具有驱蚊、抗菌、护肝之功效,其叶和茎部均可产生奇特香味,对具有药用价值的植物中内生真菌的研究更具研究价值。由于天然色素安全无毒,且具有一定的营养价值,深受人们喜爱[8]。内生真菌所产色素为天然色素,并且真菌色素与植物色素相比,其不受环境、气候、空间的影响[9],可以通过大规模的工业生产和发酵生产,既降低了成本,又提高了产量,增加经济效益[10-11]。本研究以艾草根块内生真菌WS-221为研究对象,对其水溶性红色素的稳定性进行了研究,为进一步研究利用该菌所产色素提供依据。
1 材料与方法
1.1 材料
1.1.1 真菌菌株来源 菌株,从野生艾草根块分离纯化得到。
1.1.2 培养基 平板使用马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200g、葡萄糖20g、琼脂20g、蒸馏水1000mL;发酵培养基(PDB):马铃薯200g、葡萄糖20g、蒸馏水1000mL。
1.1.3 仪器设备与试剂 MaxQ436大型落地式恒温摇床,美国Thermofisher公司;UV-1800紫外可见光分光光度计,日本岛津公司;HWS型智能恒温恒湿箱,宁波东南仪器有限公司;TG16-WS台式高速离心机,湘仪离心机;無水乙醇、葡萄糖、食盐、氯化镁、氯化钙等试剂均为分析纯。
1.2 方法
1.2.1 菌株发酵培养 用直径为1cm的打孔器获取生长在PDA培养基上具有8d菌龄的菌落,将菌饼置于装有150mLPDB发酵液的250mL锥形瓶中,在培养条件为28℃、转速为150r/min的条件下发酵培养15d。
1.2.2 菌株形态学观察 用镊子挑取培养基上的菌落放置于滴有蒸馏水的载玻片上进行压片,再通过生物显微镜进行观察。
1.2.3 色素提取 将发酵培养15d的菌液过滤,获得菌丝,称取菌丝1g分别溶于10mL蒸馏水和95%乙醇2种溶液中超声破碎35min,在5000r/min的转速条件下离心5min,获得红色素上清液。
1.2.4 吸收光谱曲线的测定 将获得的红色素上清液用紫外分光光度计于460~520nm范围内进行检测。使用origin软件进行分析,以确定最佳波长并测得最佳波长条件下色素在2种不同提取溶剂中的最大吸光度。
1.2.5 紫外光对红色素稳定性的影响 取红色素上清液放置在波长为210nm的紫外灯下分别照射10、20、30、40、50、60、70min,将照射的红色素上清液在490nm处测定其吸光度。
1.2.6 pH对红色素稳定性的影响 取红色素上清液,用HCl和NaOH调节pH值为2、4、6、8、10,在黑暗的条件下放置2h,在490nm处测定色素提取液的吸光度。
1.2.7 金属离子对红色素稳定性的影响 取红色素上清液配制成含不同金属离子Na+、K+、Mg2+、Ca2+、Al3+浓度均为0.5g/mL的红色素溶液,在黑暗的条件下放置0、2、4、6、8h,在490nm处测定红色素溶液的吸光度。
1.2.8 不同浓度食盐对红色素稳定性的影响 取红色素上清液将其配制成0.1g/mL、0.2g/mL、0.3g/mL、0.4g/mL、0.5g/mL的氯化钠溶液,在黑暗的条件下放置2h,在490nm处测定红色素溶液的吸光度。
2 结果与分析
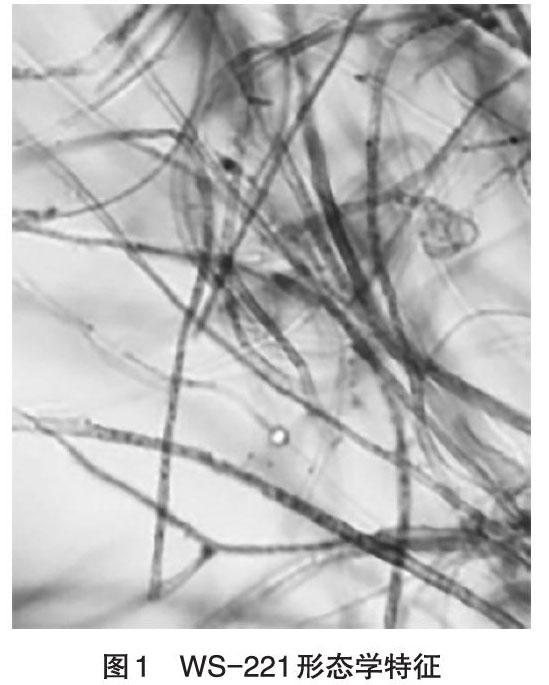
2.1 形态学特征 该菌菌落为淡红色,菌落表面湿润有凸起絮状,菌丝红色质密。其孢子存在于瓶梗上,并在顶端形成球团(图1)。
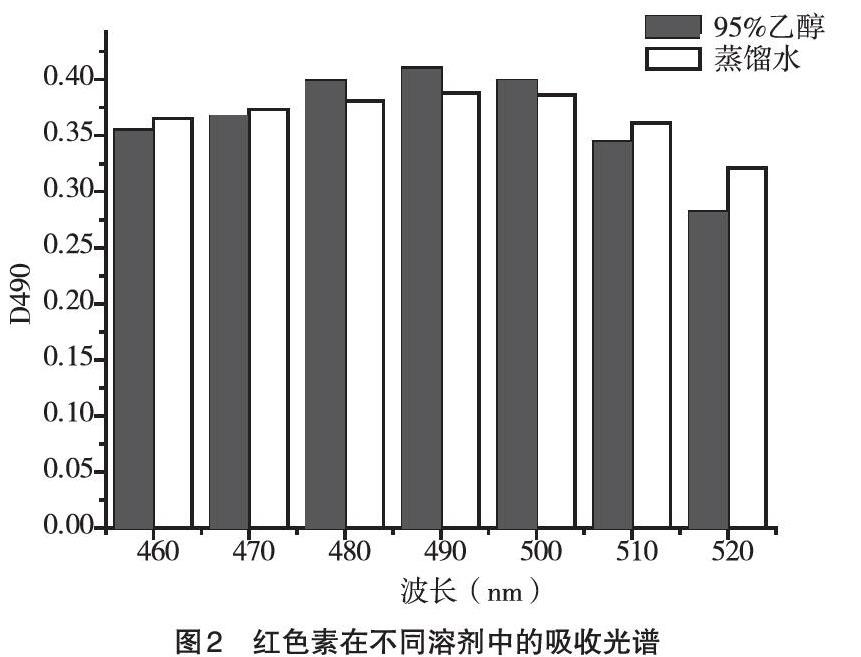
2.2 2种不同溶剂对色素提取的影响 将2种不同溶剂提取的红色素在UV1800紫外分光光度计下进行检查,结果如图2所示,波长在490nm处时出现最大吸收峰。本研究选取成本较低的蒸馏水作为溶剂提取色素,选取490nm作为该红色素的特征吸收波长,从而获得红色素提取溶液,并在D490处测得提取液的吸光度为0.388。
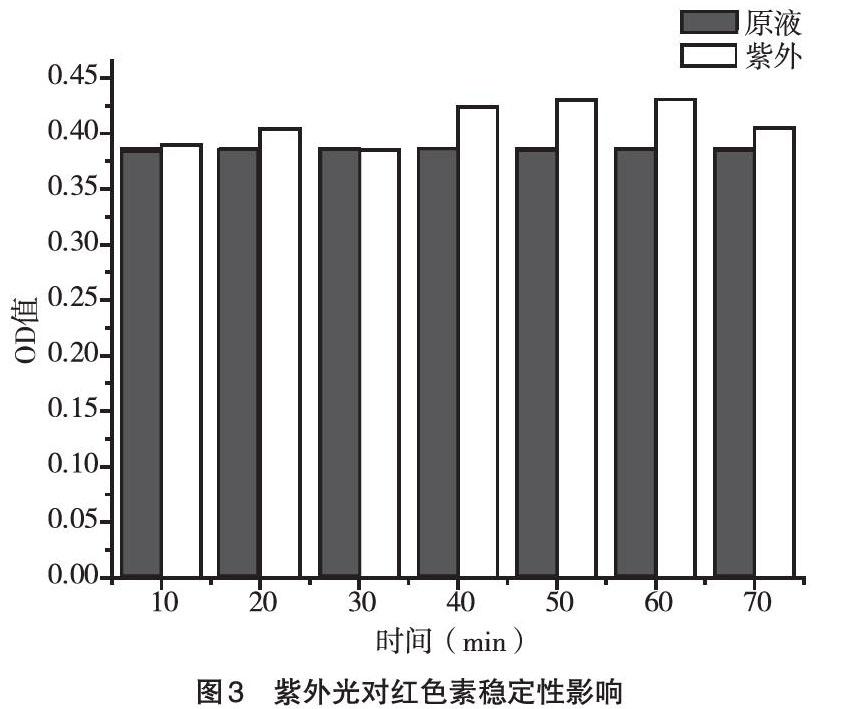
2.3 紫外光对红色素稳定性的影响 由图3所示,将红色素提取液放置于210nm紫外光下进行照射,通过控制紫外照射时间,结果显示,在不同时间照射下该色素吸光度只在较小的范围内进行波动,并且在40~70min范围内色素吸光度高于原液吸光度,说明紫外对该色素稳定性影响较小,而且在一定条件下还具有增色作用。故该色素具有较好的抗紫外能力。
2.4 pH对红色素稳定性的影响 由图4可知,该色素对pH较为敏感,当pH为6时提取液吸光度与原液持平,当pH在2~4范围内时出现较小值,且在pH为2时色素稳定性最差,说明在酸性条件对色素的稳定性影响较大。碱性条件对色素稳定性有一定影响,但对碱性条件的对抗性比酸性条件强,说明该色素的耐酸性较差。故在实际应用的过程中,应尽量避免酸性物质的使用。
2.5 金属离子对色素稳定性的影响 由表1可知,在红色素溶液中添加各种金属离子之后,在不同的时间段部分金属离子对色素的吸光度存在一定的影响。溶液中添加Na+、Ca2+、Al3+、Mg2+之后,在2h时达到最大值,并在4~8h范围内色素存在较小的波动。在红色素溶液中添加K+之后,在0h时有最大值,在2~8h范围内色素的吸光度减小,增色效果存在一定的变化。说明Na+、K+、Al3+在短时间内对该色素具有增色作用。
2.6 不同浓度的食盐对色素稳定性的影响 由图5所示,该色素在NaCl浓度为0.2g/mL时出现最大值,当Na+濃度在0.3~0.5g/mL时,其吸光度缓慢增加,且整体吸光度大于原液吸光度,说明Na+浓度对该色素有一定影响,但其影响有限,并且在红色素提取液中加入食盐对色素有一定的增色作用。故在工业生产过程中适量加入食盐可以起到增色效果。
3 结论
从野生艾草中分离出来的产红色素内生真菌WS-221在PDA固体培养基培养的前期菌丝为白色,培养5d左右菌丝变为淡红色,背面为红色,在摇瓶培养15d左右色素产量达到最大,在之后的培养过程中色素产量几乎不变。实验表明,紫外对该真菌产生的红色素的稳定性影响较小,并且红色素的吸光度只在较小的范围内进行波动;在pH为6~10时存在一定的稳定性,且在pH为6时色素吸光度几乎与原液相同;在色素溶液中添加Na+、K+、Al3+之后,在短时间内具有一定的增色作用;不同浓度的食盐对该色素有一定的影响,且在0.2g/mL出现最大值,具有较好的增色作用,故在生产利用该色素时可以添加一定量的Na+,以提高其色泽。如今具有保健功能的天然红色素应用于食品、化妆品、医药等领域引起了人们的广泛关注[12],对天然色素稳定性的研究具有广泛的工业价值。
参考文献
[1]Wilson D.EndopHyte:the evolution of a term,and clarification of its use and definition[J].Oikos,1995,73(2):274-276.
[2]Rodriguez R J,White J F,Redman R S,et al.Fungal endopHytes:diversity and functional roles[J].New Phytologist,2009,182:314-330.
[3]GUO LD.Advances of researches on endophytic fungi[J].Mycosystema,2001,20(1):148-152.
[4]Aly A H,Debbab A,Proksch P.Fungal endophytes:unique plant inhabitants with great promises [J].Applied Microbiology and Biotechnology,2011,90(6):1829-1845.
[5]廖秋红,李艳冰,李琴,等.滇重楼(Paris polyphylla var. yunnanensis)的内生细菌的分离与鉴定[J].分子植物育种,2018,16(18):6156-6160.
[6]Petrni Q.Fungalendophytes of tree leaves[A]//In:Andrews J H ,Hira-no S.Microbial Ecology of Leaves Andrews .Germany:SpringerVerag,1991:179-197.
[7]Felitti S,Shields K,Ramsperger M,et al.Transcriptome analysis of Neotyphodium and Epichloe grass endophytes[J].Fungal Genetics and Biology,2006,43:465-475.
[8]瞿霭堂.藏语韵母研究[M].西宁:青海民族出版社,1991.
[9]韩亚蓉.一种经济、高效的提取微生物胞内色素的方法[J].现代生物医学进展,2008(03):521-522.
[10]郑晨娜,方柏山,罗菊香,等.链霉菌G-HD-4产黑色素的提取及理化性质[J].华侨大学学报,2009,30(03):292-296.
[11]丘振宇,王亚琴,许喜林.红曲霉的特点及应用研究[J].食品工业科技,2006(12):186-188.
[12]侯敏,周端顼,王艳新,等.红曲霉的研究进展[J].安徽农业科学,2014,42(11):3382-3384.
(责编:张宏民)
