单硝酸异山梨酯缓释片对慢性高原病模型大鼠多脏器损伤的改善作用
2019-04-18迪丽努尔买买提依明伊力亚尔尼加提是文辉张向阳艾尼娃尔艾克木
杨 涛, 迪丽努尔·买买提依明, 伊力亚尔·尼加提, 是文辉, 张向阳, 艾尼娃尔·艾克木
(1新疆医科大学中心实验室, 乌鲁木齐 830011; 2新疆医科大学第一附属医院综合心脏内科, 乌鲁木齐 830054;3兰州军区乌鲁木齐总医院新疆特殊环境医学重点实验室; 4新疆医科大学基础医学院, 乌鲁木齐 830011)
慢性高原病(Chronic high altitude sickness,CMS,又称蒙赫病)是指进入高海拔地区半年后方才患病,或者先前所患急性高原病(AMS)长时间未治愈者,少数高原世居者也可发病[1]。其致病因素主要是缺氧、寒冷、太阳辐射等,常表现为肺动脉高压及严重的组织缺氧[2-3]。由于脑细胞处于较高能量代谢水平、对氧气的需求量大,导致大脑皮质对低氧的耐受程度最差。当急性缺氧时,脑血管代偿性扩张、使血流量增加、颅压升高,此后代偿性出现呼吸加快、加深、心跳加快,心输出量增加[4]。当机体持续供氧不足时,脑细胞无氧代谢加强甚至完全依赖无氧代谢,ATP合成降低,Na+-K+-ATP酶强度减弱,引起脑细胞内钠水潴留。此外,当机体处于持续氧气供应不足环境中,血液中氧气含量不足,可刺激颈动脉体,导致呼吸程度加深、频率加快。与此同时,过度通气可使体内的CO2呼出过度,最终导致机体出现呼吸性碱中毒[5-6]。机体供氧不足还可使肺细小血管发生强烈收缩,肌肉型细动脉中层平滑肌增厚,导致肺循环压力升高,肺微小血管网静脉压力显著升高,通透性升高,血浆渗出而导致肺水肿的发生[7-10]。单硝酸异山梨酯缓释片(Isosorbide Mononitrate Sustained Release Tablets,IMSRT)是新型治疗心绞痛药物,其不仅可以扩张全身静脉血管,同时还可扩张动脉血管,进一步降低后负荷,降低血压[11]。本研究以慢性高原病模型大鼠为基础,研究单硝酸异山梨酯缓释片对慢性高原病所致多脏器损伤的保护作用,现报道如下。
1 仪器与试药
1.1仪器Multiskan Go型全波长酶标仪(美国赛默飞世尔科技公司),1575型微孔板洗板机(美国伯乐生命医学产品有限公司),3-18k型高速低温离心机(德国西门子公司),SAR-830型小动物呼吸机(上海玉研科学仪器有限公司),西北特殊环境人工实验舱(新疆特殊环境医学重点实验室)。
1.2试药单硝酸异山梨酯缓释片(英国阿斯利康公司,批号1206085),硝苯地平片(山西云鹏制药有限公司,批号 C120304),大鼠T-SOD ELISA kit(批号 20130410)、大鼠MDA kit(批号 20130409)、大鼠GSH-PX ELISA kit(批号 20130401)均购自中国南京建成生物工程研究所。
1.3动物SD大鼠60只,体质量(180±20) g,购于新疆医科大学动物中心,动物许可证号:SCXK(新)2011-0004。
1.4方法
1.4.1 SD大鼠慢性高原病模型的建立 将60只SD大鼠随机抽取50只,放于模拟海拔5 000 m高原环境的西北特殊环境人工实验舱,进行慢性高原病的建立,每天放置22 h,连续造模30 d,剩余10只SD大鼠,放入平原环境中,饲养于新疆医科大学动物中心。
1.4.2 分组与给药方法 将50只慢性高原病SD大鼠随机分为:模型组(MG,蒸馏水4 mL/kg体质量),阳性药物组(NE,硝苯地平片2.7 mg/kg体质量),单硝酸异山梨酯缓释片高、中、低剂量组(HIMSRT、MIMSRT、LIMSRT,3.24、1.62、0.81 mg/kg体质量)。平原环境中10只SD大鼠为正常组(CG,蒸馏水4 mL/kg体质量),各组大鼠连续灌胃15 d。
1.4.3 指标的测定
1.4.3.1 大鼠肺动脉压力的测定 将各组SD大鼠常规麻醉后,固定于手术台,打开胸腔,使肺和心脏完全暴露,用充满肝素化生理盐水(浓度25U/mL)的7号针头插入肺动脉,通过生物信号仪测定肺动脉压力,记录实验结果。
1.4.3.2 大鼠组织的病理学改变 于实验第46天将大鼠处死,摘取肺、大脑、肾脏等组织,将各组织制为石蜡切片,使用苏木精-伊红染色,在光学显微镜观察各组织的形态结构变化。
1.4.3.3 大鼠组织中MDA、SOD与GSH-PX含量的测定 将大鼠肺、肾脏进行均匀化处理,制作成10%的混悬液,在4℃下3 000 r/min,离心20 min,弃去沉淀,进行SOD、GSH-PX 、MDA的活性及含量测定。

2 结果
2.1各组大鼠肺动脉压力的测定结果与CG组大鼠比较,MG、NE、IMSRT各剂量组大鼠PAP均升高,差异有统计学意义(P<0.05)。与MG组大鼠比较,NE、IMSRT各剂量组大鼠PAP均降低,差异有统计学意义(P<0.05)。与NE组大鼠比较,IMSRT各剂量组大鼠PAP升高,差异有统计学意义(P<0.05),见表1。
2.2大鼠各组织的病理学检查结果
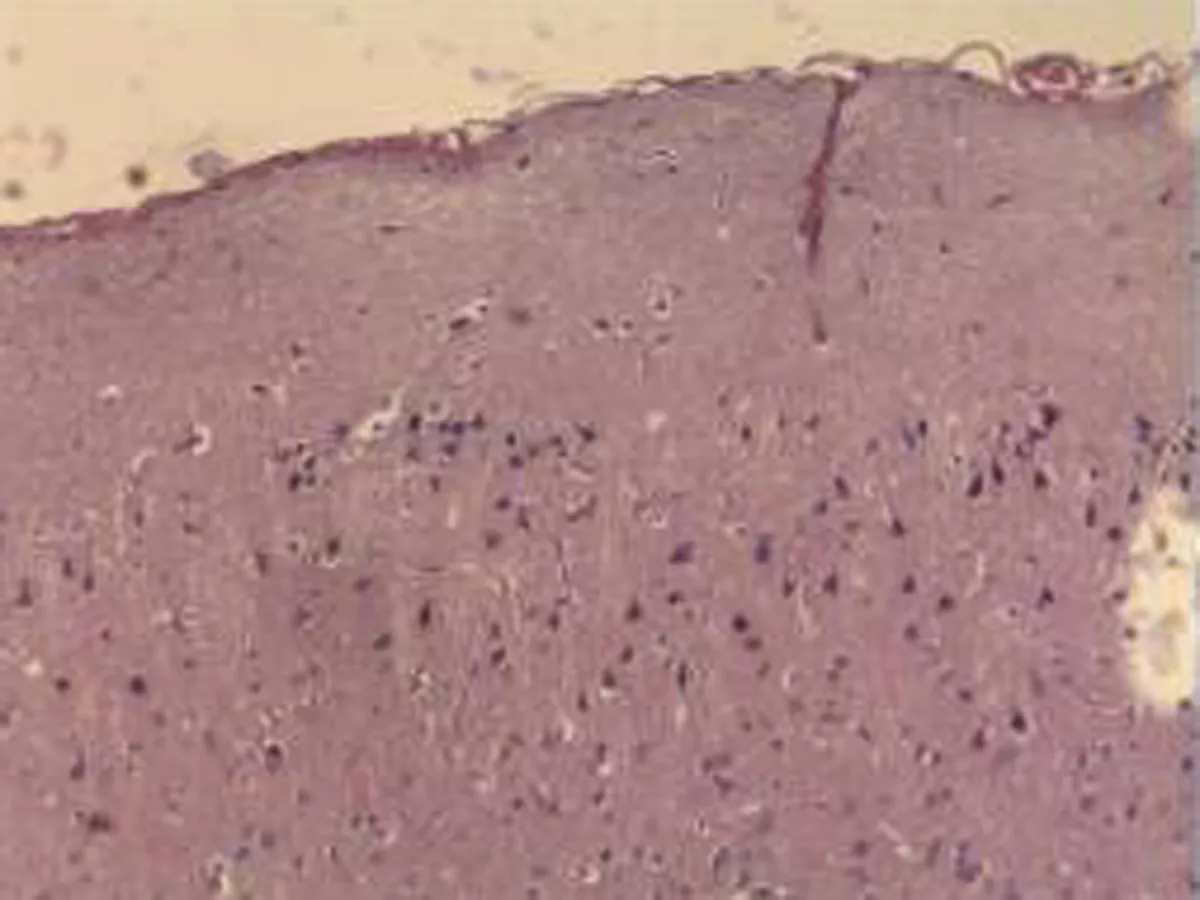
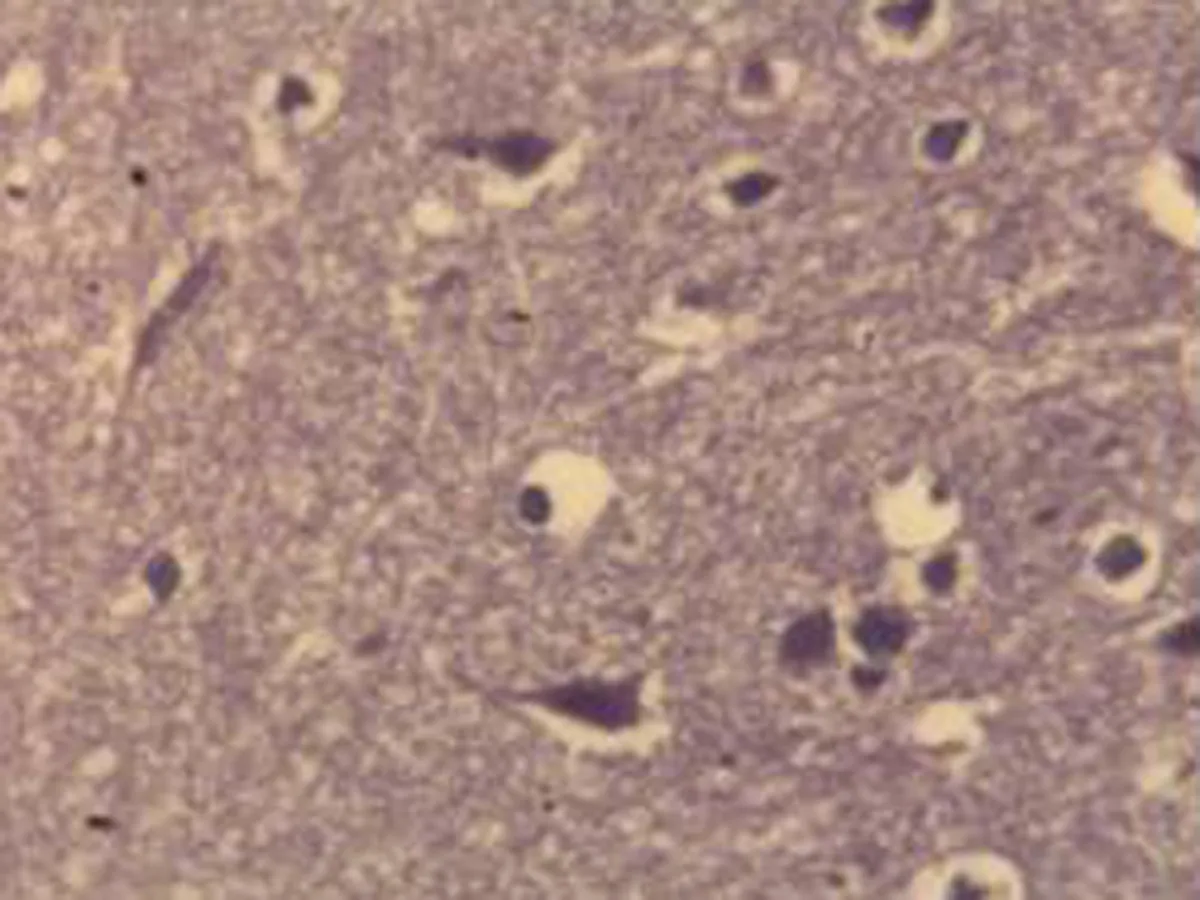
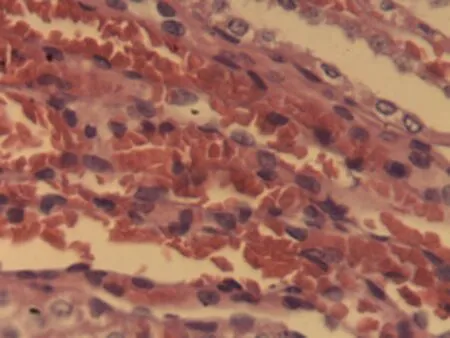
2.2.1 脑组织病理学检查结果 大鼠脑组织在光镜下观察可见,CG组大鼠:脑膜结构清晰、厚度正常,脑膜下、蛛网膜血管未见异常,分子层(ML)、外颗粒层(EGL)、外锥体细胞层(EPL)均未见发生改变;MG组大鼠:脑膜厚度明显增加,脑膜下及蛛网膜血管均明显充血,脑深部可见血栓形成,脑细胞间质略微肿胀, ML、 EGL、EPL可见略微肿胀及部分EPL发生嗜酸性病变;NE组大鼠:大脑脑膜厚度轻微增加,蛛网膜下血管偶尔可见扩张充血,EPL偶尔可见散点样嗜酸性病变,偶见脑实质中部分血管扩张充血并伴有血栓;LIMSRT组大鼠:脑膜结构完整,脑膜下偶见血管轻度扩张,少量ML、EGL、EPL细胞略微水肿,EPL偶见少量嗜酸性改变;MIMSRT组大鼠:脑膜结构完整,脑膜下血管未见扩张充血,脑细胞间质轻度水肿,ML细胞明显水肿;HIMSRT组大鼠:脑膜结构完整、血管扩张减轻,细胞间质水肿有所减弱,见图1。
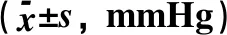
表1 各组大鼠肺动脉压力的测定结果
注:与CG组比较,aP<0.05; 与MG组比较,bP<0.05; 与NE组比较,cP<0.05。
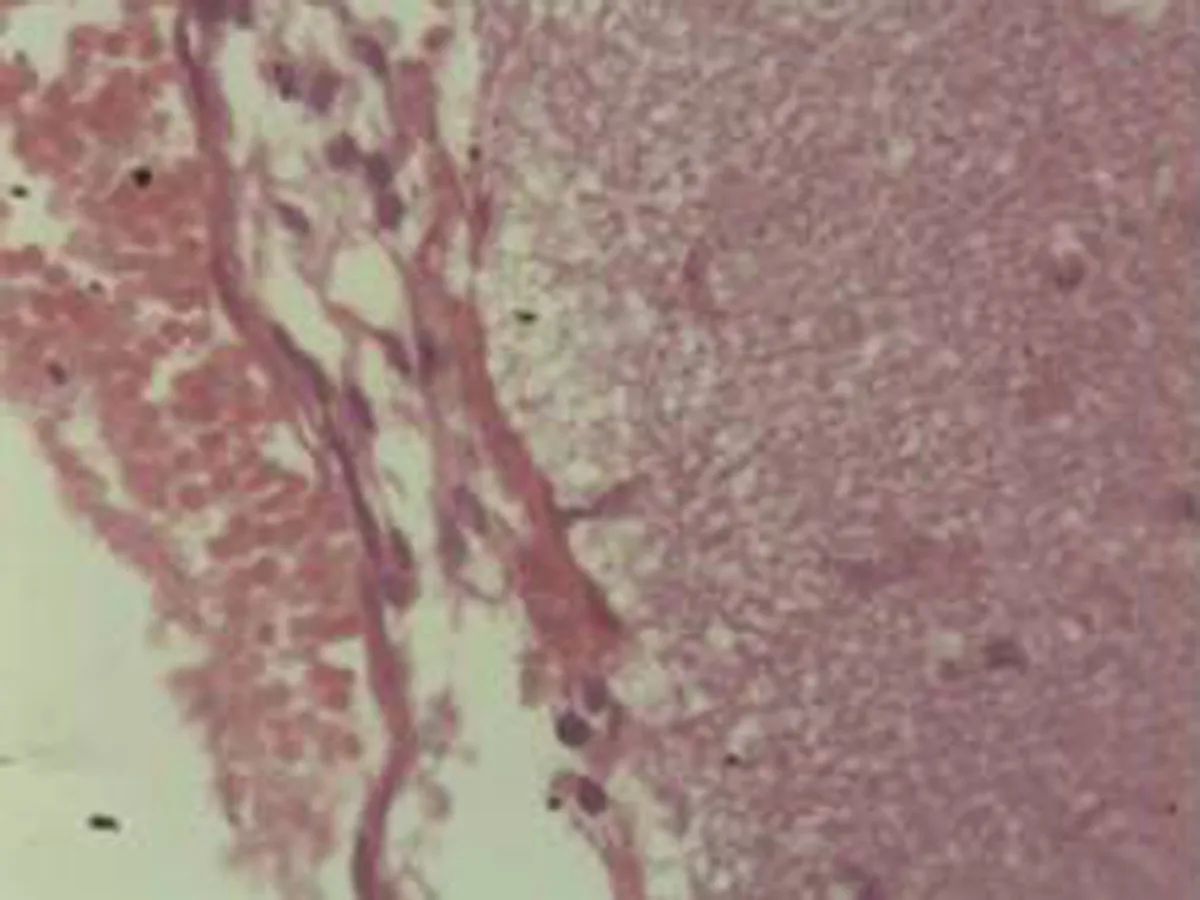
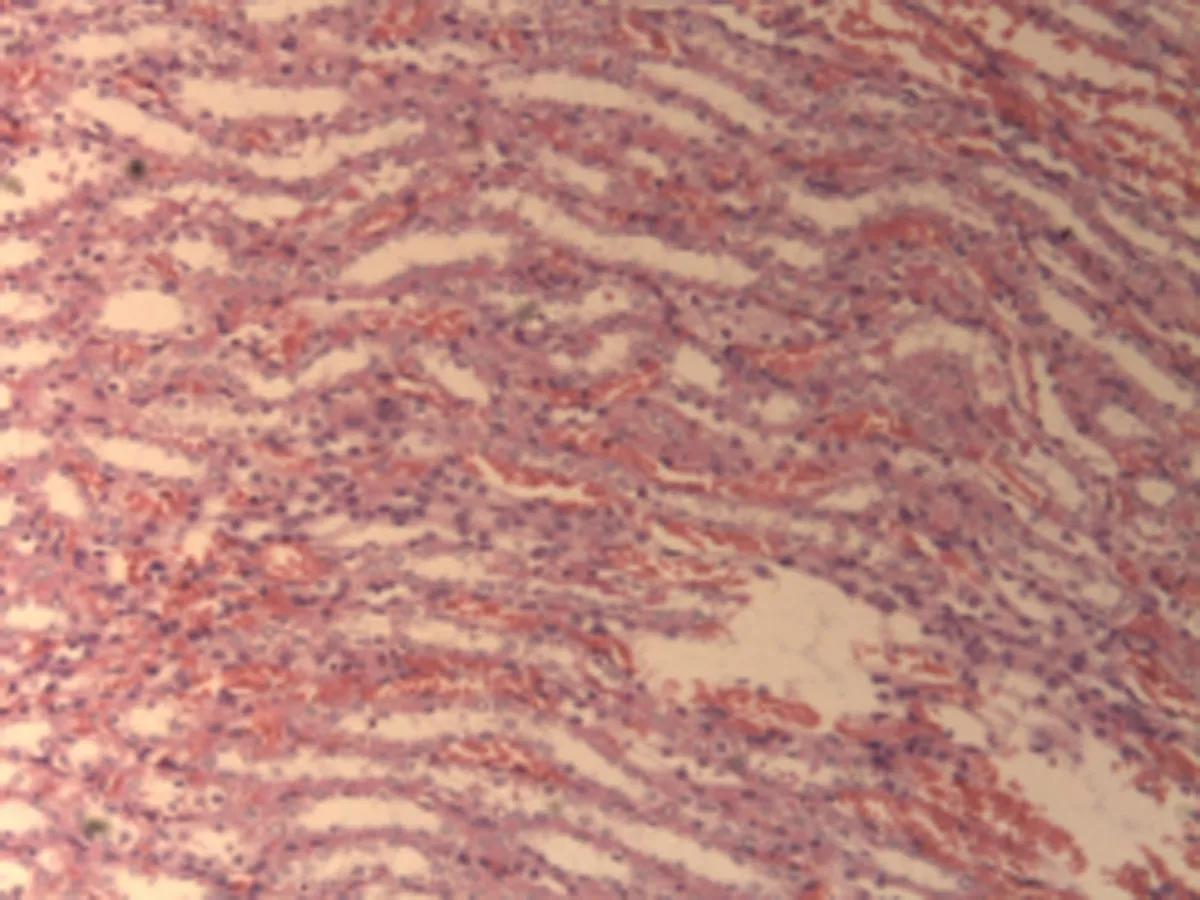
2.2.2 肺组织病理学检查结果 大鼠肺组织在光镜下观察可见,CG组大鼠:肺结构完整,未发现异常病变;MG组大鼠:大量肺泡结构被破坏,病变部位实变成片状结构;NE组大鼠:部分肺泡间隔明显增生,但轻于模型组,病变部位形成片状结构,肺间质水肿及肺泡轻微出血;LIMSRT组大鼠:少量肺泡间隔轻微增生,偶见肺间质水肿,并有较多炎细胞浸润以及肺泡出血;MIMSRT组大鼠:少量肺泡间隔轻微增生,有轻微肺萎陷,间质血管轻度扩张充血;HIMSRT组大鼠:肺泡壁较薄,肺泡壁偶而可见萎陷改变,肺泡腔清晰,未见其他异常,见图2。
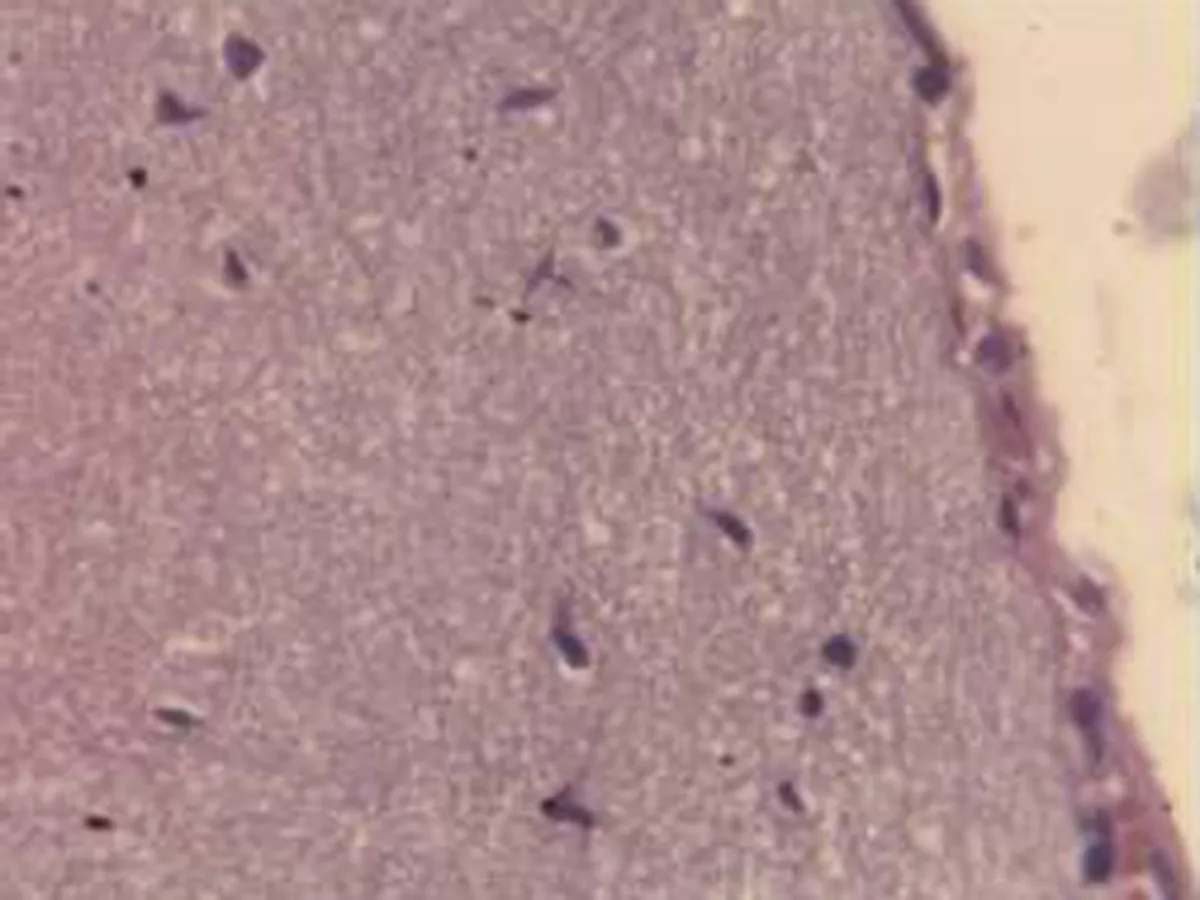
CG组(×100) CG组(×400) MG组(×100) MG组(×400)
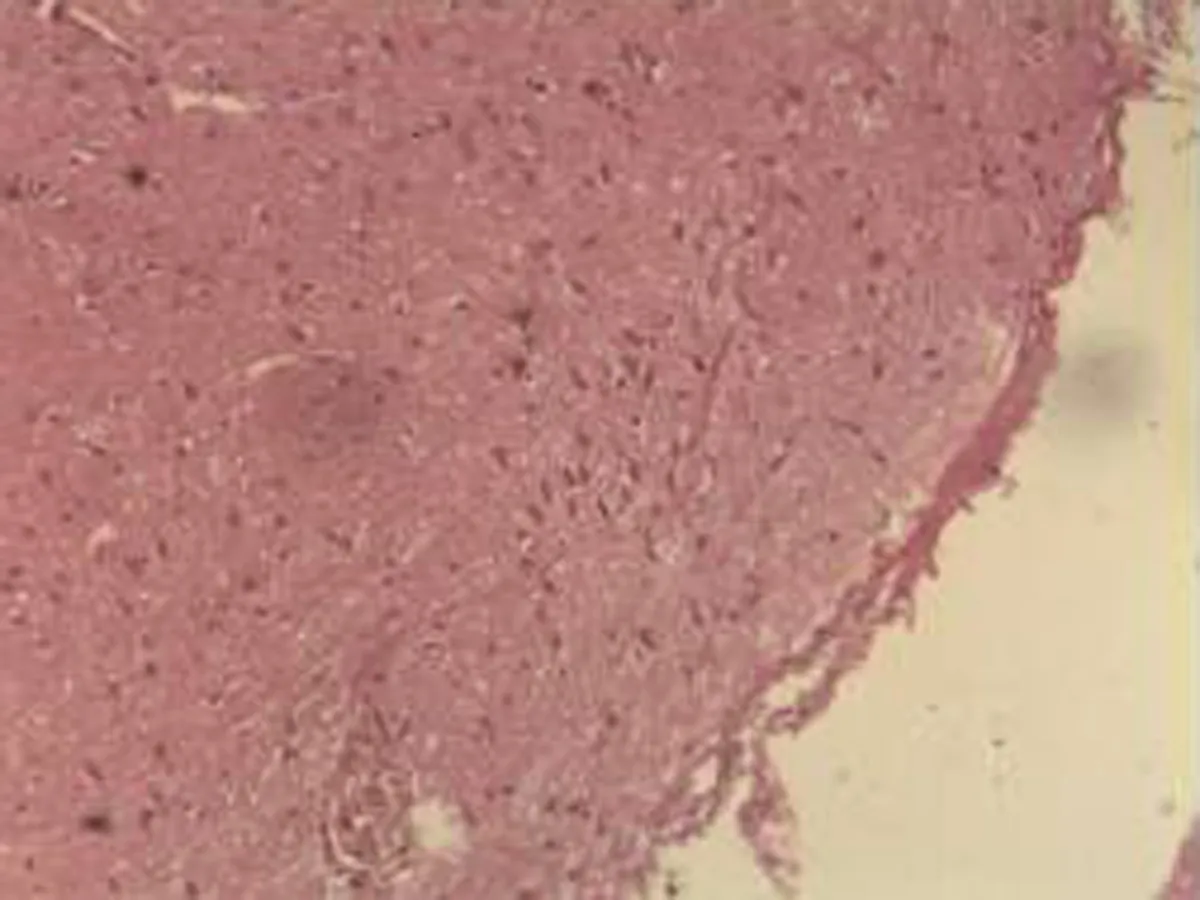
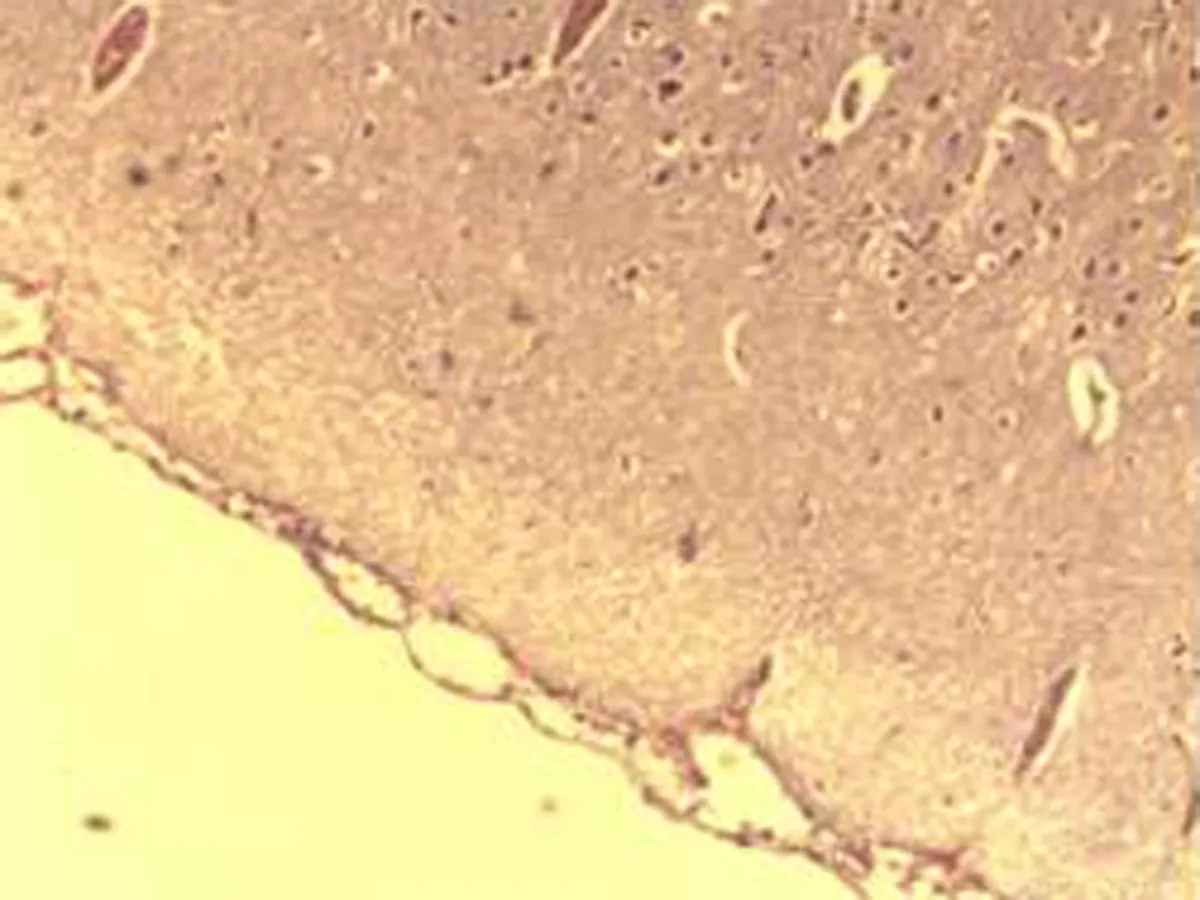
NE组(×100) NE组(×400) HIMSRT组(×100) HIMSRT组(×400)
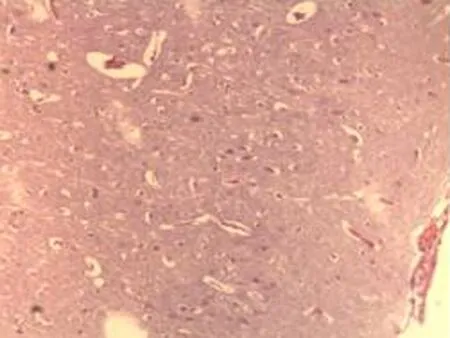
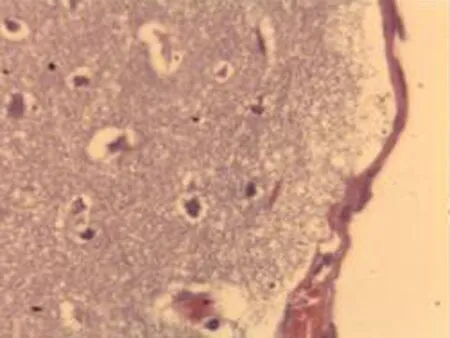
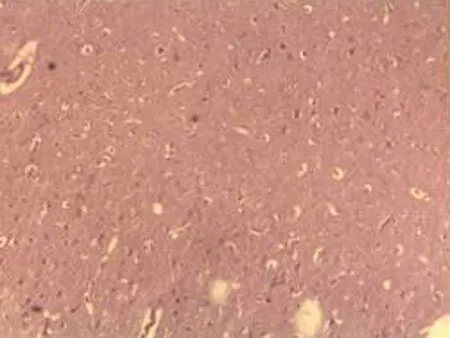
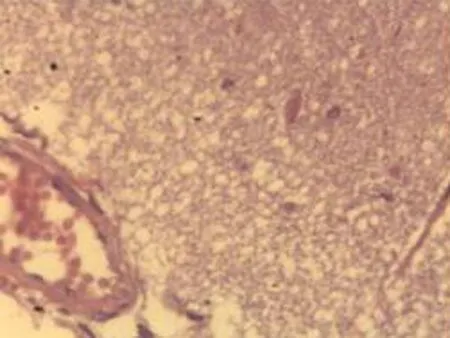
MIMSRT组(×100) MIMSRT组(×400) LIMSRT组(×100) LIMSRT组(×400)
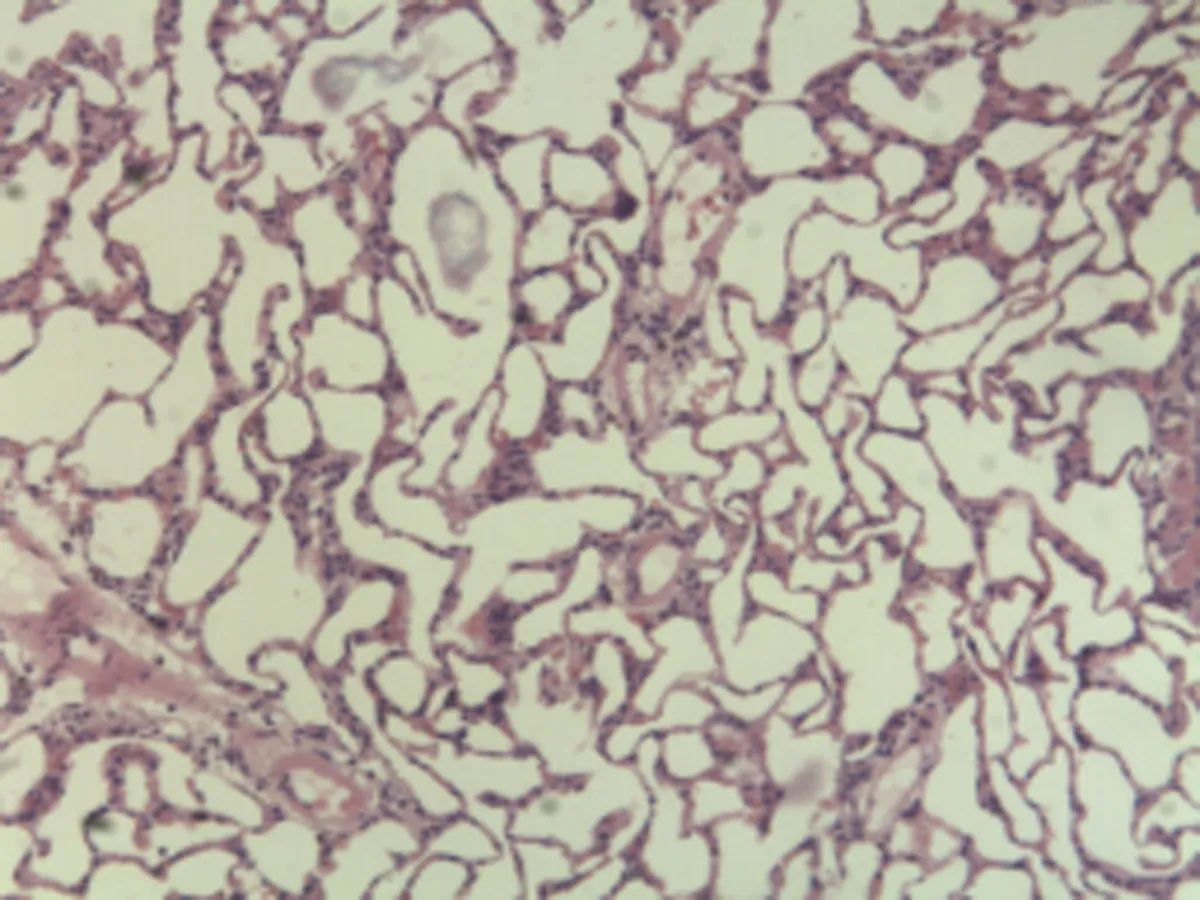
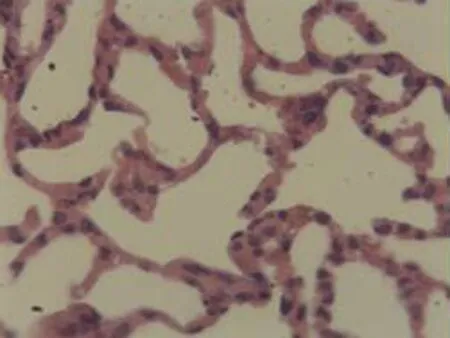
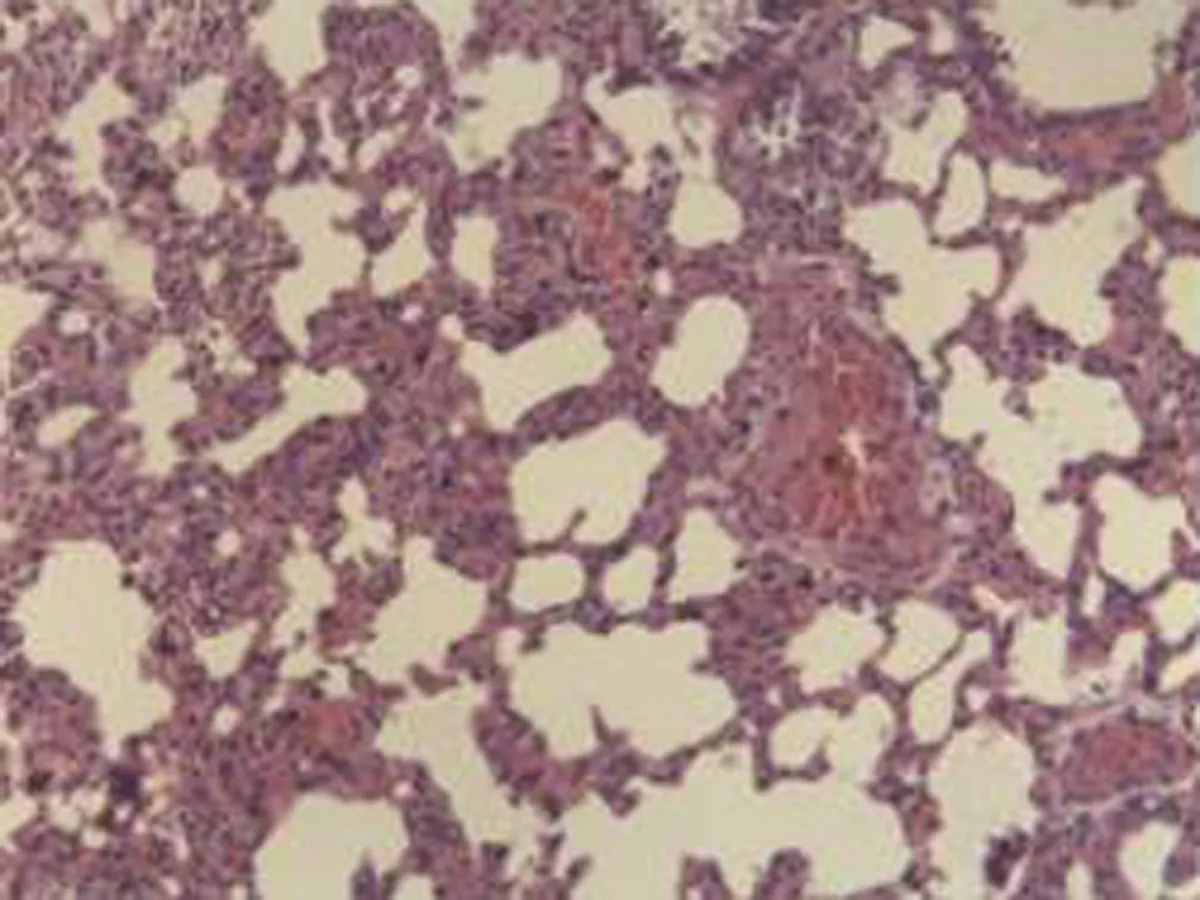
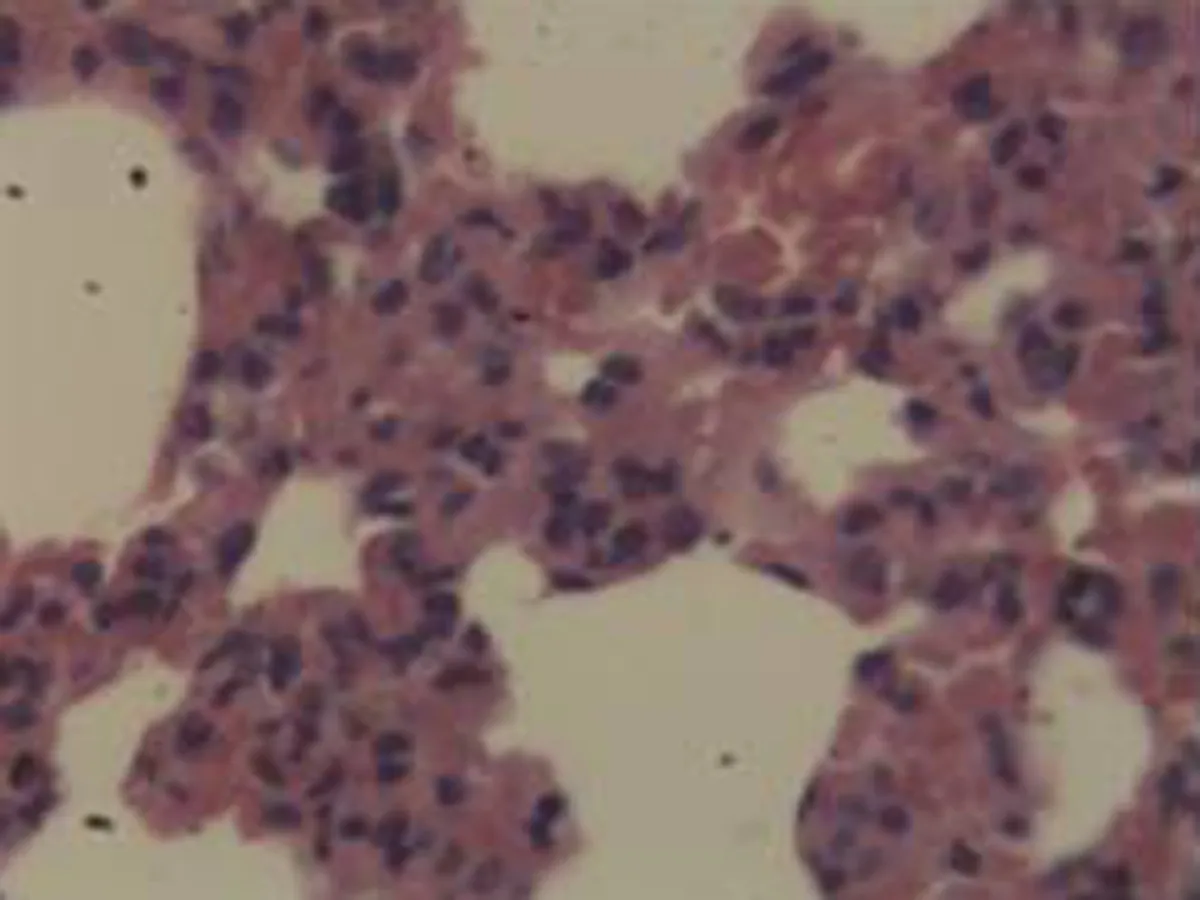
CG组(×100) CG组(×400) MG组(×100) MG组(×400)
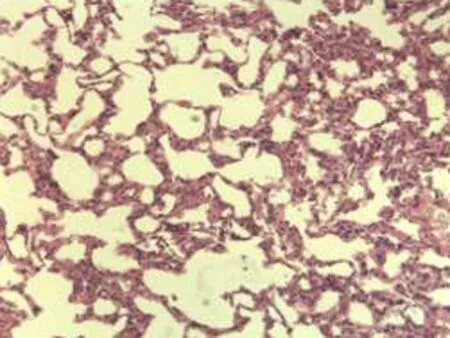
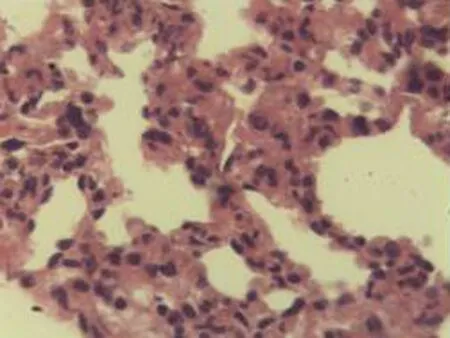
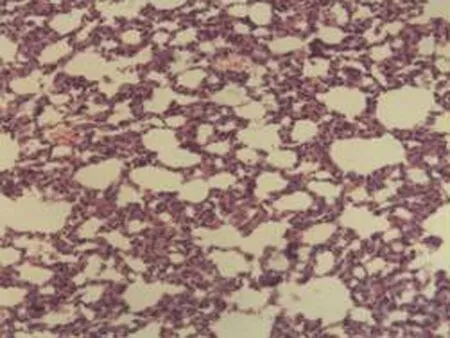
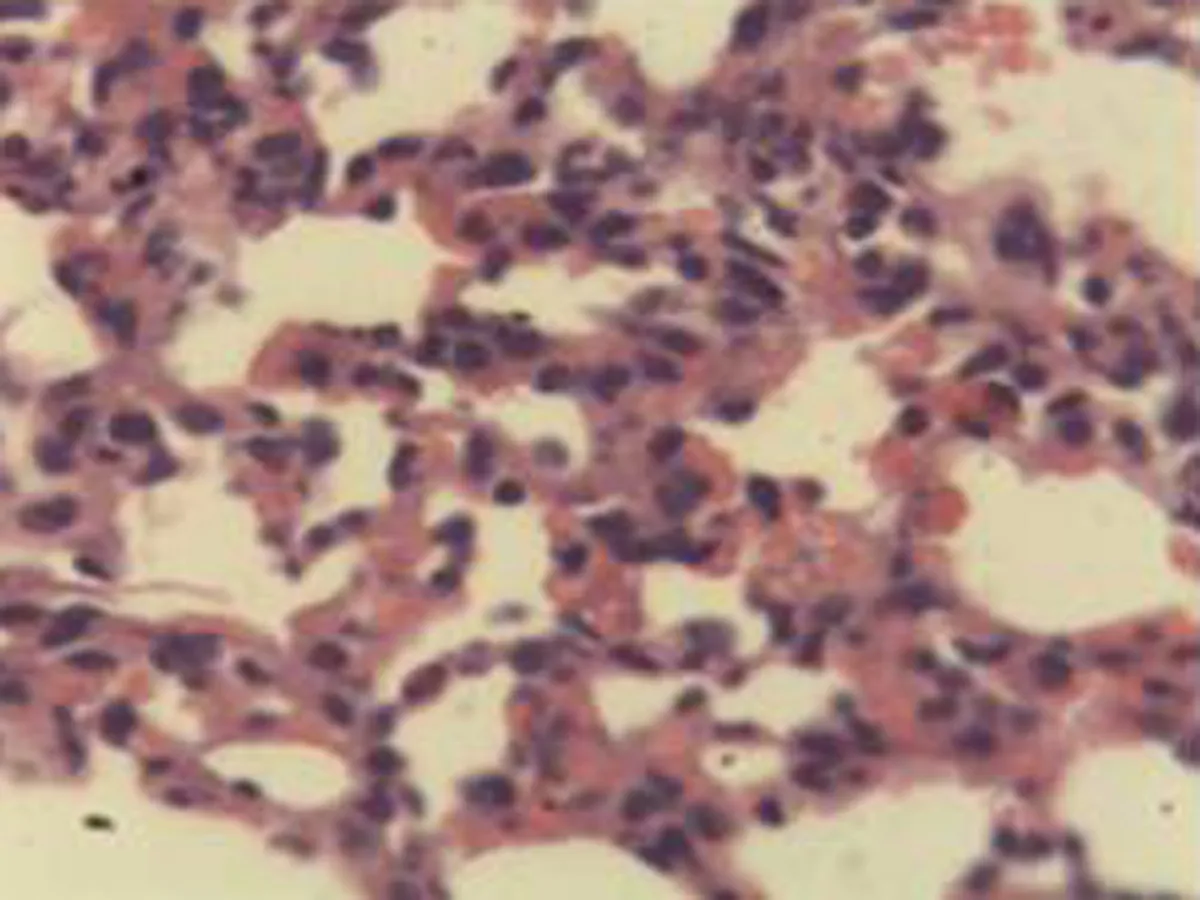
NE组(×100) NE组(×400) LIMSRT组(×100) LIMSRT组(×400)
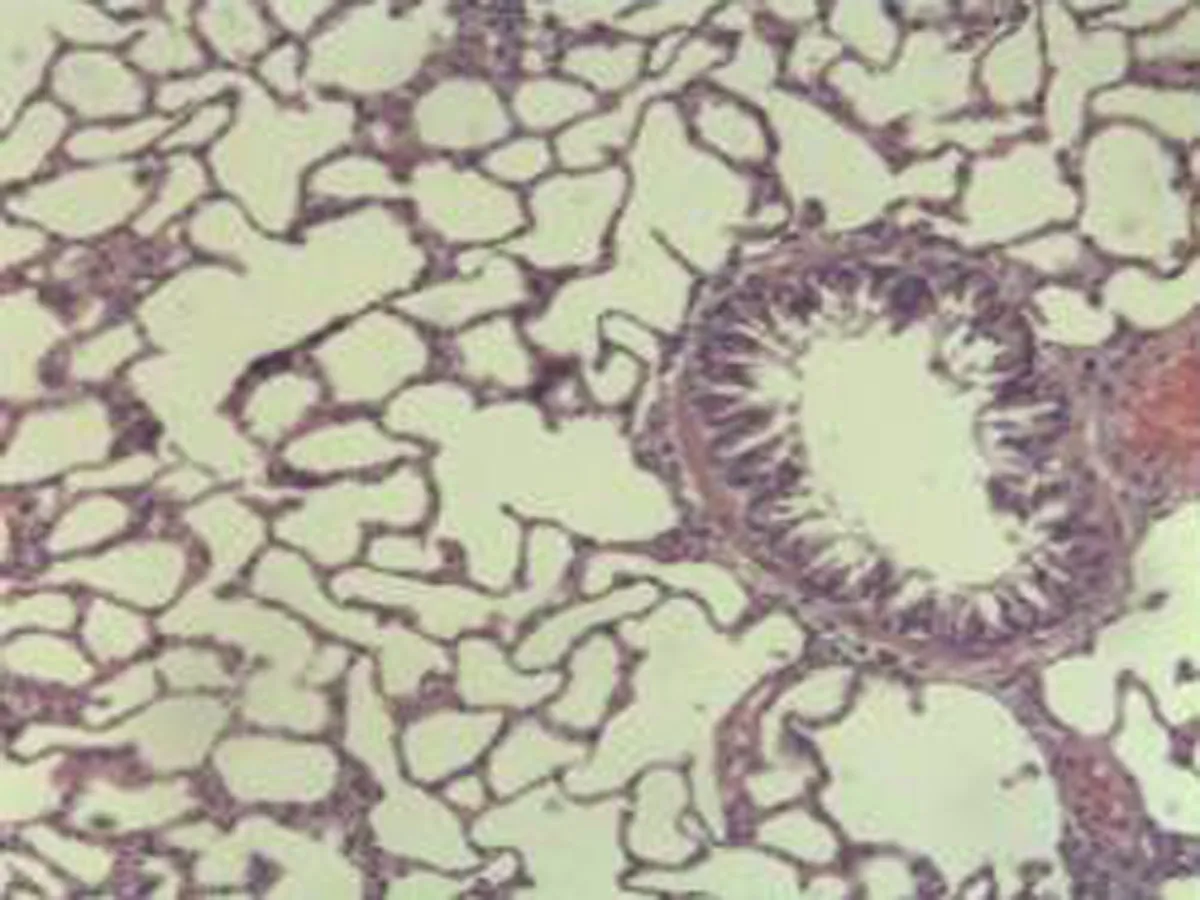
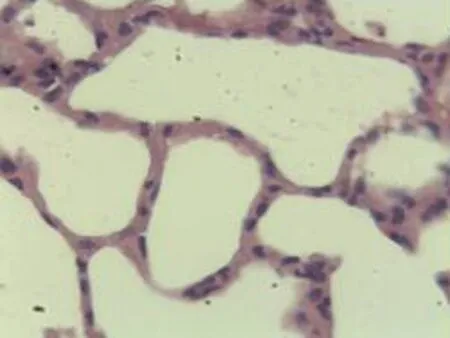

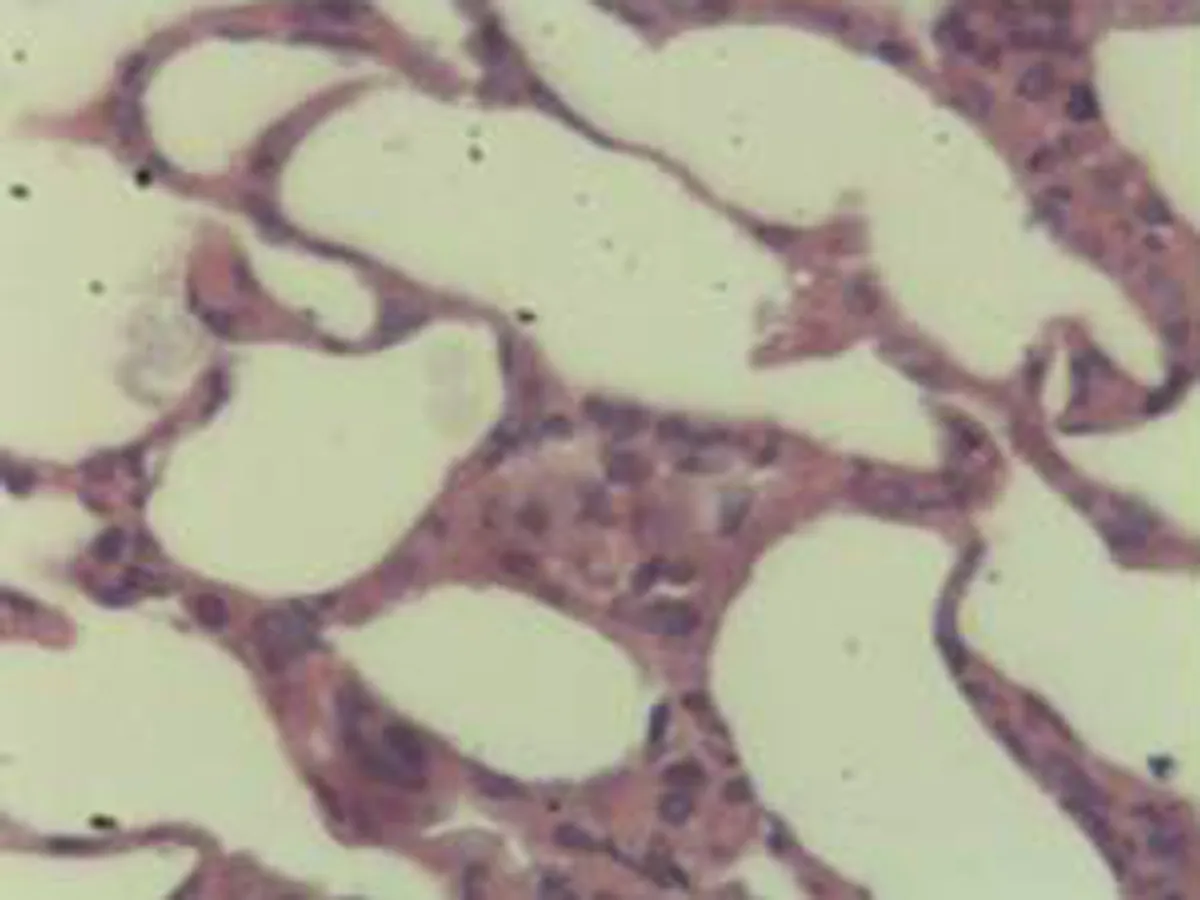
MIMSRT组(×100) MIMSRT组(×400) HIMSRT组(×100) HIMSRT组(×400)
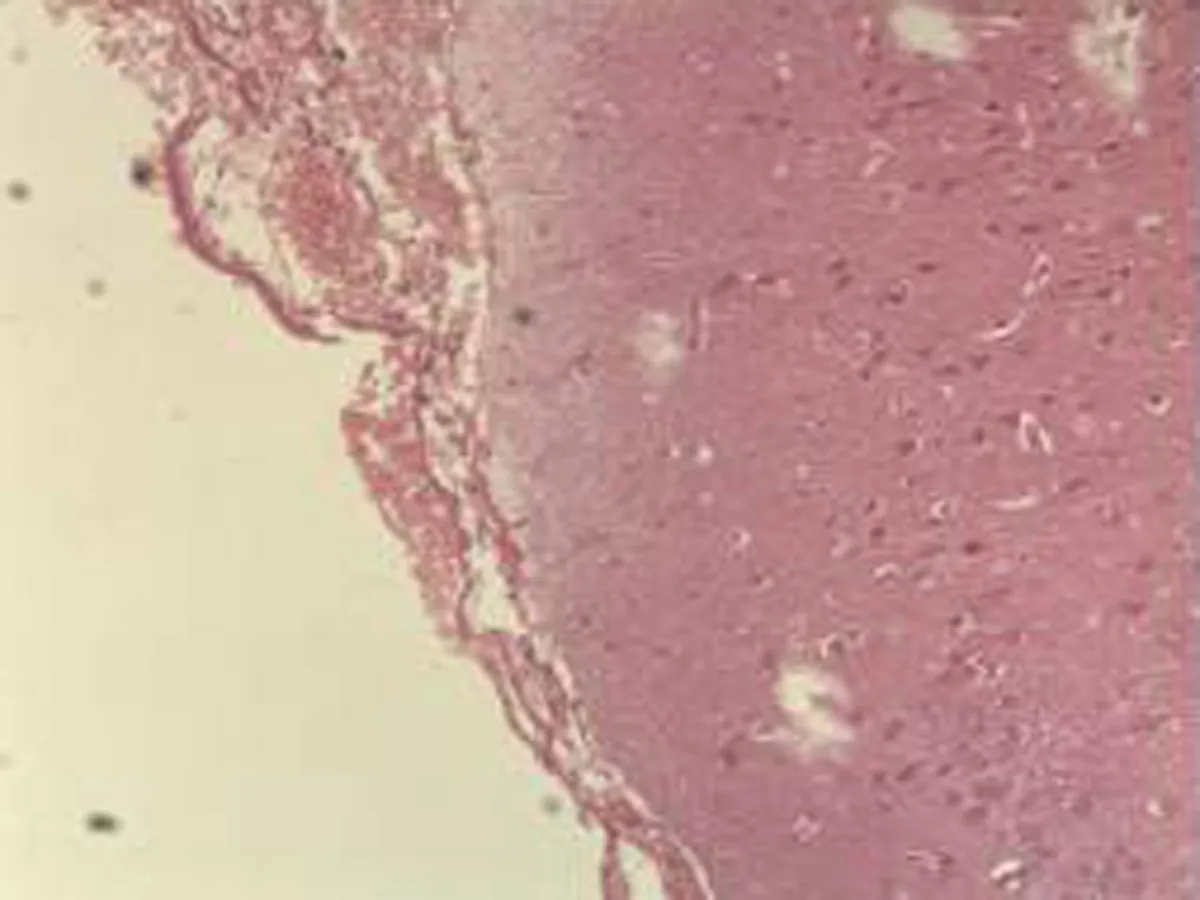
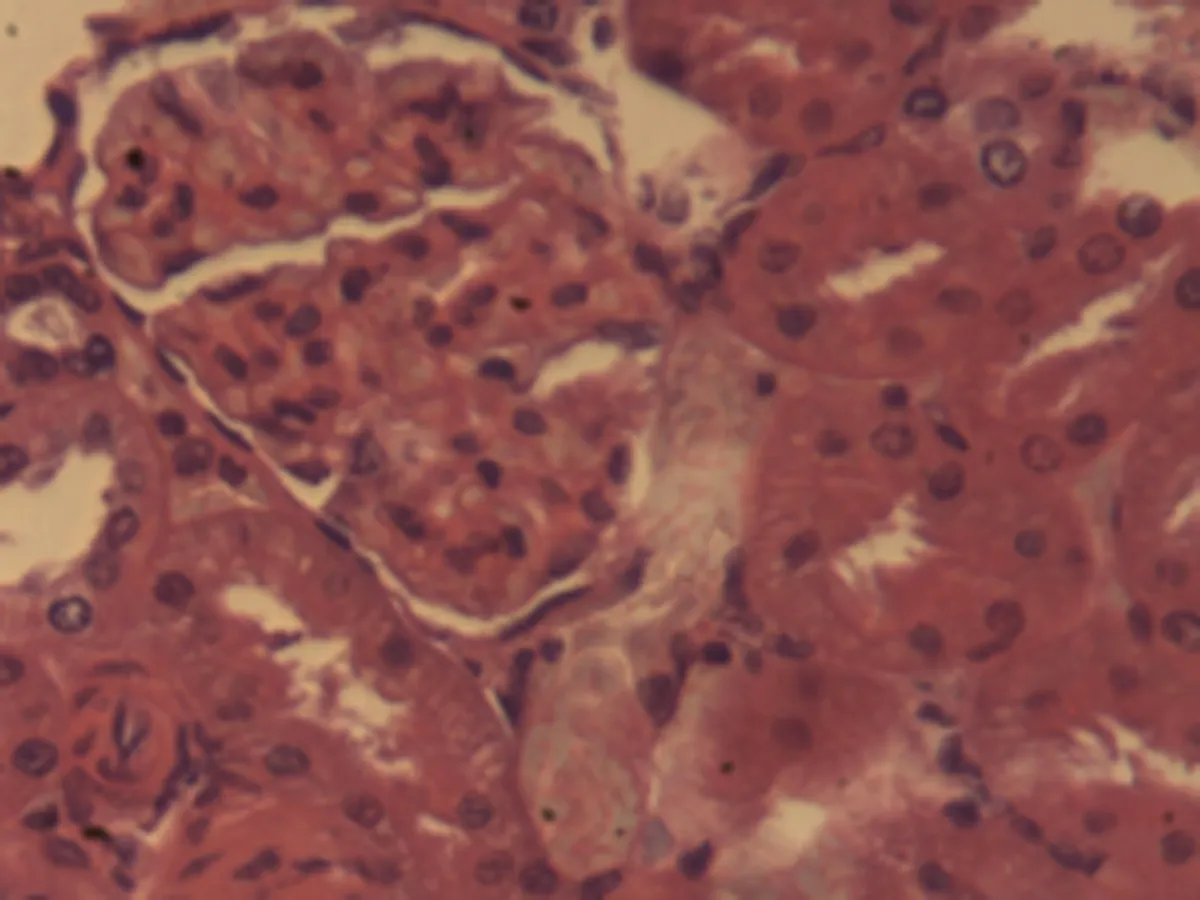
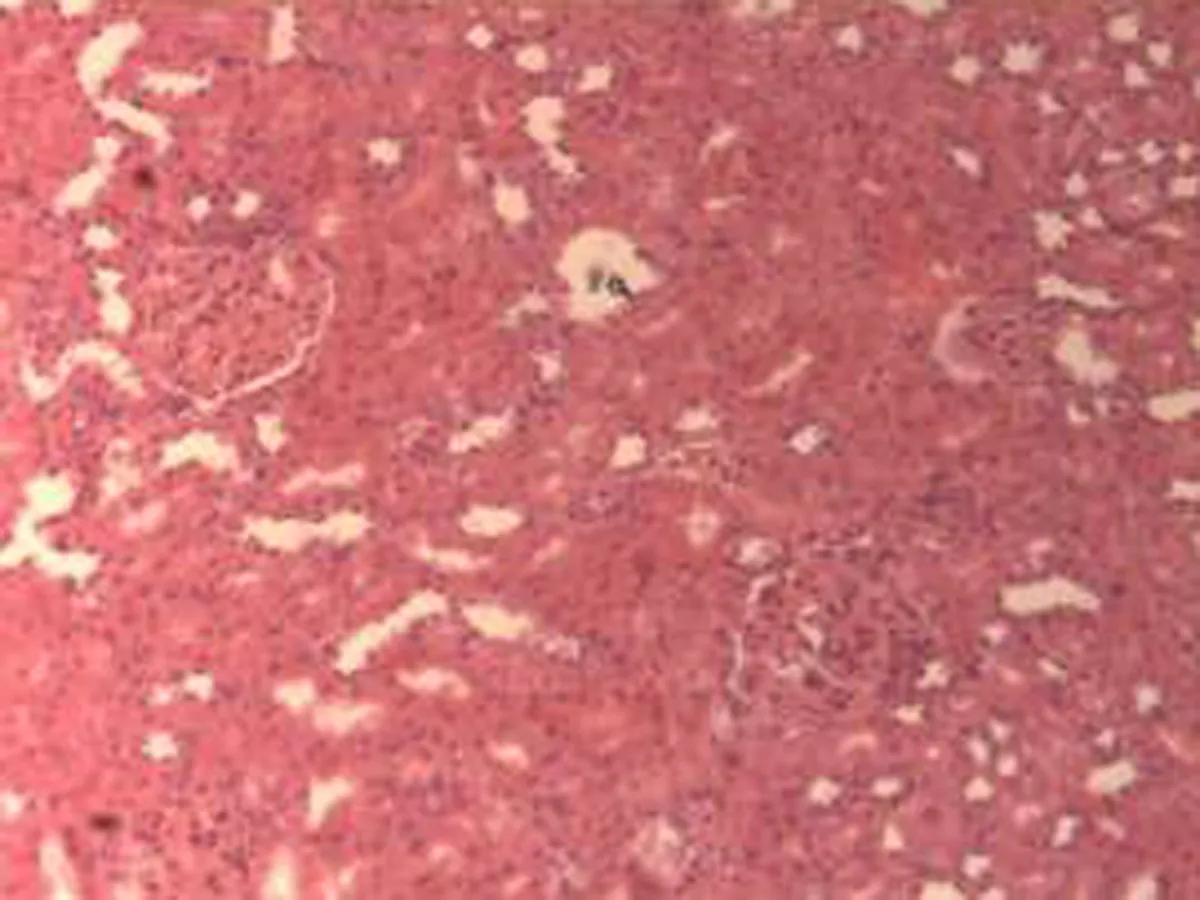
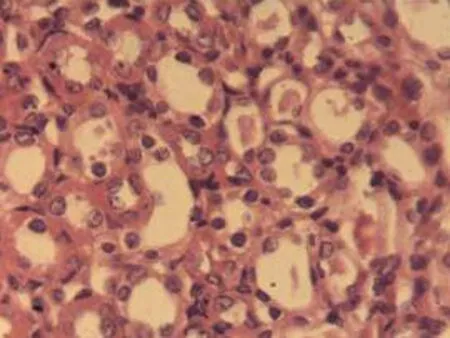
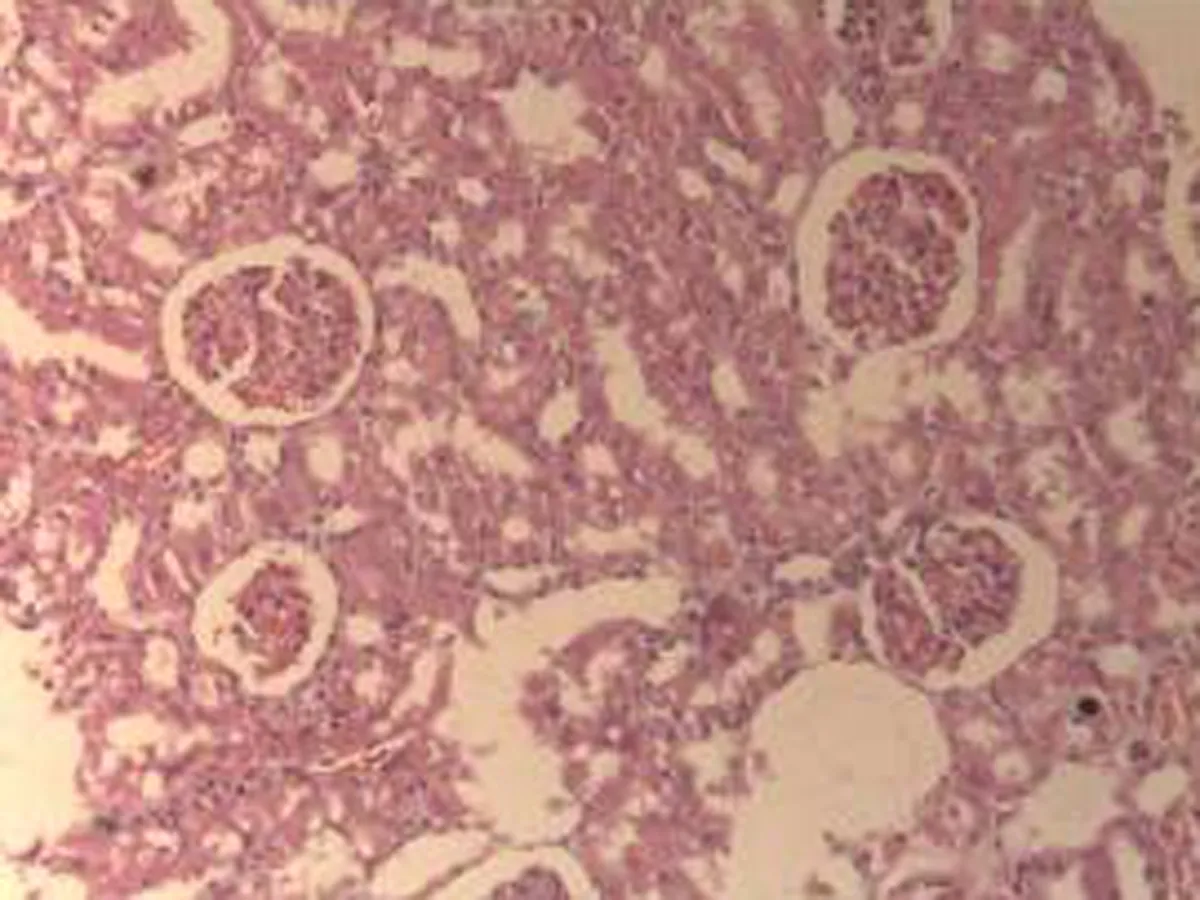
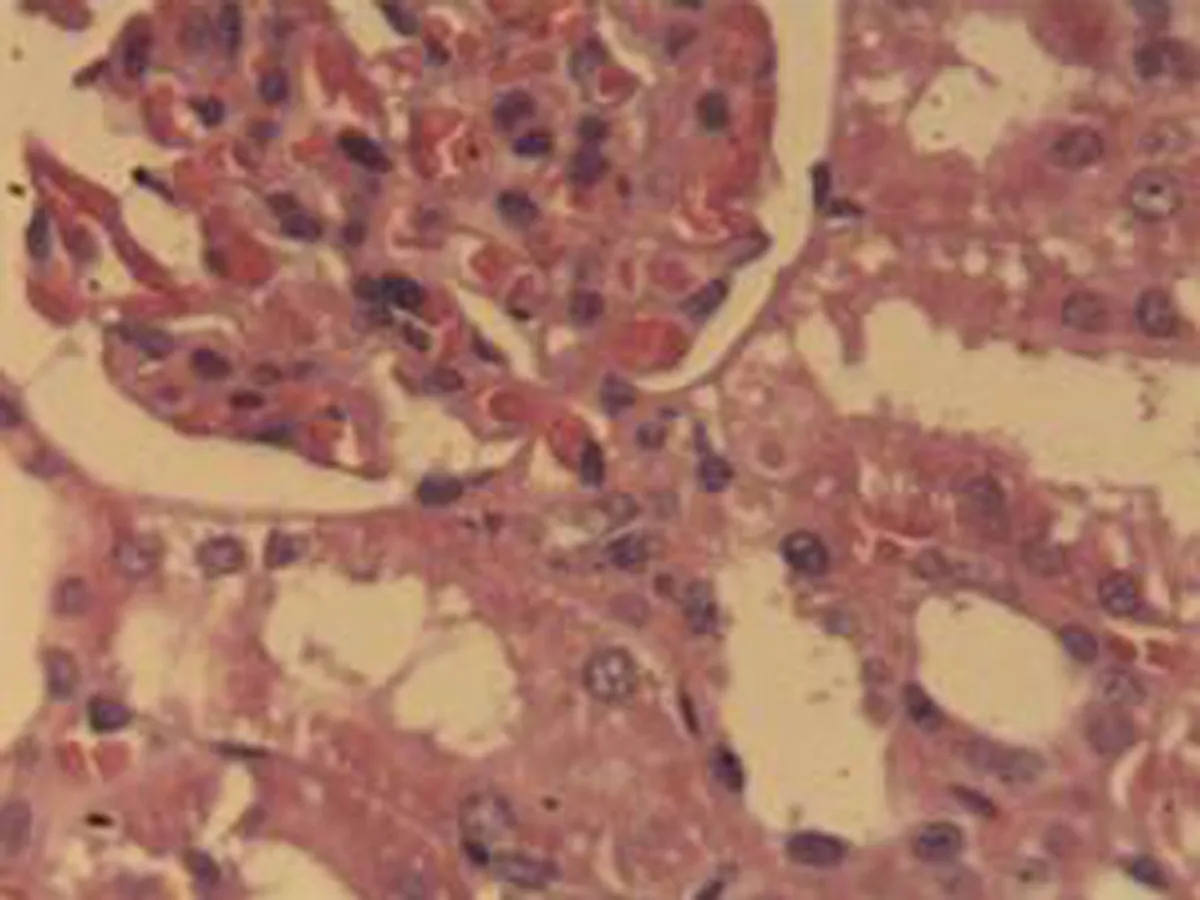
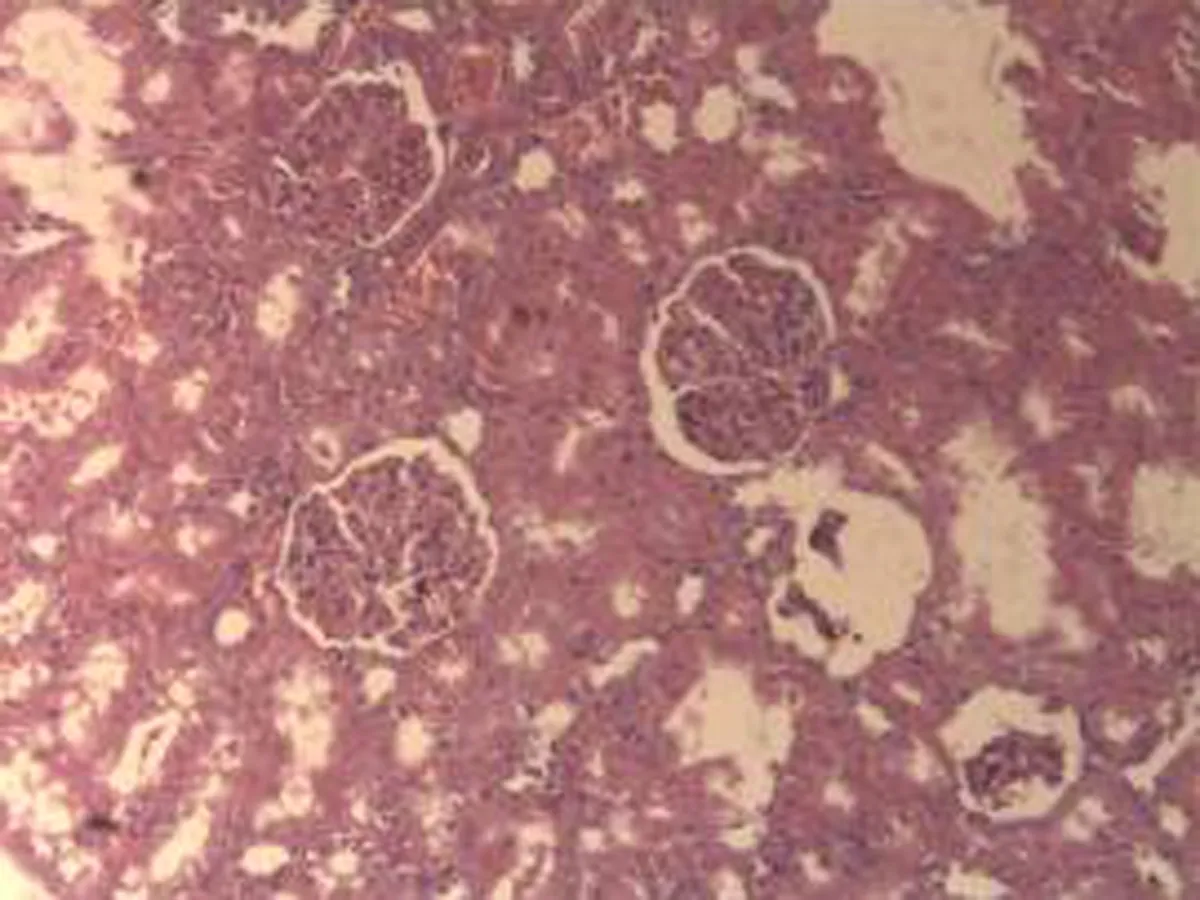
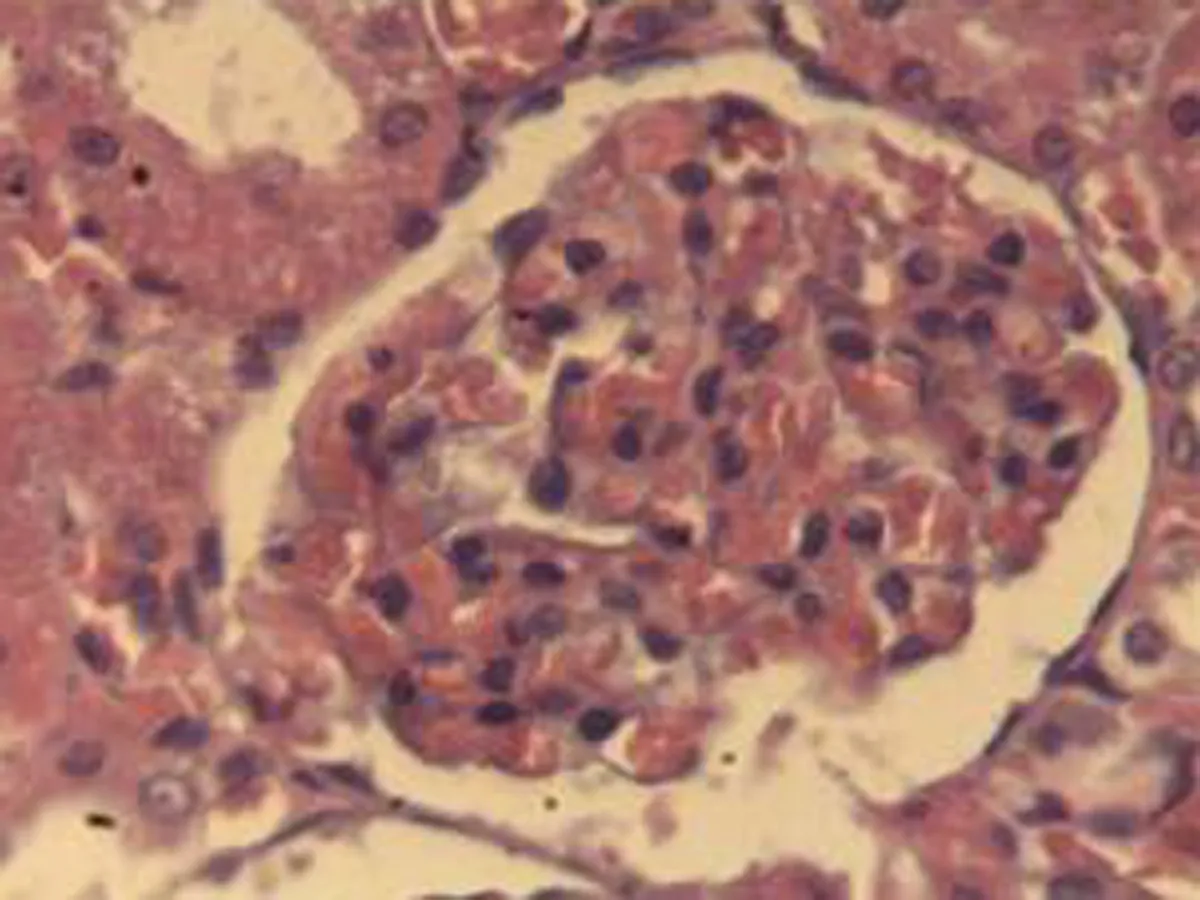
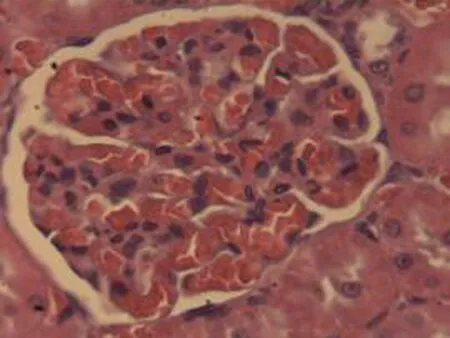
2.2.3 肾脏组织病理学检查结果 将大鼠肾脏组织在光镜下观察,CG组大鼠可见:肾组织结构正常,未发现病变;MG组大鼠可见:肾小球轻微充血,包满氏囊狭窄,远曲小管间质血管充血伴轻度水肿,近曲小管管腔狭窄,间质充血;硝苯地平组大鼠可见:肾小球轻度充血,包满氏囊较完整,近曲管轻度水肿,间质血管轻度充血,包满氏囊不完整;HIMSRT组大鼠可见:肾小球充血肿胀,近曲管轻度肿胀,间质充血,包满氏囊消失,近曲管肿胀;MIMSRT组大鼠可见:肾小球较均一,大部分结构未见明显改变,近曲管无明显水肿,管腔清楚,包满氏囊完整,近曲管轻微水肿,管腔较狭窄;LIMSRT组大鼠可见:肾小球轻度充血水肿,间质充血,包满氏囊狭窄,近曲管水肿,结构不清,轻度水肿,管腔狭小,见图3。
2.3大鼠各组织中MDA、SOD与GSH-Px测定结果
2.3.1 肺组织MDA、SOD与GSH-Px测定结果 与CG组大鼠比较,MG、NE、MIMSRT、LIMSRT组大鼠肺组织中SOD、GSH-Px活性减弱,差异有统计学意义(P<0.05)。与MG组大鼠比较,NE、HIMSRT、MIMSRT、LIMSRT组大鼠肺组织中SOD、GSH-Px活性增强,差异有统计学意义(P<0.05)。与NE组大鼠比较,HIMSRT、MIMSRT组大鼠肺组织中SOD、GSH-Px活性增强,差异有统计学意义(P<0.05)。与CG组大鼠比较,MG、NE、MIMSRT、LIMSRT组大鼠肺组织中MDA水平升高,差异有统计学意义(P<0.05)。与MG组大鼠比较,NE、HIMSRT、MIMSRT、LIMSRT组大鼠肺组织中MDA水平下降,差异有统计学意义(P<0.05)。与NE组大鼠比较,HIMSRT、MIMSRT组大鼠肺中MDA水平下降,差异有统计学意义(P<0.05),见表2。
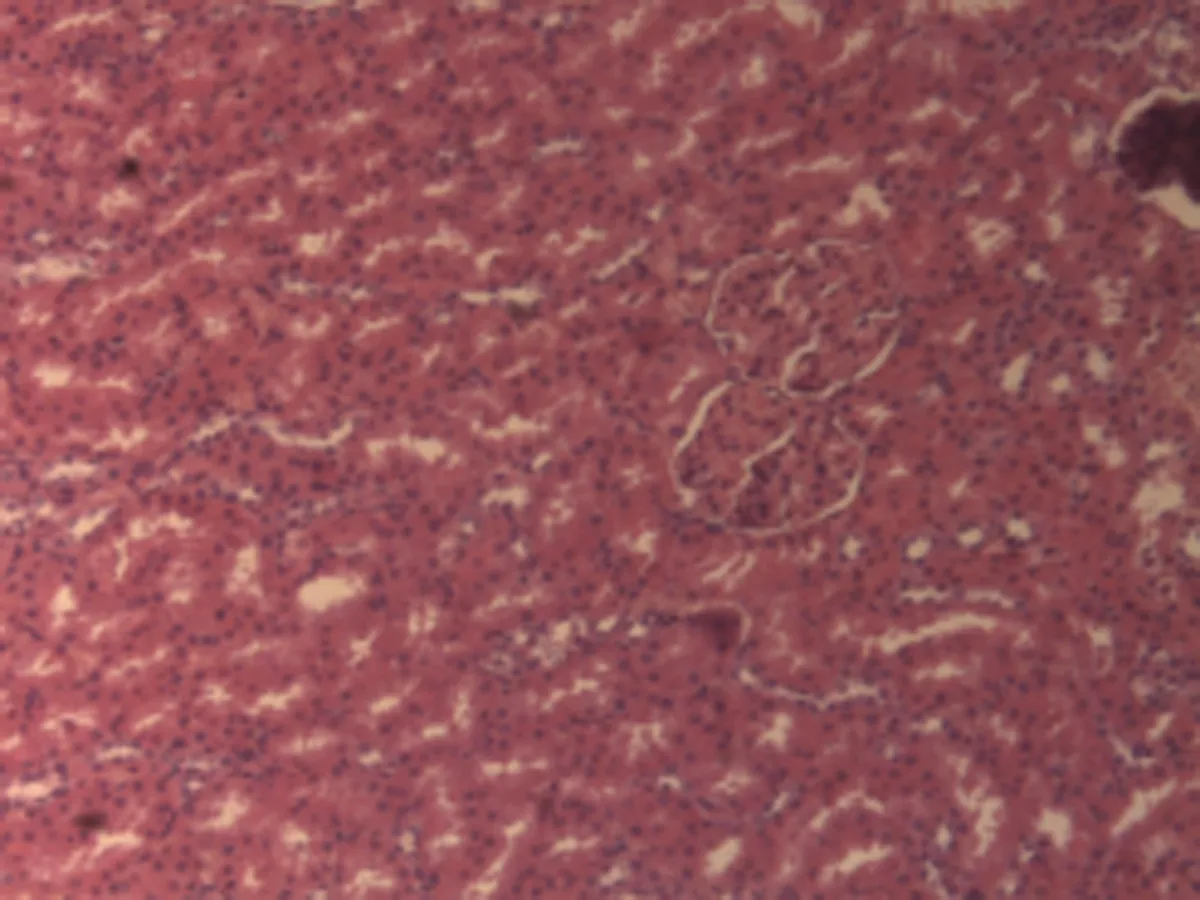
CG组(×100) CG组(×400) MG组(×100) MG组(×400)
NE组(×100) NE组(×400) HIMSRT组(×100) HIMSRT组(×400)
MIMSRT组(×100) MIMSRT组(×400) LIMSRT组(×100) LIMSRT组(×400)
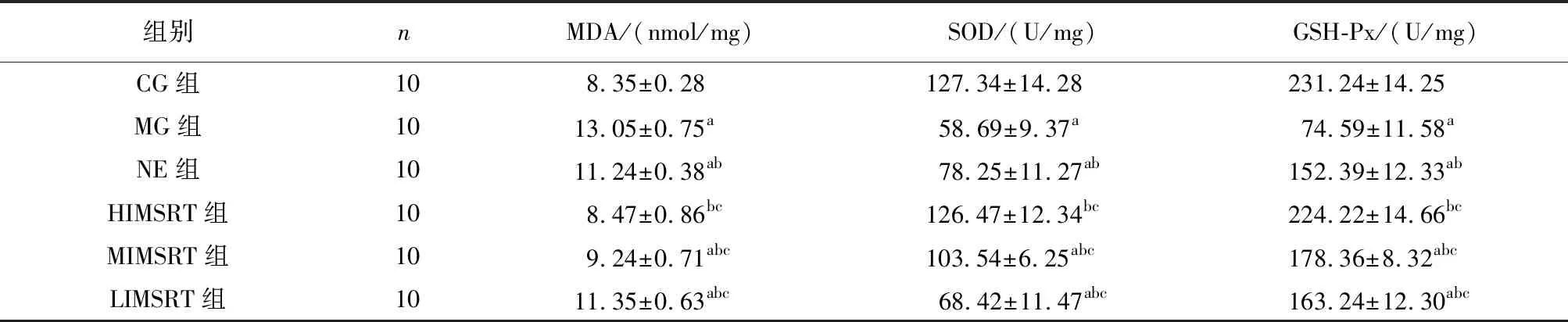
表2 各组大鼠肺组织MDA、SOD与GSH-Px的测定结果
注: 与CG组比较,aP<0.05; 与MG组比较,bP<0.05; 与NE组比较,cP<0.05。
2.3.2 肾脏MDA、SOD与GSH-Px测定结果 与CG组大鼠比较,MG、NE、MIMSRT、LIMSRT组大鼠肾脏组织中SOD、GSH-Px活性减弱,差异有统计学意义(P<0.05)。与MG组大鼠比较,NE、HIMSRT、MIMSRT、LIMSRT组大鼠肾脏SOD、GSH-Px活性增强,差异有统计学意义(P<0.05)。与NE组大鼠比较,HIMSRT、MIMSRT组大鼠肾脏中SOD、GSH-Px活性增强,差异有统计学意义(P<0.05)。与CG组大鼠比较,MG、NE、MIMSRT、LIMSRT组大鼠肾脏中MDA水平上升,差异有统计学意义(P<0.05)。与MG组大鼠比较,NE、HIMSRT、MIMSRT、LIMSRT组大鼠肾脏中MDA水平下降,差异有统计学意义(P<0.05)。与NE组大鼠比较,HIMSRT、MIMSRT组大鼠肾脏中MDA水平下降,差异有统计学意义(P<0.05),见表3。
3 讨论
氧自由基(reactive free species,ROS)[12-13],是一类高活性和短半衰期的化合物,其可以通过给予或接收电子从而获得稳定性。H2O2、·O2-和·OH为3种常见的ROS类型,其中·O2-和·OH被称为氧自由基。ROS最易受攻击的生物靶标是蛋白质、膜脂质和DNA。尽管ROS发挥着重要而广泛的作用,但它们的过量产生会导致氧化应激,从而对细胞和组织造成不可逆的损伤。为避免 ROS 过量,人体通过诱导内源性抗氧化系统(SOD、GSH等)和摄取外源性抗氧化剂(β -胡萝卜素、维生素C、维生素E和硒),从而使 ROS 产生和消除达到动态平衡。谷胱甘肽-过氧化物酶[14](GSH-Px)是分布于生物体中具有可催化过氧化氢(H2O2)分解的酶。超氧化物歧化酶[15](Superoxide Dismutase, SOD)是普遍分布于机体内消除ROS的首要酶,可通过消除ROS,进而发挥稳定细胞膜作用。GSH-Px与SOD水平的高低可直观体现生物体的抗氧化水平。当机细胞产生自由基大量堆积而无法及时清除时,ROS就可破坏细胞膜中与ROS具有高亲和性的多不饱和脂肪酸。丙二醛[16](MDA)是细胞膜内的多不饱和脂肪酸经过氧化而产生的最终产物,可以通过MDA水平的高低间接判断生物体内细胞的受损水平。本研究结果表明,构建CMS模型后,大鼠肺和肾脏中GSH-Px和SOD酶强度减弱,MDA水平升高。给予不同剂量的单硝酸异山梨酯缓释片干预后,肺和肾脏中GSH-Px和SOD酶活性强度升高,MDA水平下降。表明高海拔地区的低氧环境会对机体造成不同程度的氧化损伤,采用不同剂量的单硝酸异山梨酯缓释片干预后,这种氧化损伤出现了一定的好转。由此可见,高原低氧环境可对机体多种脏器造成不同程度的氧化损伤,而单硝酸异山梨酯缓释片对这种损伤具有一定的改善作用。
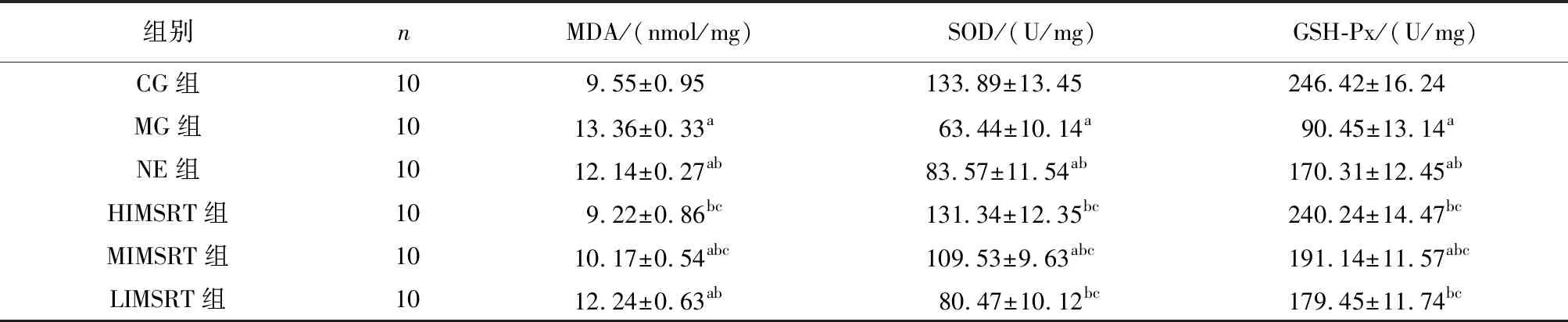
表3 各组大鼠肾脏MDA、SOD与GSH-Px含量的测定结果
注:与CG组比较,aP<0.05; 与MG组比较,bP<0.05; 与NE组比较,cP<0.05。
