CXCL6在食管鳞状细胞癌组织中的表达及其对食管癌细胞生物学特性的影响
2019-04-18申铜雪郑树涛韩秀娟卢晓梅
申铜雪, 郑树涛, 刘 清, 刘 涛, 张 潇, 马 蓉, 韩秀娟, 卢晓梅
(新疆医科大学1临床医学研究院, 2健康管理学院, 乌鲁木齐 830011)
食管癌(esophageal cancer, EC)是世界上第八大最常见的癌症,在全球死亡率排名第六,我国第四位[1]。病理学上,食管癌分为食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)和食管腺癌。尽管目前在诊断和治疗方面有了很大的进展,但是由于大多数食管癌患者发现时已经是中晚期,即使是切除和治疗后五年存活率仍不到10%[2]。因此探究食管癌的发生、发展的机制可为其诊断治疗提供科学依据。
本课题组前期通过诱导THP-1(人外周血的单核细胞)分化为M2型肿瘤相关巨噬细胞;并运用抗体芯片对Eca109细胞与M2型肿瘤相关巨噬细胞共培养与单独培养,细胞培养液中的差异蛋白因子进行筛查。结果显示,与非共培养组相比,发现趋化因子CXCL6(C-X-C motif chemokine ligand 6)有显著的差异(P=0.044),但CXCL6在食管癌组织中的表达水平及所介导的生物学功能未知。CXCL6又名粒细胞趋化蛋白2(granulocyte chemotactic protein-2,GCP-2),是趋化因子家族的重要成员之一,由巨噬细胞、上皮及间质细胞等分泌,具有趋化粒细胞、促血管生成和调节免疫等功能[3]。已有研究人员通过荧光定量PCR(RT-PCR)、酶联免疫吸附实验(ELISA )、免疫组织化学等方法验证了CXCL6在非小细胞肺癌、胃癌、肠癌、黑色素瘤中表达增加,并促进肿瘤的浸润和转移[4-7],提示CXCL6可能和某些肿瘤的发生、发展有着紧密的关联。但是CXCL6在ESCC中的作用及其机制尚不清楚。本研究旨在探索CXCL6在食管鳞状细胞癌组织中的表达和临床病理意义以及用CXCL6重组蛋白处理ESCC细胞,观察CXCL6对ESCC细胞迁移和侵袭能力的影响。
1 材料与方法
1.1临床病理标本本研究通过新疆医科大学肿瘤医院医学伦理委员会批准,标本的获取均具有患者知情同意书。ESCC组织芯片(上海芯超生物科技有限公司,型号HEso-S180Su-05)。ESCC组织芯片中,105例ESCC作为研究组,75例配对癌旁组织作为正常对照组(距病灶5 cm以外)。105例ESCC患者中包括男性77例,女性28例,年龄48~83岁,平均年龄65.19岁;ESCC组织浸润黏膜下层和肌层有17例,浸润外膜层有71例;病理分级高分化38例,中分化41例,低分化26例。根据美国癌症联合会(AJCC)2009年第七版TNM分期缺失,发现有淋巴结转移的有55例,无淋巴结转移的有50例。
1.2主要抗体、试剂和ESCC细胞兔抗CXCL6多克隆抗体(购于美国赛默飞公司,货号:PA5-67571,工作稀释浓度1∶200),DAB显色剂(购于北京中杉金桥生物制品有限公司,货号:ZLI-9018),食管鳞状细胞癌细胞Eca109 (来自武汉大学细胞库),CXCL6重组蛋白(购于北京神州义翘科技有限公司,货号:(333-GC/CF) ,胎牛血清(FBS,货号:10099-141)和胰蛋白酶(货号:25200-056)均购于Gibco公司,DMSO (购于Amresco公司,货号:0231),基质胶(购于BD公司,货号:356234)。
1.3方法
1.3.1 免疫组织化学染色和结果判定 免疫组织化学SP法操作步骤严格照试剂盒说明书进行,CXCL6抗体浓度为1∶200。用已经确定的ESCC阳性切片作为阳性对照,用PBS代替一抗作为空白对照。CXCL6主要表达在胞浆,呈现黄色或黄褐色颗粒为染色阳性。每张切片随机选取5个视野,计数500个细胞,阳性细胞占1%~25%为1分,占25%~50%为2分,占50%~75%为3分,占76%~100%为4分。阳性强度测定标准为:无色为0分,淡黄色为1分,黄色为2分,棕黄色为3分。二者之和0~2分为阴性,>2分为阳性[8-9]。
1.3.2 细胞培养 完全培养基(RPMI 1640):RPMI 1640培养基445 mL,加入50 mL灭活分装的胎牛血清(FBS),加入5 mL双抗(青霉素-链霉素混合液),充分混匀即为含10% FBS和双抗的完全培养基。Eca109细胞在37℃,5% CO2条件下培养在完全培养基中。
1.3.3 CXCL6重组蛋白处理细胞 将Eca109细胞接种于6孔板,每孔3×105个细胞,培养基更换为无血清培养基。培养基中加入CXCL6重组蛋白(50 ng/mL)培养48 h, 为CXCL6处理组,加入PBS(50 ng/mL)代替CXCL6重组蛋白为阴性对照组。Eca109作为未处理组, 每组设3个重复, 每组实验重复3次。
1.3.4 细胞划痕实验 细胞接种于6孔板,每孔3×105个细胞,在恒温细胞培养箱中培养,用10 μL无菌枪头在6孔板底部轻轻划一条力度和角度一致、粗细均匀的直线 (每组设3个重复,每组实验重复3次) 。分别于0、24、48 h在倒置相差显微镜下观察同一视野划痕的宽度并拍照(×100)。
1.3.5 细胞侵袭实验 基质胶1∶8的比例配制到小室的上室,置于细胞培养箱中过夜使其充分干燥。Transwell小室下室加入500 μL含10%FBS的1640培养基作为趋化剂,细胞用无血清培养基混匀后加入小室上室 (1×105个/孔) ,置于恒温细胞培养箱培养48 h后,用棉签轻轻擦去上室面未穿过膜的细胞,4%多聚甲醛固定, PBS清洗,结晶紫染色30 min后再用PBS清洗,显微镜下观察,每个样本随机选取4个视野,计数每个视野染色的细胞数量,即穿膜细胞数,取平均值,每组设3个重复, 每组实验重复3次。

2 结果
2.1食管鳞状细胞癌组织和癌旁正常组织中CXCL6阳性表达CXCL6主要表达在胞浆,呈现黄色或棕黄色的颗粒为阳性细胞(图1)。CXCL6在食管鳞状细胞癌组织中CXCL6阳性表达率71.4%,癌旁正常组织中CXCL6的阳性表达率为33.3%,差异有统计学意义(P<0.05)。
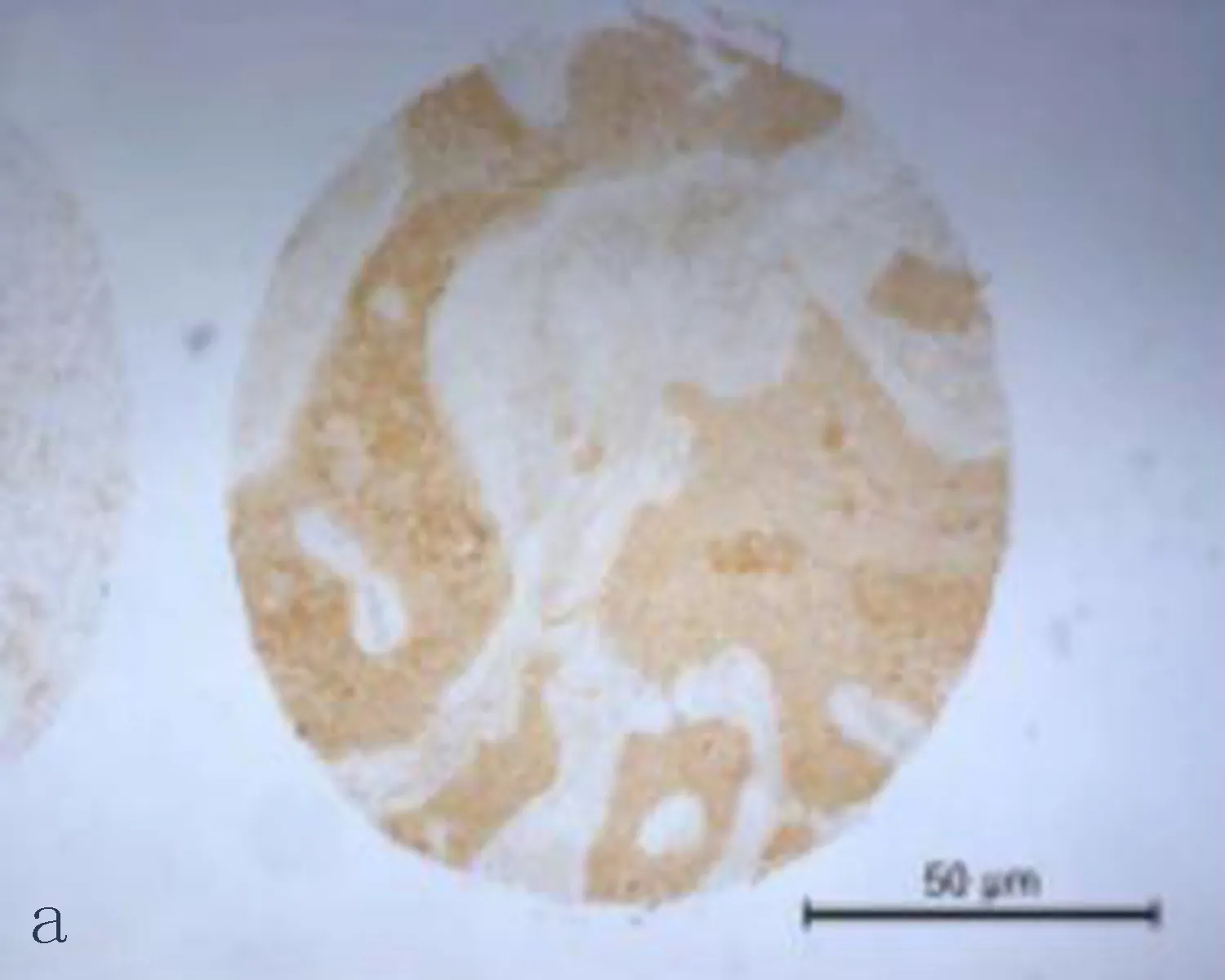
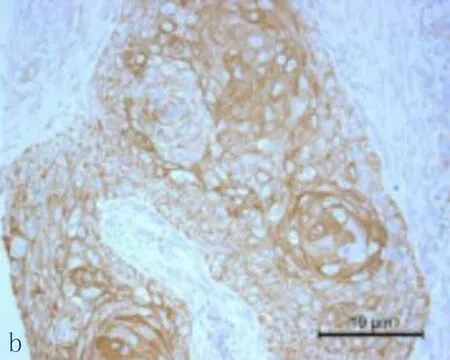
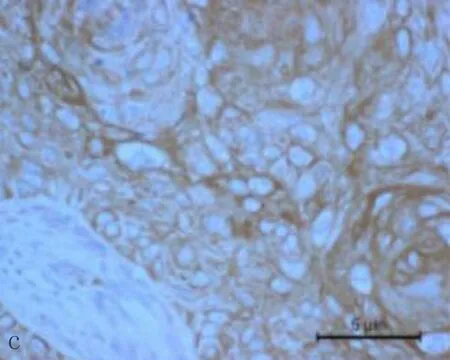
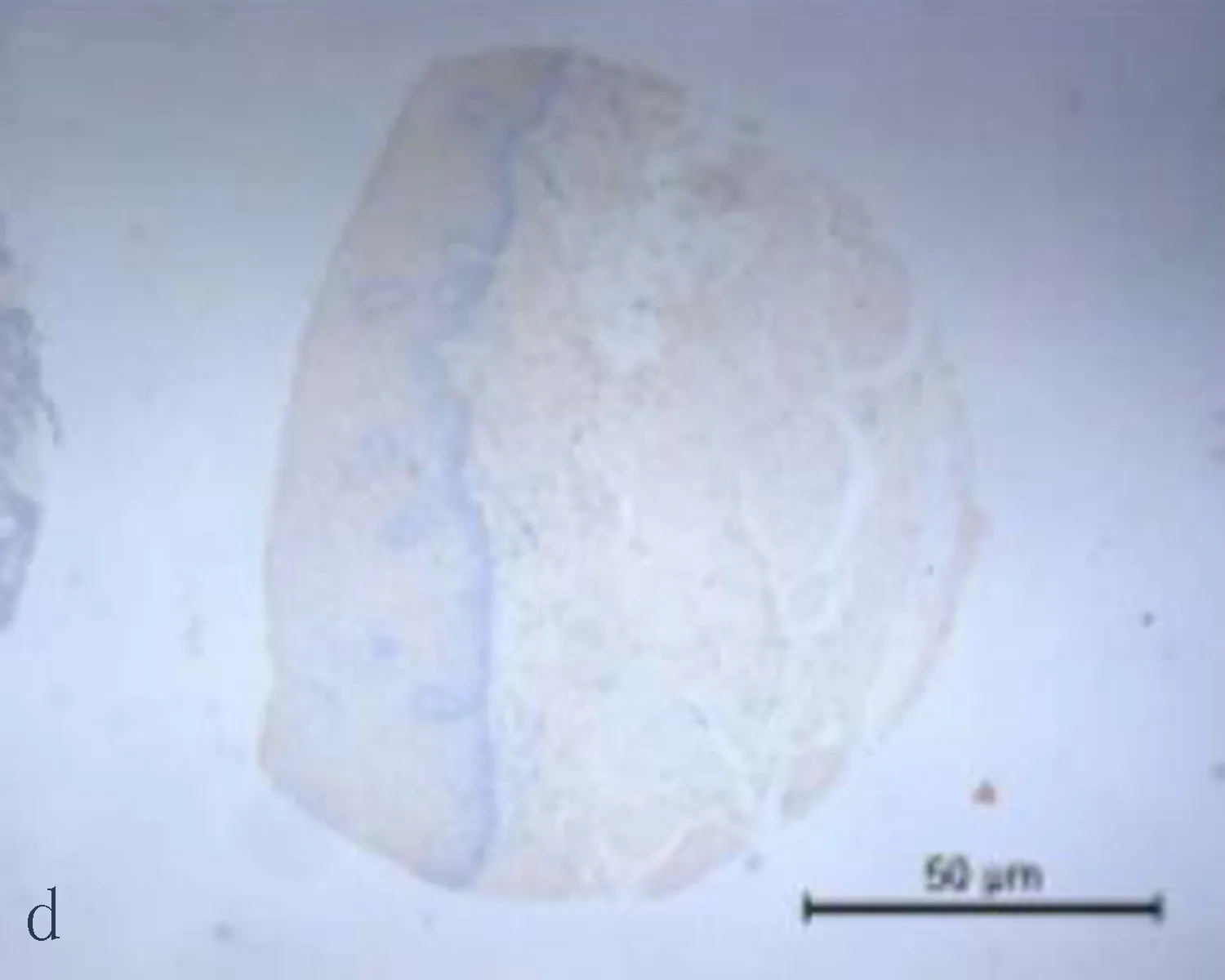
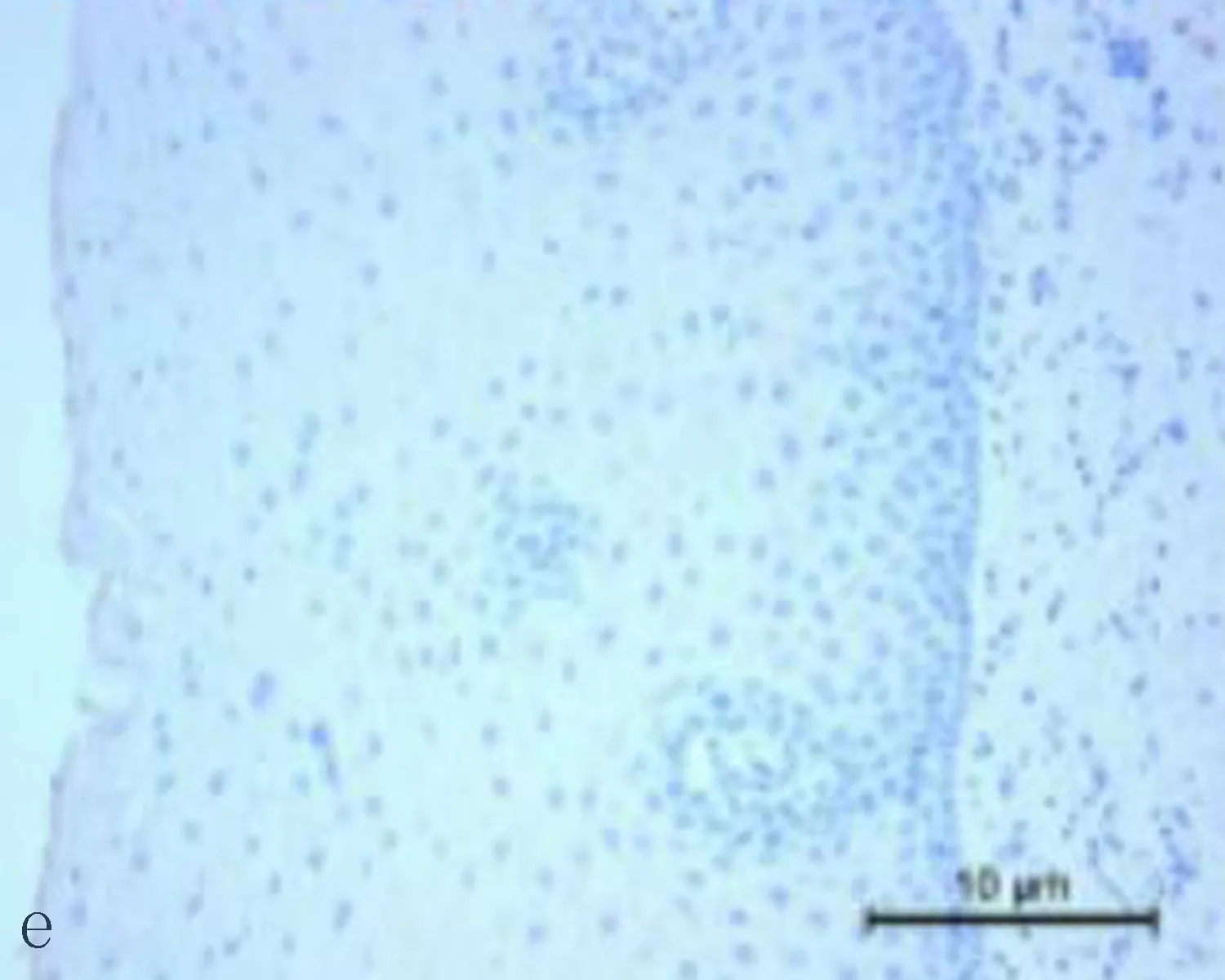
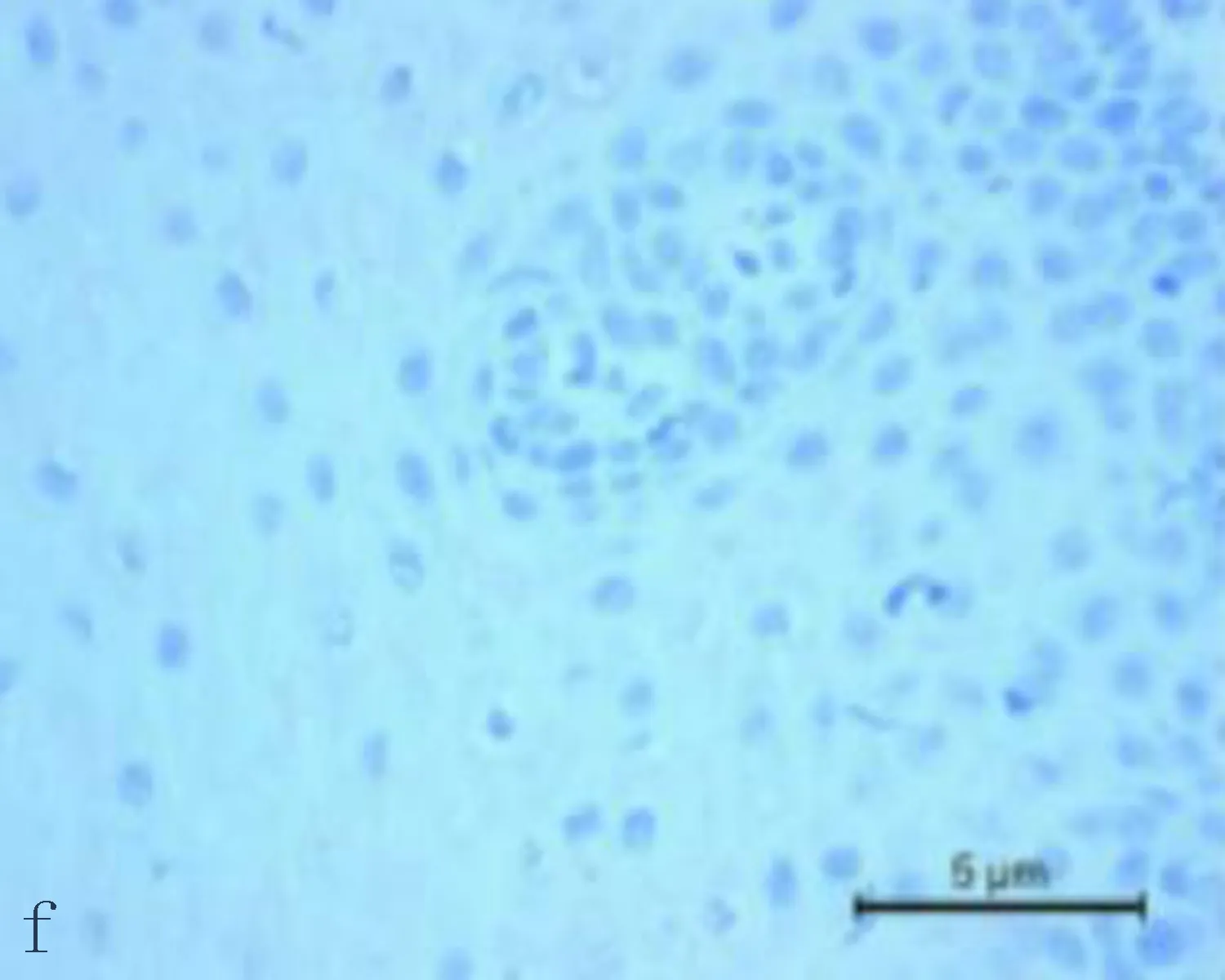
图1 CXCL6在食管鳞状细胞癌组织和癌旁正常组织中的表达
2.2CXCL6阳性表达与临床病理参数的相关性CXCL6阳性表达与患者分化程度有统计学意义(P=0.000),分化程度越低,CXCL6的阳性表达越高。在食管鳞状细胞癌组织中,CXCL6的阳性表达与患者的性别(P=0.625)、年龄(P=0.169)、肿瘤大小(P=0.231)、病理形态(P=0.862)、浸润深度(P=0,058)、临床分期(P=0.123)及淋巴结转移(P=0.062)无统计学意义(P>0.05)(表1)。
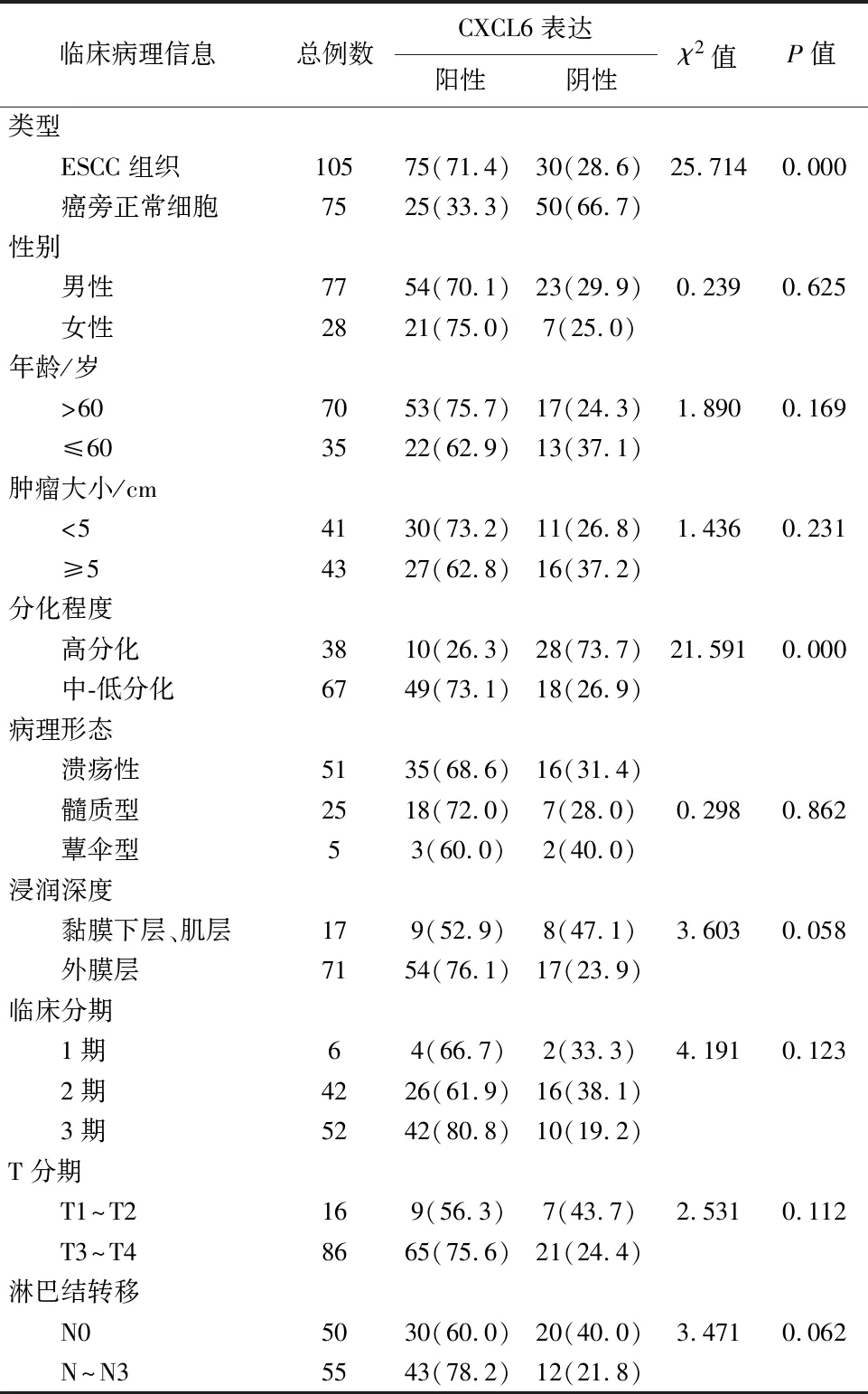
表1 CXCL6表达与ESCC患者临床病理参数的相关性分析/例
注:部分患者未提供相关病理信息(肿瘤大小,病理分型,T分期,淋巴结转移)2.3生存分析105例食管鳞状细胞癌患者手术时间是2006年1月~2008年10月,生存时间为0~107个月,平均生存时间为31个月。从2006年~2008年,105例食管鳞状细胞癌患者死亡86例,生存19例,生存率为18.10%。生存分析结果显示:食管鳞状细胞癌组织中CXCL6表达与患者总预后差异无统计学意义(P>0.05)(图2)。
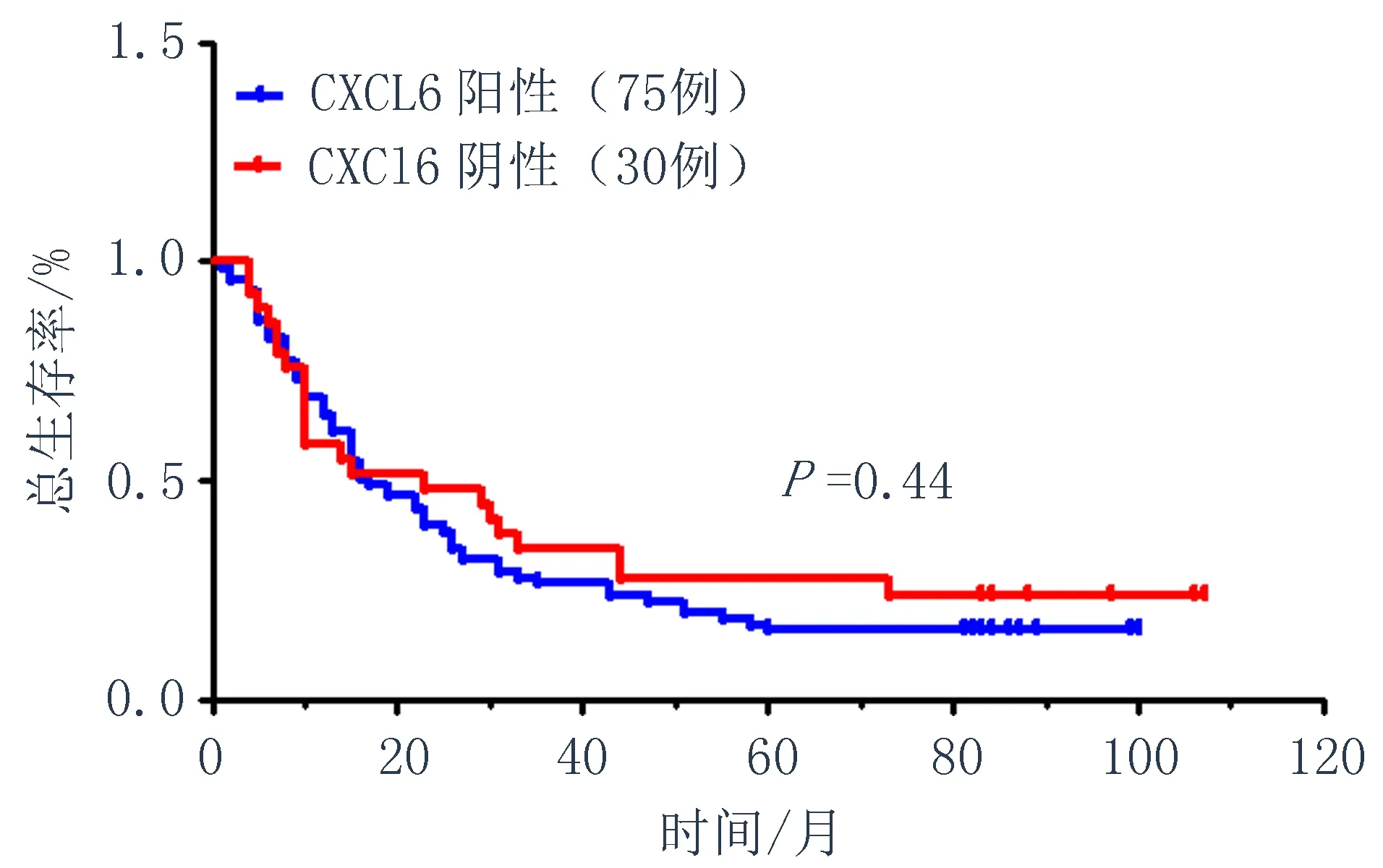
图2 CXCL6表达的预后分析
2.4CXCL6对细胞迁移能力的影响与阴性对照组比较,用 CXCL6重组蛋白处理Eca109细胞48 h后,细胞迁移能力明显增强(图3a),相对宽度变窄(图3b),差异均有统计学意义(P<0.05)。
2.5CXCL6对细胞侵袭能力的影响与阴性对照组比较,用CXCL6处理Eca109细胞48 h后,穿过基质胶的细胞数量明显增加,差异有统计学意义(P<0.05) (图4) ,表明CXCL6可以增强Eca109的侵袭能力。
3 讨论
肿瘤微环境既影响肿瘤发生,又对肿瘤的结局起一定的作用[10-11]。趋化因子是肿瘤微环境的重要组成部分,是一类能趋化细胞移行至其他特殊部位的低分子分泌蛋白(70~100 个氨基酸成)。大量研究表明,趋化因子可调控上皮组织和血液中肿瘤细胞增殖,通过诱导肿瘤细胞增殖,防止肿瘤细胞凋亡,直接调节肿瘤的生长,有促进血管生成和肿瘤生长浸润转移等作用[12-15]。不同的细胞通过趋化因子与趋化因子受体的相互作用而进入肿瘤微环境,从而促进肿瘤的迁移侵袭[16-17]。肿瘤的迁移侵袭是一个多因素、多基因参与的过程,包括炎症、细胞与细胞间的粘附降低,细胞与细胞外基质的粘附能力增强,基质金属蛋白酶降解细胞外基质等。迁移和侵袭是导致恶性肿瘤患者死亡的主要原因。CXCL6是典型的ELR+CXC趋化因子,炎症可刺激巨噬细胞、上皮细胞、间叶细胞等多种细胞分泌,与CXCL6特异性受体 CXCR1、CXCR2 结合可诱导白细胞趋化的作用。CXCL6不仅和炎症反应有关,还在肿瘤的侵袭转移的过程中起重要的作用[18-20]。研究发现, CXCL6 可表达在肝脏,参与肝脏的炎症反应。CXCL6还在胃癌、肠癌、黑色素瘤中表达增加,并促进肿瘤的迁移和侵袭,进一步证实CXCL6可能对某些肿瘤的发生、发展有至关重要的作用。本研究仅验证了CXCL6在ESCC Eca109细胞迁移和侵袭过程中起促进作用,CXCL6在其它ESCC细胞中的作用;CXCL6导致肿瘤细胞发生迁移侵袭的具体机制,还有待进一步验证。
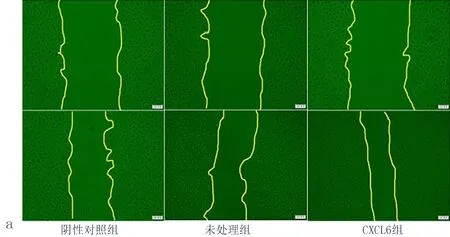
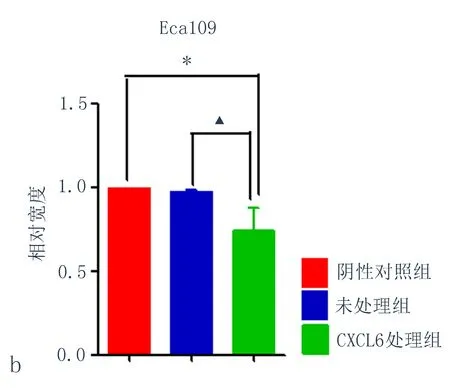
图3 CXCL6诱导后Eca109细胞迁移能力改变
(注:a:CXCL6诱导后Eca109迁移能力的变化;b:CXCL6诱导后Eca109细胞相对迁移宽度,与阴性对照组比较,*P<0.05, 与未处理组比较,▲P<0.05)
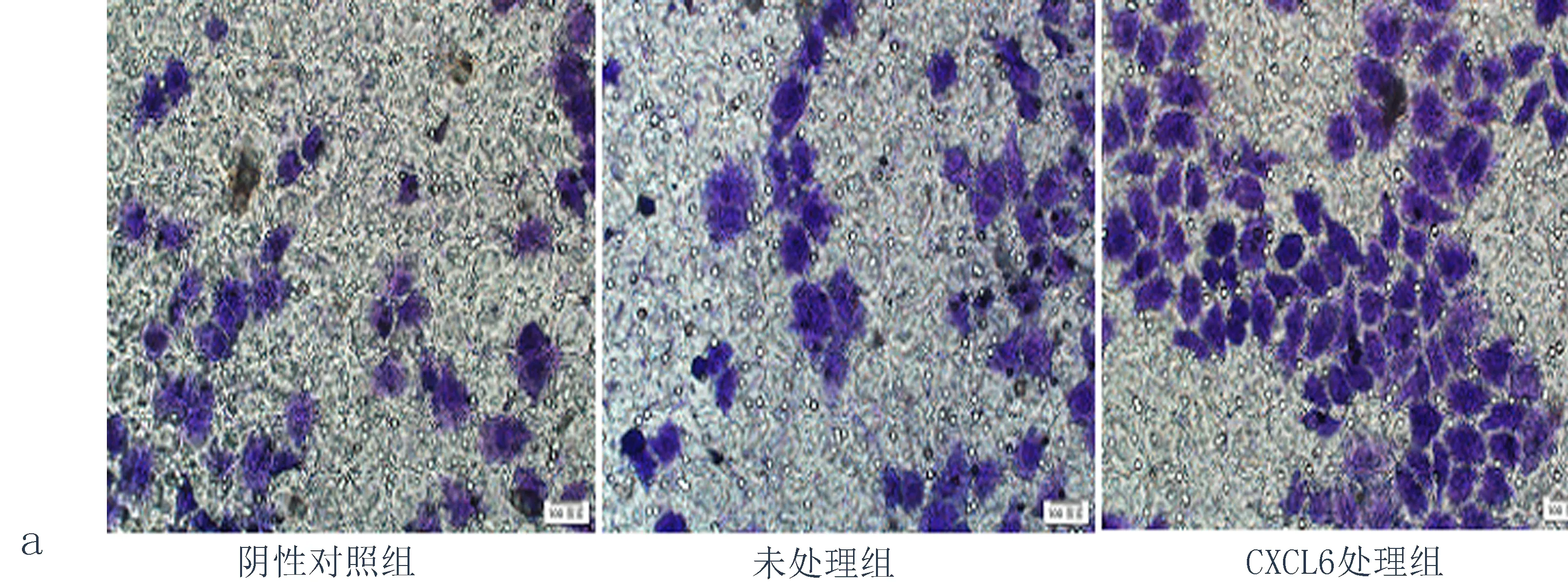
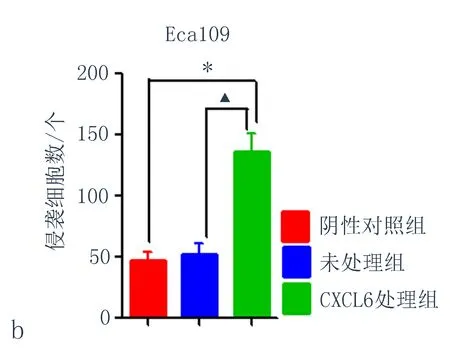
图4 CXCL6诱导后Eca109细胞侵袭能力改变
(注:a: CXCL6诱导后Eca109细胞侵袭能力改变; b: CXCL6诱导后Eca109侵袭细胞数量, 与阴性对照组比较,*P<0.05, 与未处理组比较,▲P<0.05)
本研究通过免疫组织化学染色发现ESCC组织中CXCL6高表达;且CXCL6阳性表达与患者分化程度有关,与其它临床病理参数及总预后的相关性,无统计学意义。通过细胞迁移实验发现CXCL6促进Eca109细胞的迁移能力。另外通过细胞侵袭实验发现CXCL6促进Eca109的侵袭能力。有文献报道,CXCL6在肝癌、肺癌、黑色素瘤等实体肿瘤中表达上升,并通过各种途径促进肿瘤的迁移和侵袭[4-7]。组织和细胞水平的实验结果和文献报道的一致,另外实验存在一定的局限性。免疫组织化学SP法的抗体浓度和效价、孵育时间过长等会形成假阳性的结果;抗原修复方法不当等会形成假阴性的结果;阳性阴性临界值的不同也会影响实验结果。细胞迁移实验的划痕力度和宽度及重组蛋白的效价等影响迁移实验的结果。细胞侵袭实验的局限性主要表现在,第一:细胞接种密度的影响,虽然在接种细胞时已通过细胞计数严格控制接种的细胞数,但接种24孔Transwell小室很难充分将细胞混匀,造成细胞生长不均匀。第二:基质胶质量和浓度的影响。以上所述的局限性有可能影响免疫组化和迁移及侵袭实验的结果。
综上所述,CXCL6在ESCC组织中高表达,并与分化程度有关,分化程度越低,CXCL6表达量越高,CXCL6促进ESCC Eca109细胞的迁移和侵袭能力。CXCL6在ESCC的发生、发展过程中可能扮演着重要角色。
