嵌合抗原受体T细胞免疫疗法治疗儿童恶性肿瘤的研究进展
2019-04-18杨逸成骆玥君梁广华梁颖君邹子元综述熊长明审校
杨逸成 骆玥君 梁广华 梁颖君 邹子元 综述 熊长明 审校
免疫治疗作为一种新型的靶向治疗方法逐渐成为多种肿瘤的重要综合治疗手段,显示出良好的应用前景[1-3]。嵌合抗原受体T 细胞免疫疗法(CAR-T细胞疗法)是一种过继性免疫细胞治疗方法,通过CAR-T 细胞作用于肿瘤的不同靶点,特异性地杀伤肿瘤细胞,并在共刺激因子的作用下持续发挥抗肿瘤作用,在儿童好发肿瘤的治疗方面发挥着重要作用[4-5]。该疗法不仅对白血病[6-7]和淋巴瘤[8]等血液系统的恶性肿瘤有疗效,而且对实体瘤如神经母细胞瘤[9-10]等也发挥着重要作用。本文将综述CAR-T 细胞疗法治疗儿童好发恶性肿瘤的相关研究进展。
1 CAR-T细胞治疗儿童血液系统肿瘤与实体瘤
在0~14岁的儿童中,常见肿瘤包括急性或慢性白血病、淋巴瘤、神经母细胞瘤等[11-12]。CAR-T细胞疗法已经在儿童血液肿瘤和实体瘤中取得一定效果。
1.1 血液系统肿瘤
1.1.1 白血病 白血病是儿童好发的恶性肿瘤之一,年龄<15岁白血病患儿5年生存率为60%~85%,但复发和难治性的白血病治疗效果和预后较差,患儿生存率较低[13]。目前,随着CAR-T 细胞疗法的发展,血液系统恶性肿瘤的治疗有了新的选择。
CAR-T细胞疗法治疗白血病的靶点之一为CD19分子。CD19分子高表达于淋巴瘤和所有淋巴细胞系白血病细胞,而正常组织中并不高表达CD19[14]。有研究指出CD20是治疗淋巴瘤另一靶点。儿童白血病患者最好发的类型为急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)。目前CAR-T细胞疗法用于治疗ALL患者效果显著。Maude等[9]报道Ⅰ期临床试验中,30 例复发性或难治性的ALL 儿童和成人患者以(0.76~20.6)×106CTL019细胞/kg的剂量进行输注,30例患者体内均可观测到CTL019细胞增殖,并可在骨髓、脑脊液、外周血中检测到CTL019细胞,该研究6个月的无事件生存率达67%(95%CI:55%~88%),总生存率为78%(95%CI:65%~95%)。6个月后患者体内仍持续存在68%CTL019细胞。此试验中CAR-T细胞疗法最终使27例患者获得完全缓解,且完全缓解率达90%。所有患者均发生细胞因子释放综合征(cytokine release syndrome,CRS),27%与CAR-T细胞输注前较高的肿瘤负担相关,使用白细胞介素6抗体托珠单抗后患者能得到有效治疗[9]。美国国家癌症研究所[15-16]纳入21例ALL或非霍奇金淋巴瘤(non-Hodgkin's lymhoma,NHL)年轻患者,开展第1阶段剂量递增试验评估CAR-T细胞疗法的毒性、安全性,指出患者最大耐受剂量为1×106CD19-CAR.z.28 T细胞/kg。试验中3例患者发生4级CRS,9例患者出现发热、低钾血症,但所有的不良反应均可逆。Maude等[17]开展一项涵盖全球25个中心的Ⅱ期队列临床研究,在CD19+复发或难治性B细胞ALL儿童和年轻患者中输注tisagenlecleucel,患者3 个月内的总缓解率达81%,且所有对该治疗有效的患者微小残留病灶(minimal residual disease,MRD)均为阴性。6 个月后,患者无事件生存率和总生存率分别为73%和90%,12个月后分别为50%和76%,单次注射tisagenlecleucel可为患有复发性或难治性B细胞ALL的儿童和年轻患者提供长期缓解。因其良好的治疗效果,FDA 批准tisagenlecleucel用于治疗患有B细胞ALL的年龄<25岁患者。
一项Ⅰ期临床试验纳入21 例B 细胞ALL 患者(包括17例先前接受过CD19定向免疫治疗的儿童),15例患者按≥1×106CD22 CAR-T细胞/kg的剂量输注至体内后发现73%获得完全缓解,中位缓解期为6个月。肿瘤的复发与CD22位点密度降低有关,该研究也突出了抗原密度在调节CAR-T细胞功能中发挥的关键作用[18]。CD22这一靶点在治疗ALL中的作用仍需更多的临床试验来探索。
1.1.2 淋巴瘤 CAR-T细胞疗法用于治疗霍奇金淋巴瘤(Hodgkin's lymphoma,HL)的相关报道较少,但该疗法对于NHL 却有显著的治疗效果。研究表明[19-21]CAR-T 细胞疗法对滤泡性淋巴瘤和套细胞淋巴瘤这两种NHL 亚型具有疗效,主要因为这两种亚型对T细胞介导的免疫反应有着较强的敏感性,成为CAR-T淋巴细胞的重要治疗目标之一。淋巴瘤细胞表达的CD79b[22]、CD19、CD20和CD28[23]等是CAR-T细胞疗法的重要靶点。
CAR-T细胞除招募炎症细胞外,还能激活可诱导的caspase-9凋亡相关基因引起肿瘤细胞的凋亡。第一代CAR-T细胞因CAR胞内段的信号结构域仅有CD3ζ可以激活下游信号元件,对淋巴瘤的治疗效果非常有限,但随着抗CD19的CAR在临床上的广泛应用,该疗法对首发和复发的B细胞NHL表现出持续的抗肿瘤效果[15]。Till等[24]利用具有4-1BB和CD28双刺激分子的CAR-T细胞疗法治疗3例NHL患者,其中2例完全缓解,在12个月和24个月内无疾病进展,1例部分缓解,虽然在肿瘤部位和外周血检测到CAR-T细胞水平较低,但该共刺激方法不仅可增强疗效,还可延长CAR-T细胞的存活时间,从而持续发挥抗淋巴瘤的作用。在未来的研究中,运用基因转移技术有望能提高体内CAR-T细胞的水平,更好地发挥抗肿瘤效用。Savoldo等[25]研究也证明,引入CD28共刺激分子的CAR-T细胞在B细胞淋巴瘤患者体内的特异性肿瘤细胞杀伤作用更强,作用时间更长。一项Ⅰ期临床试验[26]纳入B细胞淋巴瘤患者,探讨新的CD19-BBz(86)CAR-T细胞的疗效和安全性。11例接受(2~4)×108剂量的CD19-BBz(86)CAR-T细胞输注治疗的患者中,6例(54.5%)获得完全缓解。同时使用该T细胞治疗的患者中(包括完全缓解的患者),血清中未检测到细胞因子水平的显著升高。CD19-BBz(86)CAR-T细胞可以在体内持续增殖并分化为记忆细胞,在体内发挥有效而持久的抗淋巴瘤作用而不引起神经毒性或严重的CRS。
本研究总结近3年CAR-T 细胞疗法治疗ALL 和淋巴瘤的临床试验研究,见表1。

表1 近3年CAR-T细胞疗法治疗ALL和淋巴瘤的临床试验研究
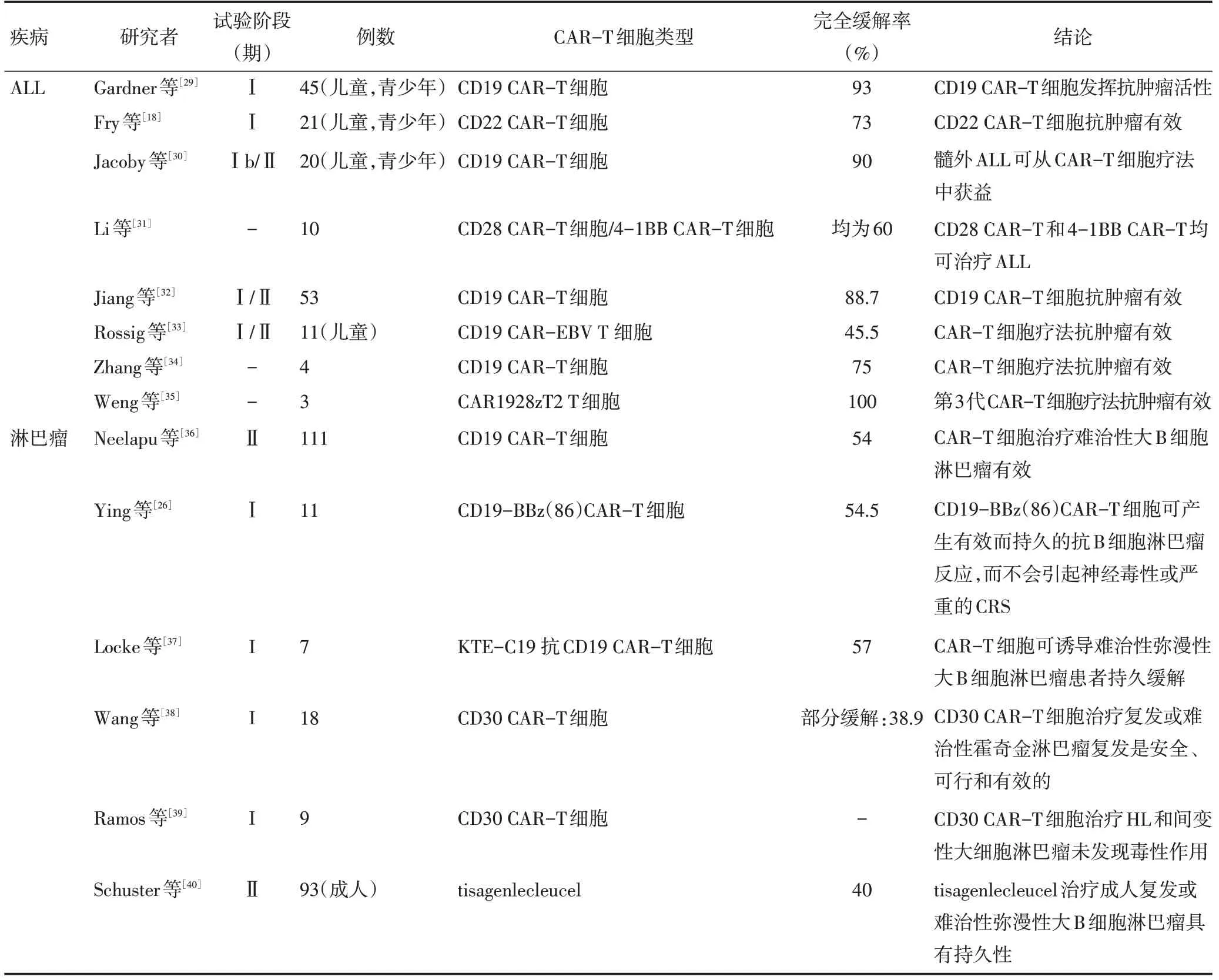
表1 近3年CAR-T细胞疗法治疗ALL和淋巴瘤的临床试验研究(续表1)
1.2 实体瘤
1.2.1 神经母细胞瘤 神经母细胞瘤多见于儿童,恶性程度及死亡率高,术后复发和治疗困难常是导致治疗失败的重要原因[41]。目前已有CAR-T细胞疗法治疗神经母细胞瘤的相关研究报道(30459759),有望降低神经母细胞瘤患者死亡率。CAR-T细胞疗法对于神经母细胞瘤的治疗主要作用于GD2和CD171靶点。
1.2.2 GD2 靶点 GD2 是起源于神经外胚层的肿瘤表达的双唾液酸神经节苷脂,黑色素瘤和神经母细胞瘤均表达GD2 分子,GD2 已经成为CAR-T 细胞免疫治疗的新靶点[42],是CAR-T 细胞治疗GD2 阳性神经母细胞瘤的基础。
在体外试验中,CAR-T 细胞对GD2 高表达的人骨髓神经母细胞瘤细胞系(SH-SY5Y)表现出明显的细胞毒性,48 h 后的细胞溶解率是80%,高出对照组20%。在小鼠体内发现CAR-T细胞明显抑制GD2阳性的转移瘤生长并诱导细胞凋亡。相对于对照组中出现的大范围高密度的神经母细胞瘤样细胞,抗GD2的CAR-T 细胞可引起肿瘤组织结构发生明显变化。抗GD2的CAR-T细胞与肿瘤抗原结合时能触发特定的抗GD2阳性的神经母细胞瘤细胞的活性[43]。Prapa等[43]通过逆转录病毒将GD2的嵌合抗原受体基因转导至T 淋巴细胞中,使T 细胞表达该受体,并通过使用体外细胞毒性测定和异种移植模型来评估抗GD2阳性神经母细胞瘤的活性,结果显示CAR-T 细胞疗法对GD2阳性的神经母细胞瘤有显著的疗效。
有临床研究表明[44],接受CAR-T 细胞治疗的11例神经母细胞瘤患者中,3 例患者获得完全缓解,并且CAR-T 细胞在患者体内可持续存在,发挥持久的肿瘤杀伤作用。
1.2.3 CD171靶点 Kunkele等[45]研究发现CD171上的抗原表位是CAR-T细胞疗法治疗神经母细胞瘤的另一新靶点。CD171(L1)分子参与实体瘤的发生发展,并调节肿瘤细胞的分化、增殖、迁移和侵袭[46]。该研究证实广泛表达于神经母细胞瘤上的CD171可被CE7衍生的CD171 CAR-T细胞靶向识别,是CART细胞疗法用于治疗神经母细胞瘤的新靶点。
目前,CD171 CAR-T 细胞疗法治疗复发性或难治性神经母细胞瘤患儿的相关临床研究正在开展,有望为神经母细胞瘤的临床治疗提供新选择。
2 CAR-T细胞疗法不良反应
CAR-T细胞疗法过程中可能引发患者的不良反应,其中最主要的是CRS和神经毒性[47]。
CAR-T细胞疗法在杀灭肿瘤细胞的同时可能会引发CRS,免疫系统过度激活后导致机体正常组织和细胞的损伤。患者出现此综合征反应的首发症状为发热,常出现在细胞输注的数小时或者数天内,可能伴有窦性心动过速、低血压、心脏功能下降和低氧血症[48-49],严重者出现肺水肿和(或)呼吸衰竭,危及患者生命。有研究[50-52]指出CRS常在细胞输注7 d内发生并且逐渐缓解。
CAR-T 细胞疗法具有神经毒性,能引起神经功能障碍。该免疫疗法引发的神经毒性的症状在临床上具有多样性,患者可能出现谵妄、幻觉、认知障碍、震颤、共济失调、吞咽困难、局灶性运动、感觉障碍、嗜睡和癫痫发作等症状。CAR-T 细胞输注后的第2天至第3~4周均有可能出现神经毒性,可以与CRS同时发生,也可继发于CRS 缓解后[53-54],由于该不良反应可能出现的时间跨度大,因此在治疗过程中需要严密监视患者的临床表现。目前关于神经毒性的病理生理学机制仍尚不明确,但研究发现分级较高的神经毒性患者常伴发严重的CRS,提示可能两者间存在共同的致病机制,可能与白细胞介素、粒细胞-巨噬细胞集落刺激因子和血管内皮生长因子水平升高相关[55]。
此外,GD2是CAR-T细胞疗法的靶点之一,由于正常组织中也有少量的GD2 表达,因此抗GD2 的CAR-T 细胞会不可避免地产生交叉免疫杀伤,导致接受CAR-T细胞治疗的患者产生不同程度的不良反应。由于免疫功能受到抑制,患者发生感染的风险大幅增加[56],这些CAR-T 细胞疗法的不良反应均需引起临床重视。
临床上可使用药物预防CAR-T细胞疗法的不良反应,如使用皮质类固醇预防CRS,同时托珠单抗生物制剂也被FDA 批准用于CAR-T 细胞疗法引起的CRS 和神经毒性的预防和治疗[57]。研究发现肿瘤负荷高的急性淋巴瘤患者使用较低的CAR-T细胞剂量可降低不良反应发生率[58-60]。目前仍需进一步探讨治疗CAR-T细胞引起的不良反应的新靶点。
3 总结与展望
CAR-T 细胞疗法在白血病、淋巴瘤和神经母细胞瘤等儿童好发肿瘤的治疗中取得较好的效果,为临床治疗难治性和复发性儿童肿瘤患者提供新的思路。现在已有相关研究探讨CAR-T细胞对非复发肿瘤患者的效用,MRD 水平较高的患者运用CAR-T 细胞疗法,可能更有效。
CAR-T细胞治疗儿童好发实体瘤的研究仍较欠缺,同时需要探索更多新的肿瘤特异性抗原,如何减少CAR-T 细胞疗法带来的不良反应也亟待解决,同时CAR-T细胞疗法与免疫检测点抑制剂的联合能否带来更大的临床效益仍需进一步探讨。期待免疫细胞疗法能得到更深入的研究,更好地应用于临床,为患者带来福音。
