不同评分系统评估慢性粒细胞白血病患者预后的比较*
2019-04-18贾茜婷毛建平薛连国蔡志梅赵利东
贾茜婷 毛建平 薛连国 蔡志梅 赵利东
在酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)上市之前,使用干扰素和化疗疗法的慢性粒细胞白血病(chronic myeloid leukemia,CML)患者5年总生存率(overall survival,OS)分别为57%和42%[1],而使用第一代TKI 伊马替尼一线治疗的患者5年OS 为83%~89%,TKI 的引入显著改善CML 患者的预后[2]。2013年,根据欧洲白血病网(ELN)的建议,第二代TKI-尼洛替尼和达沙替尼被批准为替代性一线治疗方案,与伊马替尼相比,第二代TKI 已被证明可以诱导更快、更深的分子学反应。上述3种TKI均未显示出明显的生存获益[3]。
Sokal 和Hasford 评分在化疗和干扰素“时代”被提出[4-5],其被认为是前伊马替尼“时代”的预后指标。随着伊马替尼在所有年龄组患者中使用,由于伊马替尼时代开发的评分系统不宜,EUTOS 评分系统于2011年被开发[6]。EUTOS评分中删除了以往评分系统中重要的危险因素,即年龄。通过仅考虑嗜碱性粒细胞和脾脏大小的百分比,使评分系统变得简单。脾脏大小和嗜碱性粒细胞百分比在预测CML预后中的作用尚未明确。有研究表明,嗜碱性粒细胞比例与疾病分期有关,而脾脏Ph+细胞与骨髓Ph+细胞在疾病动力学和对伊马替尼的敏感性方面有不同的特异性[7-8]。由于TKI 的治疗非常有效,CML 患者的预期寿命接近正常普通人群的预期寿命[9]。CML 患者的主要死亡原因与CML 无关,死因可能为第二种癌症、心脑血管并发症、感染等其他原因。因此,对患者预后评估的需求已从OS 转向了疾病相关特异性死亡。2016年,Pfirrmann 等[10]考虑到CML 死亡概率的情况下对患者的预后进行重新评估,认为较高的年龄、较多的外周细胞、较大的脾脏和较低的血小板计数与CML 死亡概率的增加显著相关,并确定建立一项新的长期生存评分,即ELTS评分。
Sokal和Hasford评分被用于预测CML的治疗结果,有数据表明Sokal评分在评估使用伊马替尼甚至第二代TKI治疗患者的预后方面仍具有较好的预测性[2]。
接受一线伊马替尼治疗CML患者的预后评分的比较分析在国内人群的资料较为有限。且由于更高剂量的伊马替尼或第二代TKI对患者产生的治疗效果和反应深度不同,应该对有相同初始治疗和诊断状态的一组患者进行预后评分系统的比较分析。因此,针对使用标准剂量的伊马替尼早期慢性粒细胞白血病慢性期(chronic myeloid leukemia-chronic phase,CML-CP)的患者,本研究进行单中心回顾性分析,以验证4种评分系统作为预测和预后工具的有效性,同时在考虑到CML相关性死亡概率的情况下对患者的预后进行重新评估。
1 材料与方法
1.1 病例资料
分析2010年1月至2019年12月连云港市第一人民医院就诊的172例BCR-ABL融合基因阳性的CMLCP患者进行分析(除外在治疗过程中,因为不可耐受或耐药而改为二代TKI治疗的43例患者及未按照建议进行评估且无法获取随访数据的患者)。其中男性98例,女性74例,中位年龄为46.5岁。患者根据中国慢性髓系白血病诊断与治疗指南(2011年版)确诊。记录患者初诊时的年龄、性别、脾脏大小及外周血中血红蛋白数、白细胞数、血小板数、嗜酸性粒细胞、嗜碱性粒细胞数及原始细胞数。并根据表1中Sokal、Hasford、EUTOS及ELTS评分给出的公式进行计算和分类。
1.2 方法
本研究患者在接受伊马替尼治疗前给予羟基脲的降白细胞处理。所有患者从确诊后的6 个月内口服伊马替尼400 mg/d治疗,并在治疗过程中监测其治疗耐受性和不良反应。建议育龄妇女采取避孕措施,并报告月经周期是否存在延迟。

表1 Sokal、Hasford、EUTOS及ELTS评分的比较
1.3 随访
定期随访患者,每月行血常规检查,以监测血液学反应。每隔3个月进行1次逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)检查,记录BCR-ABL融合蛋白转录本水平,直至达到主要分子学反应(major molecular response,MMR),然后每6个月进行1次。当BCR-ABL/ABL比率降低3个对数倍时,即BCR-ABL/ABL(IS)比率为0.1%或更低时,即表明患者达到MMR。OS 和无进展生存期(progression free survival,PFS)分别为从治疗开始到死亡或最终随访结束时间、从治疗开始到进展为加速期(accelerated phase,AP)/急变期(blastic phase,BP)或因任何原因死亡的时间。疾病进展为AP或BP后,或在血液学不受控制的慢性期(chronic phase,CP)期间发生的死亡才被认为是“CML相关性死亡”。所有其他死亡被归类为“与CML无关的死亡”。若患者出现3或4级中性粒细胞减少[中性粒细胞绝对计数(absolute neutrophil count,ANC)<1.0×109/L]或3、4级血小板减少(50×109/L),则暂停用药。
1.4 统计学分析
采用SPSS 21.0软件进行统计学分析。生存分析采用Kaplan-Meier法,Log-rank检验用于比较各组间的OS 或PFS,MMR 累积发生率采用χ2检验进行比较,在区分竞争性死亡原因时,使用累积发生函数(CIF)估算CML 相关死亡累计发生率,并通过Gray test进行比较。以P<0.05为差异具有统计学意义。
2 结果
2.1 172 例CML-CP 患者确诊时的临床特征及生存情况
诊断时全部患者的中位年龄为46.5(6~80)岁,中位随访时间为12(4~120)个月。其中58.7%患者年龄<50岁。50%以上患者为男性(57.0%)。脾脏肿大的患者有140 例(81.4%),超过肋缘下10 cm 的患者仅1 例(0.6%)(表2)。随访期间,14 例死亡(8.14%),4 例(28.6%)死于与白血病无关的合并症(其中2 例死于感染,1 例死于肾衰竭,1 例死于心血管事件),10例(71.4%)患者因疾病进展而死亡。
2.2 根据各评分系统划分不同风险组的患者分布情况
使用Sokal 评分,分别将61 例(35.47%)、72 例(41.86%)和39 例(22.67%)患者分为低、中和高危组。根据Hasford 评分,分别将91 例(52.91%)、62 例(36.05%)和19 例(11.05%)分为低、中和高危组。根据EUTOS 评分,将152例(88.37%)患者分为低危组,20例(11.63%)患者分为高危且。ELTS 评分低、中和高危组的患者分别为119 例(69.19%)、41 例(23.84%)和12例(6.98%)(表3)。

表2 172例CML-CP患者确诊时的临床特征
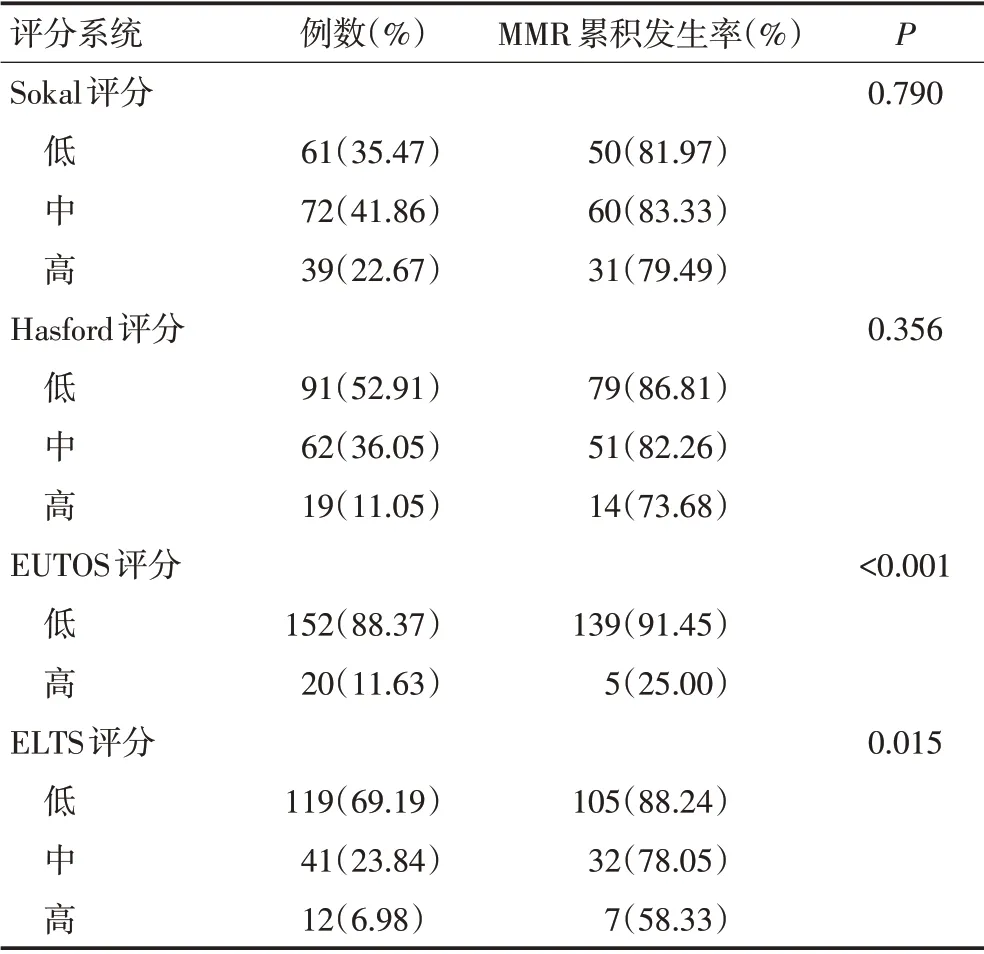
表3 根据各评分系统风险组划分的患者分布情况及MMR 的累积发生率
2.3 4种评分系统各风险组MMR累积发生率的预估情况
在整个观察时间内,28 例(16.28%)患者未实现MMR,而144例(83.72%)患者实现MMR。根据Sokal评分,低、中和高危组的MMR累积发生率分别为81.97%、83.33%和79.49%(P=0.790)。根据Hasford评分,低、中和高危组的MMR累积发生率分别为86.81%、82.26%和73.68%(P=0.356)。根据ELTS评分,低、中和高危组的MMR累积发生率分别为88.24%、78.05%和58.33%(P=0.015)。在EUTOS评分高危患者中,达到MMR的累积发生率显著低于低风险患者(25.00%vs.91.45%,P<0.001)。根据各评分系统风险分组,EUTOS和ELTS评分各组之间MMR存在显著性差异,但Sokal及Hasford评分风险组之间无显著性差异,见表3。
2.4 4种评分系统对CML-CP患者OS的预估情况
低、中和高危组的Sokal评分的5年OS分别为96%、96%和85%(P=0.060);Hasford评分的OS分别为97%、90%和87%(P=0.100)。EUTOS评分低危和高危组的OS分别为97%和71%(P<0.001)。低、中和高危组的ELTS评分分别为98%、93%和67%(P=0.001,图1)。
2.5 4种评分系统对CML-CP患者PFS的预估情况
如图2所示,EUTOS评分低危组和高危组的5年PFS分别为90.1%和63.2%(P<0.05)。ELTS评分低、中和高危组的5年PFS 分别为92.5%、84.2%和49.0%(P<0.05)。而Sokal及Hasford评分的5年PFS无显著性差异(P=0.12,0.08)。
2.6 4 种评分系统对CML-CP 患者CML 相关性死亡的预估情况
在ELTS评分系统中,接受一线伊马替尼治疗的早期CML-CP高危组患者,其8年与CML相关性死亡的发生概率为9%,中危组为7%,低危组为1%,高危组患者死于CML的概率明显高于低危组。ELTS评分在因CML导致相关性死亡方面,差异具有统计学意义(P<0.01),而Sokal、Hasford和EUTOS评分系统在预测“与CML相关死亡性累计发生率”方面均未见显著性差异(P=0.07,0.10,0.08,图3)。
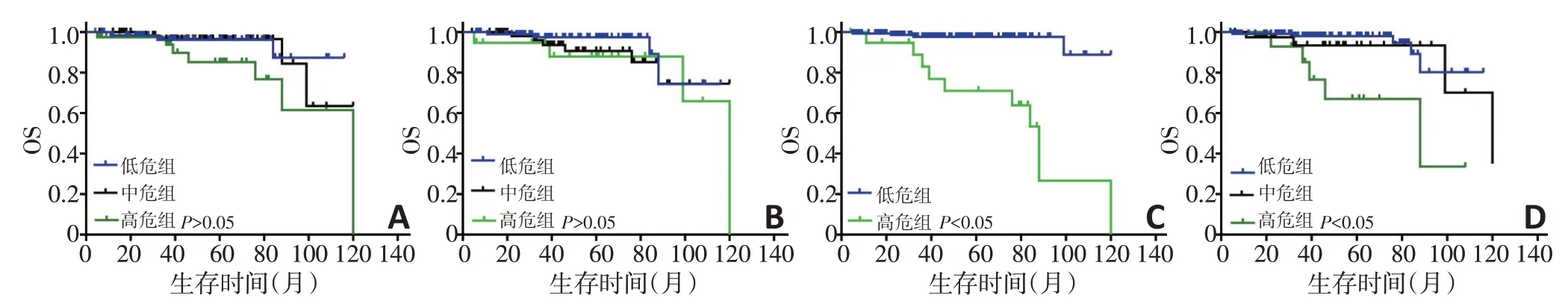
图1 根据Sokal、Hasford、EUTOS和ELTS评分得出OS的Kaplan-Meier分析曲线
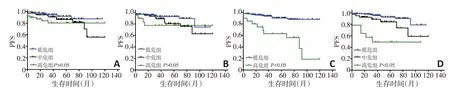
图2 根据Sokal、Hasford、EUTOS和ELTS评分得出PFS的Kaplan-Meier分析曲线
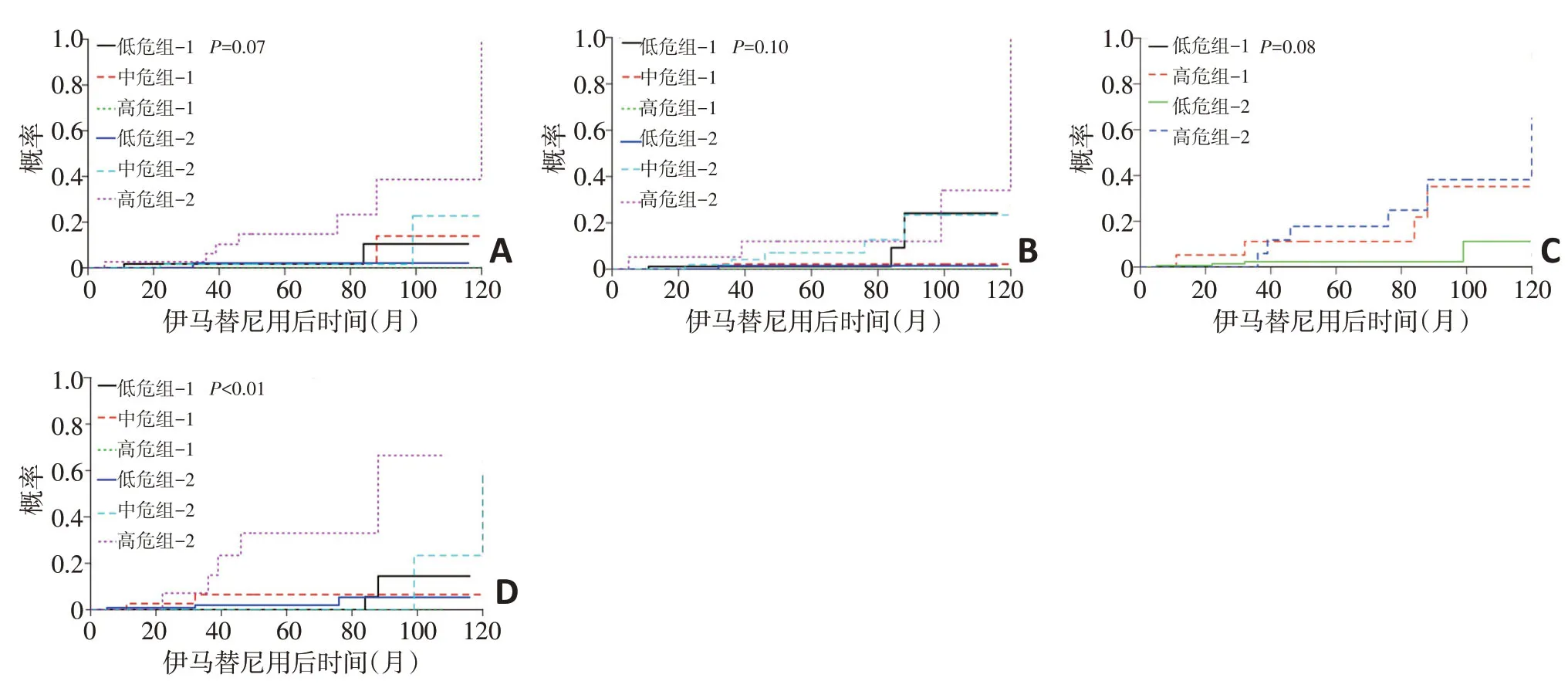
图3 根据4种评分系统进行预后分层CML-CP患者的死亡累计发病率曲线
3 讨论
本研究结果表明,EUTOS 及ELTS 评分在预测接受一线伊马替尼治疗CML-CP 患者的治疗反应、PFS和OS方面的重要性。其中ELTS 评分对CML 相关性死亡概率的区分优于Sokal、Hasford 和EUTOS 评分。证实EUTOS评分有效性的研究结果并不一致。有研究显示,EUTOS评分与患者预后无关,即使是EUTOS高危患者,伊马替尼治疗预后仍良好[11]。同样,也有研究发现[12],在接受TKI 治疗的患者中,EUTOS 评分未能识别出存在不良预后的患者。一项更大规模的对1 288 例接受伊马替尼治疗的CML 患者研究表明[13],EUTOS 评分可以有效地预测到CML-CP 患者的不良预后。除了大部分持否定态度的结果外,既往的一些研究还对EUTOS评分预测伊马替尼治疗的最佳反应进行了探讨。有研究表明[14],EUTOS 评分并不能预测伊马替尼的最佳反应,但EUTOS 评分高危组与长期观察后患者的疾病进展(AP/BP)相关。Bonifacio等[15]研究发现,EUTOS评分可以预测3个月和6 个月时的早期最佳反应,但不能预测12 个月时的最佳反应。
本研究发现,EUTOS 评分系统在国内人群中具有重要的价值。EUTOS评分仅根据初诊时患者脾脏大小和外周血中嗜碱性粒细胞百分比来进行分类评估,其在简单性和实用性方面均具有优越性,使得EUTOS分数更适合于不同的临床环境。下述因素可能导致本研究与其他研究的结果不同。
首先,潜在原因为研究中治疗药物的类型或剂量的不同,EUTOS评分系统仅根据接受伊马替尼治疗患者的相关数据得出,并不包括接受各种不同的第二代TKI治疗的患者[6],本研究剔除了接受一线或二线第二代TKI治疗的患者43例,保证了研究的准确性。Marin等[16]通过分析282例接受一线伊马替尼治疗的CML患者,发现EUTOS评分系统并不能准确地预测患者的OS及MMR,其研究包括转换到第二代TKI(95例)治疗的患者,并且未提供伊马替尼剂量的相关信息。更为有效TKI的出现和使用,可能会使第一代伊马替尼治疗效果较差的患者在第二代或第三代TKI中达到较好的疗效从而造成结果差异。
其次,种族之间药代动力学差异和药效学变化可能会导致反应和结果差异,本研究结果与既往大部分来自中国、印度及土耳其等亚洲国家的研究结果相似[17-19],而与英国、德国等西方国家相反[16,20]。本研究为单中心研究,患者平均脾脏大小为4 cm,比部分研究观察到的脾脏要小得多[11,17]。这可能与临床中应用不准确的触诊方法测量所致。
最后,患者对CML治疗的依从性不同,未获得阳性结果的部分研究可能是由于其患者在治疗过程中因疗效降低和医疗费用增加而导致依从性差,进而无法获得足够的分子应答。保持对治疗的良好依从性被认为是治疗的重要目标,尽管在本研究中未进行评估,但上述因素可能会对评分系统在CML 患者中的研究结果产生影响。
欧洲一项基于人口注册表的关于CML特征和流行病学的研究显示[21],2 904例新诊断的CML患者中94.3%患者被诊断为CP,中位年龄为56 岁,55.5%患者患有合并症,其中以心血管疾病为主(41.9%)。随着老年患者年龄的增长,合并症的增加及TKI的有效治疗,近一半的患者死于与CML 无关的原因[22]。为了充分评估治疗效果,最合适的方法为关注CML 导致的死亡事件。ELTS 评分系统是在考虑到CML 相关性死亡的第一个长期生存预后评分。在临床实践中,ELTS 可用于指导选择出CML 相关性死亡率较高的患者人群,上述患者可能在第二代或第三代TKI治疗中获益更多。考虑到本研究分析的患者数量有限,并且国内外关于ELTS 评分系统临床意义的综合研究较少,亟需更大规模的前瞻性多中心研究来验证ELTS评分在CML患者中的实用性。
本研究中的数据验证了EUTOS 评分及ELTS 评分的有效性。随着治疗策略的变化(如干扰素α和伊马替尼、第二代TKI 的应用)导致新的风险评分系统的产生,以纠正目前可用的风险评分系统所存在的缺陷。为了解决上述问题,建议新的评分系统标准应包括多种治疗选择(不仅限于伊马替尼,如第二代TKI)等复杂治疗方案的CML患者。建议采用标准化客观地测量脾脏大小的方法,如超声或CT,以取代目前不精确的触诊。应进行更多基础研究以清楚地阐明目前使用的评分系统参数和疾病发病机制之间的联系,提出改进的、新的预后参数,便于迅速、准确、有效地指导治疗以达到最佳疗效。综上所述,随着CML 患者可用治疗方案的增加,对风险分层的需求也越来越高。理想的评分标准应该简单,能被普遍接受,并且能以高度的敏感性和特异性清楚地区分各风险组,有助于更好地调整前期治疗。
