小牛血清去蛋白对脑缺血-再灌注损伤模型大鼠血脑屏障的保护作用研究*
2019-04-18郑永强
邓 超,郑永强,徐 悦
(湖北省十堰市人民医院·湖北医药学院附属人民医院神经内科,湖北 十堰 442000)
脑卒中又称中风、脑血管意外,为急性脑血管疾病,其中缺血性卒中占60%~70%。脑缺血触发的病理改变会影响血脑屏障(BBB)的通透性[1],导致脑水肿和局部炎症。本研究中以小牛血清去蛋白用于脑缺血-再灌注损伤模型大鼠,并分析其对模型大鼠BBB的影响。现报道如下。
1 材料与方法
1.1 动物、仪器与试药
动物:清洁级SD大鼠100只,雌雄各半,体质量为(250±20)g,购自湖北医药学院实验动物中心,动物生产合格证号:SCXK<鄂>2017-0008,适应性喂养,自由进食和饮水,人工黑暗和光照交替,在体质量达到(270±20)g时纳入实验。本研究经医院动物实验伦理审查委员会批准,实验中大鼠的处置方法符合动物伦理学要求。
仪器:JEM-2000EX型透射电镜(日本电子光学公司);CM3050S型冰冻切片机(德国Leica公司);BX-51型显微镜及图像分析系统(日本Olympus公司)。
试药:小牛血清去蛋白肠溶胶囊(锦州奥鸿药业有限公司,国药准字H20090346,规格为每粒5 mg,批号为 2820170104);兔抗带状闭合蛋白 -1(ZO-1,美国CST公司);免疫组化试剂盒(美国Molecular Probes公司);伊文斯蓝(EB,美国 Sigma-Aldrich 公司)。
1.2 方法
建模、分组与给药:按随机数字表法将100只SD大鼠分为假手术组(A组,等体积0.9%氯化钠溶液)、模型组(B组,等体积0.9%氯化钠溶液)及小牛血清去蛋白低剂量组(C1组,7.5 mg/kg,按肽量计,下同)和高剂量组(C2组,37.5 mg/kg),各 25 只。灌胃给药,每天1次,连续10 d。参考线栓法相关文献[2],阻断大鼠大脑中动脉,于缺血2 h后再灌注24 h,以建立脑缺血再灌注损伤模型。观察大鼠左侧肢体肌力减弱,运动左偏,解剖未见蛛网膜下腔出血则表明模型复制成功。A组除不阻断大鼠大脑中动脉外,其余操作同上。
脑组织EB染色:再灌注24 h后,于处死大鼠前1 h静脉输入EB 0.9%氯化钠注射液(0.2 mL/100 g)。腹腔注射10%水合氯醛(5 mL/kg),心脏注入0.9%氯化钠注射液,开颅取脑,称定大鼠脑湿质量,切碎块,置试管中,加4 mL甲酰胺,恒温避光环境水浴3 d,3 000 r/min离心10 min,取上清液,于620 nm波长处测定吸光度值,计算脑组织EB含量。
BBB超微结构观察:再灌注48 h内,腹腔注射10%水合氯醛(5 mL/kg)以麻醉大鼠(40 mg/kg),其中 B 组大鼠固定再灌注 0.5,2,6,12,24 h 时麻醉。经左心室输注0.9%氯化钠注射液60 mL,灌注镧醛固定液50 mL,开颅取脑。将脑组织从视交叉向后冠状切片成约1 mm,分别在缺血同侧和对侧相应部位的皮质及底节区各取2小块脑组织,以透射电镜观察再灌注0.5,2~6,12~24,48 h时大鼠BBB的超微结构。
免疫组化:再灌注24 h后,建模成功后腹腔注射10%水合氯醛(5 mL/kg)以麻醉大鼠,多聚甲醛心脏灌流,取脑组织,10%甲醛溶液固定24 h,并经石蜡包埋,脱水、切片、染色。按试剂盒说明书操作,以图像分析系统检测ZO-1阳性血管数目。
1.3 统计学处理
2 结果
2.1 大体、光镜、电镜观察结果
大体标本可见,模型大鼠缺血侧脑组织呈蓝染,而对侧未见蓝染(见图1),显示大鼠脑间质及神经纤维肿胀,缺血处细胞变少,并同正常组织形成了移行带。电镜可见,B组大鼠脑组织内皮细胞皱缩,管腔变形,基底膜断裂;而C2组在光镜下缺血部位有轻度间质水肿,但不及B组的肿胀程度;肿胀程度较轻,基底膜尚未断裂,较完整;C1组介于B组和C2组之间(见图2)。
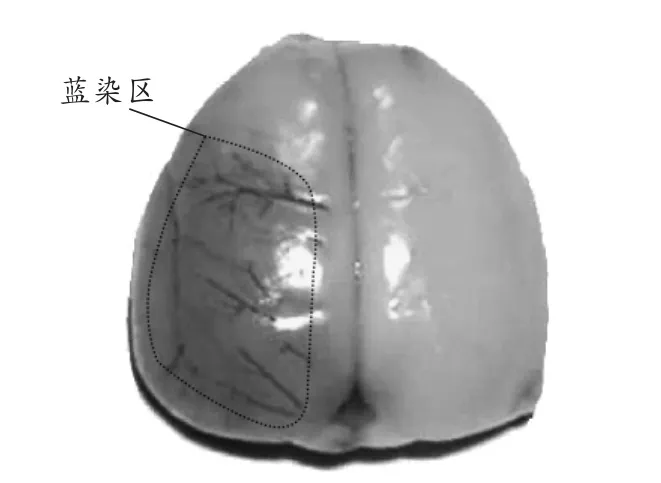
图1 模型组大鼠脑组织染色大体图
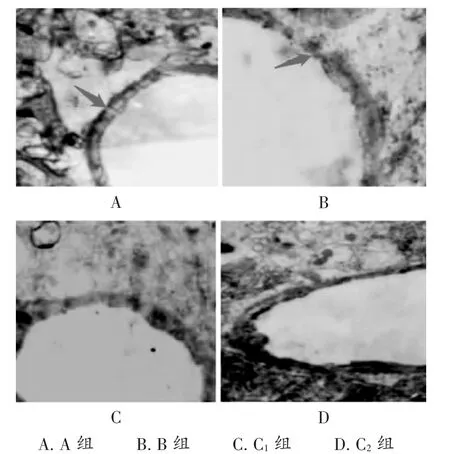
图2 右半侧大脑皮质额叶冠状切片电镜观察图(HE,×400)
2.2 BBB超微结构观察结果
由图3可见,A组大鼠脑组织非缺血区的脑血管内皮细胞形态、内皮细胞间的紧密连接(TJ)正常,未见镧颗粒。再灌注0.5 h,大鼠脑组织缺血区开始肿胀,星型胶质细胞足突有轻度肿胀,但与毛细血管基底膜连接仍较紧密;内皮细胞出现肿胀,其胞质内线粒体增多,TJ处可见镧颗粒。再灌注2~6 h后,大鼠缺血区脑组织肿胀,胶质足突及血管基底膜分离,间隙增加;内皮细胞肿胀更明显,可见空泡,胞质内见到镧颗粒;神经纤维微管排列不整齐,细胞间隙中有镧颗粒。再灌注12~24 h时,大鼠脑组织缺血区严重肿胀,结构疏松,神经细胞、胶质细胞变性坏死,核溶解,细胞内见到镧颗粒;基底膜不连续;镧颗粒经血管漏出至脑实质。再灌注48 h时,大鼠脑组织缺血区基本已无正常结构,可见大量小胶质细胞,其胞质内有脂滴、坏死组织等,形似泡沫细胞;内皮细胞皱缩,胞质电子密度变大,胞质内可见髓样体。
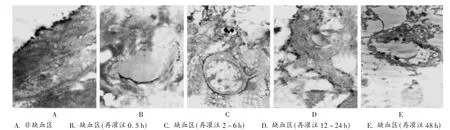
图3 BBB超微结构图
2.3 EB含量和ZO-1阳性血管检测结果
结果见表1。与A组比较,B组大鼠脑组织EB含量显著增加,ZO-1阳性血管数显著减少(P<0.05);与B组相比,C1组和C2组大鼠脑组织EB含量显著减少,C2组ZO-1阳性血管数显著增加(P<0.05)。
表1 各组大鼠脑组织EB含量和ZO-1阳性血管数比较(±s)

表1 各组大鼠脑组织EB含量和ZO-1阳性血管数比较(±s)
注:与A组比较,#P<0.05;与B组比较,*P<0.05。
组别A组B组C1组C2组EB 含量(μg/g)10.53±1.28 54.69±2.20#49.52±2.27*44.91±3.15*ZO-1阳性血管数(条)9±2 2±1#3±1 4±2*
3 讨论
BBB是脑组织结构的一部分,对神经系统有保护作用,微血管内皮细胞是BBB的基本组成部分,它们形成了保障局部环境稳定的第一道防线[3]。缺血再灌注后,缺血半暗带组织可继续存活[4];但再灌注会导致代谢失衡[5],使乳酸、炎性因子及自由基等生成过多[6],令细胞骨架变化,细胞间连接数量变少[7],BBB通透性升高[8]。ZO-1是TJ的重要成分[9],可参与TJ跨膜蛋白的联系[10],其对生化反应敏感[11],脑缺血时,能及时应答炎性细胞因子[12],导致相关复合体解离,最终影响BBB[13]。
本研究结果显示,大鼠缺血区脑组织BBB通透性改变的程度与再灌注的时间紧密相关。再灌注0.5 h时,BBB的TJ开放;再灌注2~6 h时,内皮细胞出现空泡化,胞质有吞噬的镧颗粒,说明胞膜的通透性开始增大,足突与基底膜开始分离,镧颗粒沉积在细胞间隙;再灌注12~24 h后,BBB结构严重破坏,大量镧颗粒漏入脑实质;再灌注48 h,内皮细胞不完整,大量神经细胞、胶质细胞坏死崩解,小胶质细胞胞质内充满的脂滴和坏死组织形成的类似泡沫细胞的结构提示组织开始修复。说明BBB的通透性在再灌注24 h内逐渐升高,在48 h后逐渐降低。脑缺血模型大鼠脑组织ZO-1阳性血管数显著减少,EB含量增多,脑水肿程度加重。其原因可能为再灌注增加的炎性因子降低了ZO-1表达,引起内皮细胞的骨架变化,跨膜蛋白的连接程度变小,BBB通透性改变,局部稳态失衡。与B组比较,C1组和C2组大鼠脑组织EB含量显著减少,C2组ZO-1阳性血管数显著增加。表明小牛血清去蛋白可影响ZO-1蛋白表达,从而维系TJ复合体的结构,进而保护BBB。
综上所述,小牛血清去蛋白对脑缺血再灌注损伤模型大鼠BBB具有保护作用,其机制可能与稳定缺血区脑细胞和增强ZO-1表达有关。
