反相高效液相色谱法对小鼠血清中基因重组人促肾上腺皮质激素前体及其代谢物的测定
2019-04-18武新丽韦双双裴业春赵景锋王大勇
武新丽,韦双双,裴业春,3,赵景锋,王大勇
(1.海南大学 海南省热带生物资源可持续利用重点实验室,海口 570228; 2.海南大学 热带农林学院生物学院 生物技术与分子药理实验室,海口 570228; 3.海南大学 热带农林学院 动物科技学院,海口 570228 )
促肾上腺皮质激素(Adrenocorticotropic hormone,ACTH)又称为促皮质素(Corticotropin),是由 39 个氨基酸构成的多肽激素,主要由垂体前叶分泌,也发现于下丘脑、肾上腺髓质等组织[3-4]。ACTH能够调控糖皮质激素(GC)的合成与分泌,影响糖、脂肪和蛋白质的合成与代谢,调节心脑血管功能,提高机体抵抗力,促进神经损伤恢复与再生,还具有抗炎、免疫抑制、抗毒素、抗休克等作用。ACTH是治疗两岁以下婴儿惊厥症的唯一特效药,该病发病率为0.5%~1%,6%~33%的婴儿惊厥症患儿在3岁前死亡,70%~90%患儿智力发育缓慢,30%发展为自闭症。除此之外,ACTH也用于红斑狼疮、多发性硬化病急性恶化、肾病综合征、全身性皮肌炎和结节病的治疗,以及银屑病关节炎、风湿性关节炎、强直性脊柱炎以及严重眼部过敏和炎症等的辅助治疗[5]。ACTH的半衰期很短,约为10 min,需要反复大量用药[6]。目前,国内临床应用的ACTH由家猪的脑垂体中提取,容易传播动物病毒和支原体。人工合成的ACTH(1-24)的体内半衰期更短,并且工业化生产成本高,未见药用。ACTH(1-39)的前体蛋白是鸦片样肽促黑激素促皮质激素原(Propiomelanocortin,POMC),天然存在酶切底物序列(POMCst),在体内逐步被丝氨酸内切酶——激素原转化酶1(Prohormone convertase 1,PC1),PC2和PC3水解,释放出ACTH(1-39)[7-9]。此外,POMC经蛋白酶酶切还可以产生其他多种代谢产物,包括γ-促脂素、γ3-促黑素和γ1-促黑素等[10-11]。在前期实验中,本试验室构建了多种基因重组人促肾上腺皮质激素前体蛋白,其中一种由141个氨基酸构成的ACTH前体蛋白(ProACTH141)在血液中比ACTH更加稳定,并且具有良好的药理作用。在ProACTH141的结构中ACTH的N末端增添了一段多肽链,可以防止具有药理活性的N末端被氨肽酶快速降解,从而降低微生物表达过程中的降解速度;延长药物的体内半衰期,减少给药次数和剂量。基因工程制药法还可以避免传播动物病毒的潜在风险。研究目的是探讨采用反相高效液相色谱(RP-HPLC)法同时测定在一定的时间内小鼠血清中重组人促肾上腺皮质(ACTH)激素前体蛋白(ProACTH141)及其代谢产物ACTH(1-39)的实验方法,用于分析ACTH前体蛋白质的药物代谢动力学特性。
1 材料与方法
1.1仪器与材料LC-20AD高效液相色谱仪 (日本岛津)、ME204E/02电子天平(梅特勒-托利多仪器公司)、PS-40超声波清洗仪(深圳超艺达科技有限公司)。ACTH(1-24)(批号:human-20180810,纯度≥95.0%,生工生物工程有限公司),ACTH(1-39)(批号:P14976-20171124,纯度≥95.0%,生工生物工程有限公司),乙腈和三氟乙酸(色谱纯,北京迈瑞达科技有限公司)。SPF级昆明种雄性小鼠(5周龄)(海南省实验动物中心)。
1.2载体构建针对BL21-DE3基因工程菌密码子偏好性,优化HisTag-EKst-ProACTH141 cDNA核苷酸序列,并在5' 端添加NdeI酶切位点,在3' 端添加SalI酶切位点,人工合成cDNA。合成的cDNA经NdeI和 SalI双酶切。回收cDNA酶切片段连接至同样双酶切的pET21a载体,以构建pET21a- HisTag-EKst-ProACTH141原核表达质粒。
1.3HisTag-EKst-ProACTH14蛋白原核表达将构建好的原核表达质粒pET21a-HisTag-EKst-ProACTH141转化入BL21-DE3工程菌感受态细胞,复苏2 h后接种到含有阳性筛选抗生素的LB半固体培养基,37 °C培养16 h后挑取单克隆菌落至50 mL 含有氨苄青霉素的 LB 液体培养,37 °C,180 r·min-1振荡过夜。按1∶50接种到250 mL的含有氨苄青霉素的 LB 液体培养,OD600= 0.6~0.8。移取1 mL菌液作为非诱导对照,剩余菌液加入IPTG(终浓度0.1 mmol·L-1),37 °C诱导表达 5 h 后采样,SDS-PAGE电泳并考马斯亮蓝染色检测表达量。
1.4HisTag-EKst-ProACTH141蛋白的纯化诱导表达后的菌液经6 000 r·min-1离心15 min收集菌体,每克湿重加入8 mL非变性裂解液(50 mmol·L-1Tris-HCl, 300 mmol·L-1NaCl,10 mmol·L-1咪唑,pH 8.0)缓慢洗涤菌体。6 000 r·min-1,4 °C 离心10 min收集沉淀,反复洗涤3次。将菌液置于冰上,用超声破碎仪破碎菌体,破碎功率为 400 W,破碎3 s,暂停5 s,反复破碎至菌液澄清。6 000 r·min-1,4 °C离心 20 min,收集合并上清液,用镍柱纯化HisTag-EKst-ProACTH141蛋白质。
1.5肠激酶酶切及ProACTH141蛋白的纯化测定纯化后的HisTag-EKst-ProACTH141蛋白浓度,1 U肠激酶(EK)催化水解50 μg融合蛋白,1 μL≈3.3 U。带His标签的肠激酶溶解于酶切缓冲液(25 mmol·L-1Tris-HCl,pH 7.6,50 mmol·L-1NaCl,2 mmol·L-1CaCl2),25 °C温育16 h,切割约95%样品中的 HisTag-EKst-ProACTH141多肽链,得到游离的ProACTH141以及HisTag-EKst片段。用平衡缓冲液(50 mmol·L-1NaH2PO4,300 mmol·L-1NaCl,10 mmol·L-1咪唑,pH 8.0)平衡 Ni柱,将EK酶切后的样品液缓慢加至Ni柱中,流出液即为纯化的ProACTH141目的蛋白质。
1.6小鼠处理5周龄昆明种雄性小白鼠随机分为2组,分别为对照组和ProACTH1411实验组,每组12只。实验组尾静脉注射ProACTH141,剂量为56 pmol·g-1,对照组注射等体积生理盐水。注射1,5,10,15,20,30,45,60,80和100 min后摘眼球采血,4 °C,4 000 r·min-1离心10 min,收集血清[12]。
1.7标准品溶液的制备分别称取适量纯度超过95%的ACTH (1-24),ACTH(1-39)和ProACTH141冻干粉,溶解于0.1% TFA溶液,通过预实验确定每种多肽或蛋白质标准品的保留时间。以浓度为0.3 mg·mL-1ACTH(1-24)作为定量标准品。
1.8样品预处理取2 μL ACTH(1-24)储备液加入298 μL血清中,加入600 μL乙腈充分振荡10 min,5 000 r·min-1离心10 min弃去上清。缓慢吹入氮气挥去乙腈,加入298 μL 0.1% TFA,振荡使其充分溶解,再次离心后取上清,以0.45 μm针头式滤器过滤[13-14]。
1.9色谱条件色谱柱:Inertsil®C18柱(4.6×150 mm,Ø 5 μm) ,流速:1.0 mL·min-1,进样体积: 20 μL,柱温:室温,检测波长:280 nm,流动相:0.1% 的TFA(A)-含0.1% TFA的乙腈(B)梯度洗脱液[15],梯度程序见表1。

表1 HPLC 梯度洗脱程序
3 结果与分析
3.1载体构建重组质粒NdeⅠ和 SalⅠ双酶切,琼脂糖凝胶电泳,条带大小和预测大小(477 bp)相符(图1A)。
3.2ACTH141蛋白诱导表达及镍柱亲和层析纯化诱导物IPTG终浓度为0.1mmol·L-1,大肠杆菌在37 °C诱导表达5 h后,SDS-PAGE电泳结果表明上清液中存在较大量HisTag-EKst-ProACTH141蛋白(表观相对分子质量约25×103),并且纯化效果良好(图1B)。

图1 重组质粒pET21a-HisTag-EKst-ProACTH141双酶切鉴定及蛋白的原核表达及纯化结果
3.3肠激酶酶切及ProACTH141蛋白的纯化HisTag-EKst-ProACTH141蛋白经带有组蛋白标签的EK酶切得到proACTH141。HisTag-EKst-ProACTH141及ProACTH141经SDS-PAGE(15% Tris-Glycine聚丙烯酰胺凝胶)分离,转印到硝酸纤维素膜后用抗体检测,一抗为鼠抗人ACTH(Abcam)抗体,二抗为Alexa488标记的羊抗鼠抗体(Abcam),用Typhoon FLA 9500(GE Healhcare)检测荧光条带,见图2泳道1,2所示。
3.4ProACTH141,ACTH(1-39)及ACTH(1-24)的RP-HPLC色谱图ProACTH141,ACTH(1-39)及ACTH(1-24)冻干粉溶解于0.1%TFA中,用配备了C18反相色谱柱的岛津高效液相色谱仪检测3种蛋白质或多肽的系统保留时间。经测定,ACTH(1-24)的保留时间为(13.23±0.02) min,ACTH(1-39)的保留时间为(15.24±0.05) min,ProACTH141的保留时间为(26.12±0.05 min)(图3)。

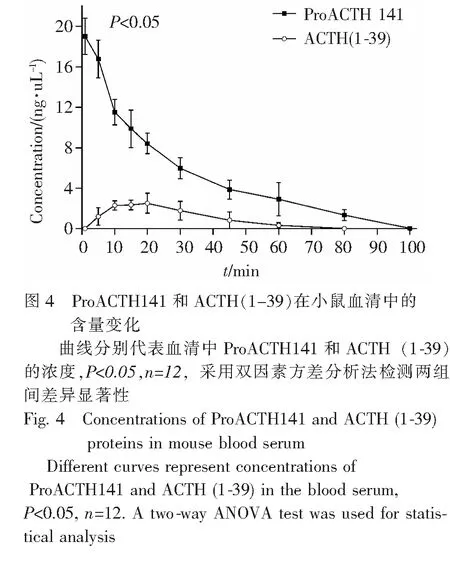
3.5不同时间血清中ProACTH141及ACTH(1-39)的含量尾静脉注射ProACTH141蛋白,注射后1,5,10,15,20,30,45,60,80和100 min快速摘眼球采血。通过HPLC反相色谱法测定ProACTH141蛋白及其代谢物ACTH(1-39)在小鼠血清中的含量,ProACTH141蛋白含量1 min 时的浓度为19.01 mg·L-1,然后逐渐降低,在100 min时恢复到血清基线水平,其半衰期(T1/2)为21.9 min。ACTH(1-39)的血清达峰时间(Tmax)约为20 min,其后逐渐降低。从1~100 min,ProACTH141和ACTH(1-39)的药时曲线下面积(AUC)分别为538.2和88.2 (mg·L-1)·min-1。
3 讨 论
ACTH是治疗小儿痉挛症的唯一特效药,目前国内仅有一家生化药厂从动物脑垂体中提取生产,成本较高,供不应求[16]。美国同类药品Acthar单剂(5 mL)价格超过4万美元(CVS Pharmacy/Walgreens,2018.11)。人体内天然存在识别POMC酶切底物序列(POMCst)的蛋白酶,包括PC1,PC2和PC3。其酶切过程分为3个部分。(1)PC1和PC3可酶切得到β-促脂素和ACTH前体2段多肽链。(2)PC1,PC2和PC3共同发挥作用,PC1,PC3识别ACTH前体中的酶切位点,PC2识别β-促脂素中的酶切位点。(3)PC2发挥酶切作用释放出具有生物活性的短肽[18]。POMC在3种蛋白酶作用下,逐渐水解释放出游离的ACTH(1-39)。针对这一酶切特性,笔者设计表达了多种ACTH前体药物,一方面考察不同长度的ACTH前体是否具有与ACTH相同的药理作用,另一方面考察它们的药物代谢动力学特性,包括T1/2,Tmax和AUC。前期预实验中发现包含141个氨基酸的ACTH前体蛋白ProACTH141不但具备良好的药效,并且在血液中的半衰期较长,发挥药效的时间长于ACTH(1-39)。本研究采用RP-HPLC法测定ProACTH141蛋白其T1/2,其结果与预实验的一致,并长于ACTH(1-39)。
针对待分离的蛋白质,笔者对分析条件作了优化。首先,选择从血液中提取ProACTH141及ACTH(1-39)的溶剂。采用液液萃取法,比较了甲醇、乙腈等多种溶剂对注射到血液中的ProACTH141及ACTH(1-39)的提取效果。其中,乙腈对两者的提取回收率均较高,且色谱峰形对称,故以乙腈作为提取溶剂。其次,选择检测波长。取标准品混合液注入RP-HPLC,应用PDA检测器,在210 nm及280 nm波长扫描[19],结果显示3个成分在210 nm和280 nm均有较好的紫外吸收,其中280 nm紫外吸收高于210 nm,且基线和峰形较好,干扰少,色谱图较理想,因此选择280 nm作为检测波长。第三,流动相的选择。由于血清成分复杂,用组分恒定的流动相难以将ProACTH141与ACTH(1-39)很好地分离而且保留时间较长,因此,本试验采用两种流动相(A与B)混合梯度洗脱。通过比较多种流动相系统,确立以0.1%(V/V)TFA缓冲液(A)与含0.1%(V/V)TFA缓冲液的乙腈溶液(B)混合梯度洗脱,色谱分离度较高,基线平稳。
