濒危兰科植物DNA的提取方法
2019-04-18潘英文王安石李佳潼谢添伟陈施明刘福秀林明光
潘英文,张 凌,王安石,李佳潼,谢添伟,陈施明,刘福秀,林明光
(海南出入境检验检疫局 热带植物隔离检疫中心,海口 570311)
兰科植物极具观赏价值,近年来其分子生物学研究越来越多。DNA的提取是基因克隆、PCR 扩增、分子杂交以及遗传多态性分析等分子生物学研究的基础。按照《濒危野生动植物种国际贸易公约》,兰科植物大多为濒危植物,濒危兰科植物约占公约保护植物总数的90%,是进出境物种资源查验工作的重要组成部分。由于处于非生育期的许多兰科植物种类间形态差别很小,仅凭形态特征较难分类。目前,兰科植物大多采用DNA条形码方法如atpF-atpH,rbcL,rpoB,rpoC1,psbA-trnH,matK和核糖体ITS等序列来加以鉴定[1-2]。这些方法都需要获得高质量DNA才能进行。为了适应相对恶劣的环境,濒危野生兰科植物细胞壁坚韧含有与抗逆有关的多种化合物,如多糖、脂类、多酚等次生代谢物,高质量的基因组DNA提取相对困难,经典的DNA提取方法有CTAB法和SDS法[3-10]。为探索简便和高效的兰科植物基因组DNA提取方法,笔者对应用较广、成本较低的CTAB法和SDS法进行适当改良,并与试剂盒法一起对濒危兰科植物基因组DNA进行提取,比较不同提取方法的效果及优缺点,旨在筛选出提取兰科植物基因组DNA的有效方法,为开展兰科植物后续的分子生物学研究提供参考。
1 材料与方法
1.1材料供试材料来自海南出入境检验检疫局热带植物隔离检疫中心种质资源圃保存的濒危兰科植物,分别是金钗石斛Dendrobiumnobile、卷萼兜兰Paphiopedilumappletonianum、春兰Cymbidiumgoeringiivar.goeringii、矮万代Vandapumila、云南火焰兰Renantheraimschootiana、小兰屿蝴蝶兰Phalaenopsisequestris,选取植株叶片为材料,每植株采集2~3片叶,放入已编号的封口袋中并立即拿回实验室放入-70 ℃冰箱内贮存。
1.2DNA提取方法
1.2.1 改良CTAB法取新鲜叶片100 mg,置于研钵中,加入液氮,研磨成粉,将粉末转至2 mL的离心管中,再加入800 μL的CTAB提取缓冲液(50 mmol·L-1Tris-HCl,20 mmol·L-1EDTA,700 mmol·L-1NaCl,φ=l%β-疏基乙醇,φ=2% CTAB,pH8.0);混匀后65 ℃水浴30~40 min,振荡混匀2~3次,放置冷却至室温,加入等体积的V酚︰V氯仿︰V异戊醇=25︰24︰1振荡混匀,4 ℃,12 000 r·min-1离心10 min;取上清液转入一新离心管,加入1/10倍体积的3 mol·L-1NaAc和等体积的无水乙醇,混匀,冰上放置10~15 min,4 ℃,12 000 r·min-1离心10 min;弃上清,沉淀用φ=70%乙醇洗涤2次,加入800 μL TE溶解后,加入等体积的V酚︰V氯仿︰V异戊醇=25︰24︰1振荡混匀,4 ℃,12 000 r·min-1离心10 min;取上清液转入一新离心管,加入等体积的V氯仿︰V异戊醇=24︰1振荡混匀,4 ℃,12 000 r·min-1离心10 min;取上清液转入一新离心管,加入1/10倍体积的3 mol·L-1NaAc和等体积的无水乙醇混匀,冰上放置10~15 min,4 ℃,12 000 r·min-1离心10 min;弃上清,沉淀用70%乙醇洗涤2次,室温静置2~3 min晾干,加入100 μL TE或ddH2O溶解,加入10 g·L-1RNase液2 μL混匀,37 ℃保温30 min,置于-20 ℃冰箱中保存。
1.2.2 改良SDS法取新鲜叶片100 mg,置于研钵中,加入液氮,研磨成粉,将粉末转至2 mL的离心管中,再加入800 μL的SDS提取缓冲液(100 mmol·L-1Tris-HCl,50 mmol·L-1EDTA,500 mmol·L-1NaCl,φ=l%β-疏基乙醇,φ=3% SDS,pH8.0);混匀后 65 ℃水浴10 min;加1/5体积的5 mol·L-1KAc于冰上放置30 min,4 ℃,13 000 r·min-1离心15 min;取上清液入一新离心管,加入等体积的V酚︰V氯仿︰V异戊醇=25︰24︰1振荡混匀,4 ℃,12 000 r·min-1离心10 min;取上清液转入一新离心管,加入等体积的V氯仿︰V异戊醇=24︰1振荡混匀,4 ℃,12 000 r·min-1离心10 min;取上清液转入一新离心管,加入0.6倍体积的异丙醇混匀,冰上放置10~15 min,4 ℃,12 000 r·min-1离心10 min;弃上清,沉淀用φ=70%乙醇洗涤2次,室温静置2~3 min晾干,加入100 μL TE或ddH2O溶解,加入10 g·L-1RNase液2 μL混匀,37 ℃保温30 min,置于-20 ℃冰箱中保存。
1.2.3 试剂盒法使用TIANGEN植物基因组DNA提取试剂盒,按照试剂盒操作手册提取DNA。
1.3DNA检测
1.3.1 DNA浓度与纯度检测使用Thermo Nanodrop 2000核酸分析仪测定3种方法提取的DNA样品230 ,260,280 nm处的光吸收值,根据OD260/OD280和OD260/OD230的比值确定DNA纯度。
1.3.2 琼脂糖凝胶电泳检测取5 μL样品DNA加上Loading buffer后,使用w=1%琼脂糖凝胶,在0.5×TBE缓冲液中,3 V·cm-1恒压电泳1~2 h(Power PAC3000电泳仪,BIO-RAD)。根据电泳结果检测DNA质量。
1.3.3 PCR扩增检测根据第3届条形码国际学术大会上建议的兰科植物DNA条形码片段,选择用通用引物ITS进行PCR扩增[11-12],以上述3种方法提取的DNA 样品为模板进行PCR反应及电泳检测,以检测提取的DNA中是否有抑制PCR反应的成分存在。PCR反应体系:10 μL 2×PrimeStar Max premix(TaKaRa), 0.4 μmol·L-1引物, 6~10 mg·L-1模板DNA, 用ddH2O补充至20 μL。反应程序: 94 ℃预变性8 min; 94 ℃变性45 s,60 ℃退火45 s,72 ℃延伸1 min,35个循环; 72 ℃延伸6 min,4 ℃保存。扩增产物用1%琼脂糖凝胶电泳检测,以DL2000 marker (TaKaRa) 为参照,凝胶成像系统下观察并拍照。
2 结果与分析
2.1DNA浓度与纯度检测由表1可看出,试剂盒法提取DNA质量最好,OD260/OD280为1.8~1.9,OD260/OD230﹥2,表示蛋白质,RNA、盐类、有机溶剂等杂质污染很少,DNA纯度较高,但DNA浓度明显低于其他2种方法。CTAB法提取DNA质量较好,DNA浓度较高,OD260/OD280为1.7~1.9,说明蛋白质及RNA污染较少,但OD260/OD230大多低于2.0,表示存在少量盐类或有机溶剂等其他杂质污染。SDS法提取的DNA虽然浓度较高,但DNA质量较差,OD260/OD280均低于1.8,OD260/OD230均低于2.0,表示DNA纯度较低,存在蛋白质、RNA、盐类、有机溶剂等杂质污染现象。

表1 3种方法提取基因组DNA质量及浓度检测
2.2琼脂糖凝胶电泳检测DNA的提取质量由图1可看出,CTAB法提取的DNA电泳后样品孔干净,杂质含量较低,DNA条带清晰完整,亮度较高,有轻微拖尾现象;SDS法提取的DNA电泳后样品孔残留部分杂质,杂质较多,DNA条带较模糊,亮度较低,且有较严重的拖尾现象,DNA存在降解情况;试剂盒法提取的DNA样品孔干净无杂质,DNA电泳条带清晰,无明显拖尾现象,但亮度较低。
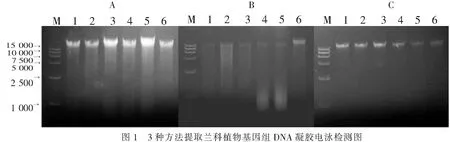
A.改良CTAB法;B.改良SDS法;C.试剂盒法;1.金钗石斛;2.卷萼兜兰;3.春兰;4.矮万代;5.云南火焰兰;6.小兰屿蝴蝶兰
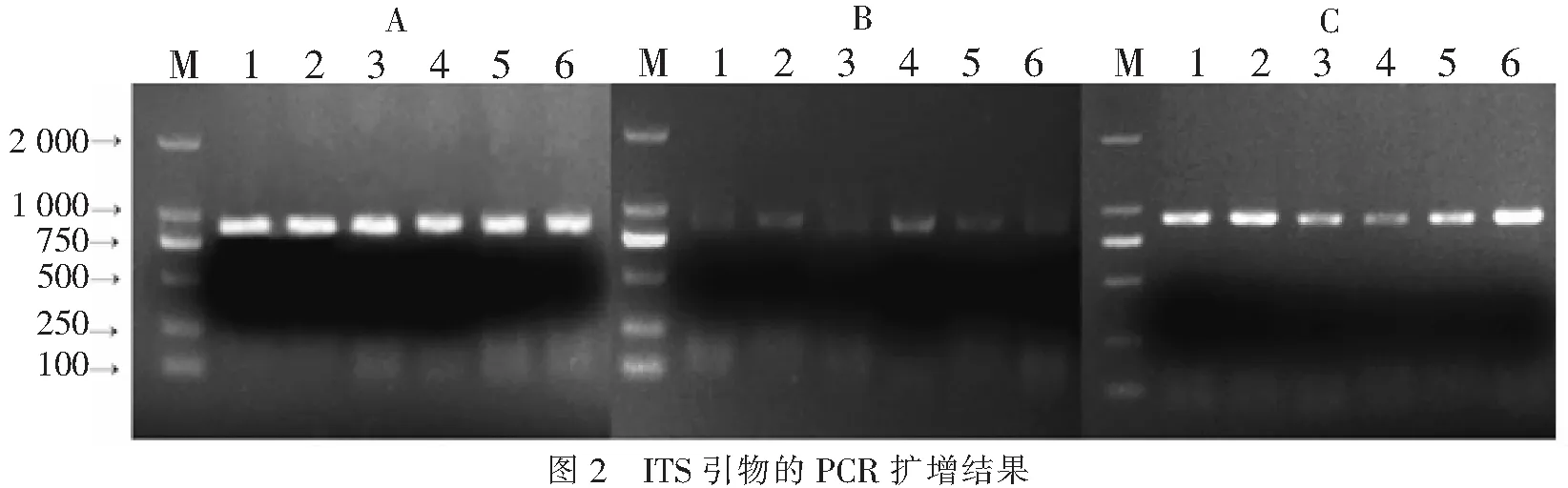
A.改良CTAB法;B.改良SDS法;C.试剂盒法;1.金钗石斛;2.卷萼兜兰;3.春兰;4.矮万代;5.云南火焰兰;6.小兰屿蝴蝶兰
2.3PCR扩增检测DNA的提取质量由图2可看出,采用CTAB法和试剂盒法提取DNA作为模板进行PCR扩增反应得到的条带清晰,亮度较高,稳定性好;SDS法提取DNA作为模板进行PCR扩增反应得到的条带亮度模糊,亮度相对较低,稳定性大大降低;试剂盒法和CTAB法提取DNA作为模板进行PCR扩增效果均获得理想带型,能满足DNA条形码检测鉴定的实验要求。
3 讨 论
濒危兰科植物大多数含有丰富的多糖多酚物质,DNA提取过程中难于分离,尤其多糖的污染是影响植物DNA 纯度的主要问题,多糖的理化性质与DNA相似,容易与DNA 结合产生难溶于水的凝胶状透明沉淀影响DNA沉淀,多糖能抑制限制性核酸内切酶、连接酶及DNA 聚合酶等酶类的生物活性,影响后续的分子生物学研究。本试验采用SDS法提取的DNA可用于一般的PCR 反应,只能满足常规的分子生物学实验要求;CTAB法和试剂盒法所提DNA质量较高,但试剂盒法成本较高,且每次提取DNA量较少,不适用大量提取DNA,在原CTAB法基础上进行改良,加入高盐法去除杂质,可防止沉淀过程中酚化合物氧化降解以及电离化作用,以保证提取的DNA质量,同时通过2步沉淀法,减少蛋白质、多糖等其它杂质的影响,可提高DNA纯度。改良CTAB法提取DNA浓度高,质量较好,操作简单,相比试剂盒法成本低廉。目前,有关兰科植物DNA提取方法仅局限于春兰、卡特兰、石斛兰和蕙兰等特定的原生种或杂交种中[6-10],主要针对兰科特定类群的特有属,大多数没有涉及到多糖或多酚类物质含量丰富的类群,改良CTAB法解决了兰科植物DNA提取方法适用性差的问题,可广泛应用于兰科植物分子生物学研究。
